大肠杆菌致脑膜炎小鼠模型的构建及脑脊液采集方法的改建
钟昊然,王培莉,黄蓝田,孟 霞,李建基,朱国强,崔璐莹,董俊升,王 亨*
(1.扬州大学 兽医学院 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;2.教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
大肠杆菌引发的脑膜炎是一种临床上人和动物都颇受关注的感染性疾病,主要由大肠杆菌随血液进入脑部而引发脑膜与脑实质部位的炎症反应,并导致相关损伤[1]。临床上多联合运用脑脊液检查、影像学、病原学检查和血液学检查等进行鉴别诊断[2]。由于各类型脑膜炎缺乏特异性的临床表现,不易鉴别诊断,故建立脑膜炎模型和收集样本方法,对提高诊出率具有重要意义[3]。本试验所用的大肠杆菌TW-XM菌株已被证实能引起雏鸭、雏鸡的脑膜炎[4-5]。
脑脊液(cerebrospinal fluid,CSF)检查是中枢神经系统(central nervous system,CNS)疾病的重要检查方法。脑脊液的性状和成分变化可反映疾病的类型和程度,所以当CNS受损时,常进行脑脊液的辅助检查。但由于小鼠的脑室及蛛网膜下腔狭小,血管丰富,导致小鼠脑脊液采集过程复杂,失败率较高[6]。本研究通过腹腔注射大肠杆菌构建了大肠杆菌致小鼠脑膜炎模型,并改良了传统小鼠脑脊液的采集方法,为脑脊液收集和进行脑膜炎疾病诊疗提供相应的思路和方法,同时也为脑膜炎致病机制的研究奠定基础。
1 材料与方法
1.1 实验动物SPF级雄性(institute of cancer research,ICR)小鼠20只,4周龄,体质量20~30 g,购于扬州大学比较医学中心,每天12 h光照,12 h黑暗循环。饲养过程中给予全价饲料,自由饮水。
1.2 菌株和主要试剂与仪器大肠杆菌TW-XM菌株由扬州大学朱国强教授馈赠。眼科剪、眼科镊购自苏州六六视觉科技有限公司;20 μL微量采血吸管购自江苏康健华医疗用品有限公司;LB培养基购自英国Oxoid公司;麦康凯琼脂培养基购自青岛高科园海博生物技术有限公司;Diff-Quik染色液购自南京建成科技有限公司;异氟烷购自山东科源制药股份有限公司;ExTaq DNA聚合酶购自日本TaKaRa公司;Trans2000 DNA Marker购自北京天根生化科技有限公司;质控标准品、甲酸和基质溶液购自德国布鲁克公司;台式离心机购自德国Eppendorf公司;全自动轮转式切片机购自德国Lecia公司。
1.3 动物模型的构建将保存的APEC TW-XM冻菌液用三区划线法接种于LB平板培养基上,置于37℃培养箱中18~24 h,随后挑取单菌落接种于3 mL液体LB培养基中,37℃、180 r/min培养过夜,过夜培养的菌液按1∶100的比例重新转接到新鲜的3 mL液体 LB培养基中,37℃、180 r/min培养12 h,随后取1 mL菌液5 000 r/min离心5 min后弃上清,用1 mL无菌生理盐水重悬,将菌液的终浓度调整为1×108CFU/mL。将20只4周龄ICR小鼠随机分为2组,空白对照组和大肠杆菌感染组,每组10只。大肠杆菌感染组:每只小鼠腹腔注射0.1 mL菌液(107CFU);空白对照组:每只小鼠腹腔注射0.1 mL生理盐水。
1.4 术前准备及麻醉手术所使用的眼科剪、眼科镊、20 μL微量采血吸管均进行高压灭菌。小鼠术前12 h禁食禁水。手术采样时使用2%的异氟烷混合氧气进行吸入麻醉,并监护小鼠体征。
1.5 脑脊液的采集将小鼠头部垫高,使小鼠头部与躯干成120~135°角。对小鼠颈背部皮肤进行剃毛消毒处理,用眼科剪沿颈背部皮肤正中线作一纵行切口,长度约为1 cm,钝性分离颈背部肌肉,暴露头后小直肌,将改造的微量穿刺管(图1),刺入枕骨大孔直至硬脊膜(图2),当有明显的落空感时,停止刺入,可见到清亮的脑脊液沿微量吸管缓慢上升。当管内脑脊液的液面高度停止上升时,将吸管退出,可取到3~5 μL脑脊液。
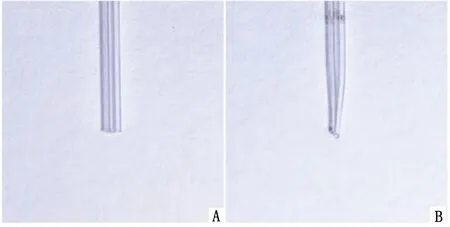
A.处理前;B.处理后
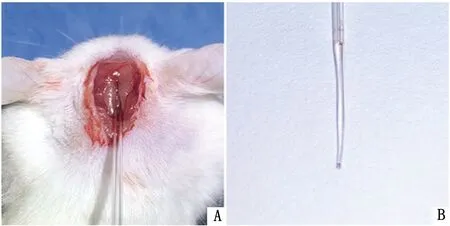
A.经肌肉穿刺延髓池;B.微量穿刺管采集到的脑脊液
1.6 脑脊液染色镜检将脑脊液涂片,固定,并进行Diff-Quik染色,镜检。
1.7 细菌的分离及纯化将采集的感染组小鼠脑脊液涂布于麦康凯琼脂培养基,37℃ 恒温培养箱培养18~24 h。挑取单菌落,转培进行纯培养,后涂片,进行革兰染色镜检。
1.8 分离菌的鉴定根据GenBank中APEC TW-XM菌株(NO.KF678349.1)已知的基因序列设计特异性引物:上游引物5′-TCATGGGTGGAAAATGCCGA-3′、下游引物3′-GGTGTCCTGGCCCTT-TCAAA-5′,引物由南京擎科生物技术公司合成。以超纯水作为阴性对照,攻毒所用的TW-XM菌株作为阳性对照,用PCR方法鉴定脑脊液中分离纯化的细菌。PCR反应体系为ExTaq DNA聚合酶12.5 μL,上、下游引物各1.0 μL,细菌DNA模板1.0 μL,补ddH2O至25.0 μL。PCR程序为94℃ 4 min;94℃ 30 s,57℃ 30 s,72℃ 30 s,25个循环;72℃延伸10 min。用10 g/L 琼脂糖凝胶电泳在0.5×TBE电泳缓冲液中进行电泳分析。若出现200 bp的特异性扩增条带则为阳性,否则为阴性。鉴定正确后由南京擎科生物技术公司进行测序比对。
1.9 脑组织病理学检查采用脱颈法安乐小鼠,收集大脑组织。将采集的样品,置于10%中性甲醛溶液中,固定48 h后取出,流水冲洗12 h;进行乙醇梯度脱水、二甲苯透明及浸蜡后包埋于石蜡中;常规切片,采用苏木精和伊红染色,封片后镜检。
2 结果
2.1 小鼠临床症状检查结果感染12 h后,感染组小鼠出现精神沉郁、倦怠懒动、被毛粗乱、眼分泌物增多、拉稀并伴有癫痫、角弓反张等神经症状(图3)。空白对照组小鼠则精神状况良好、被毛平滑有光泽、运动自如。
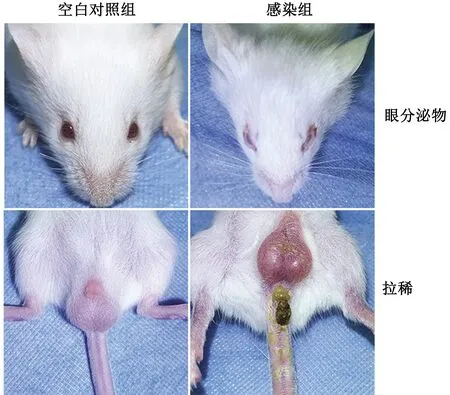
图3 小鼠临床症状观察
2.2 小鼠脑脊液性状及染色镜检感染12 h后,采集各组小鼠脑脊液。Diff-Quik染色后于显微镜下观察,可见感染组小鼠脑脊液中含有杆状菌落,而空白对照组小鼠脑脊液中未见杆状菌落(图4)。
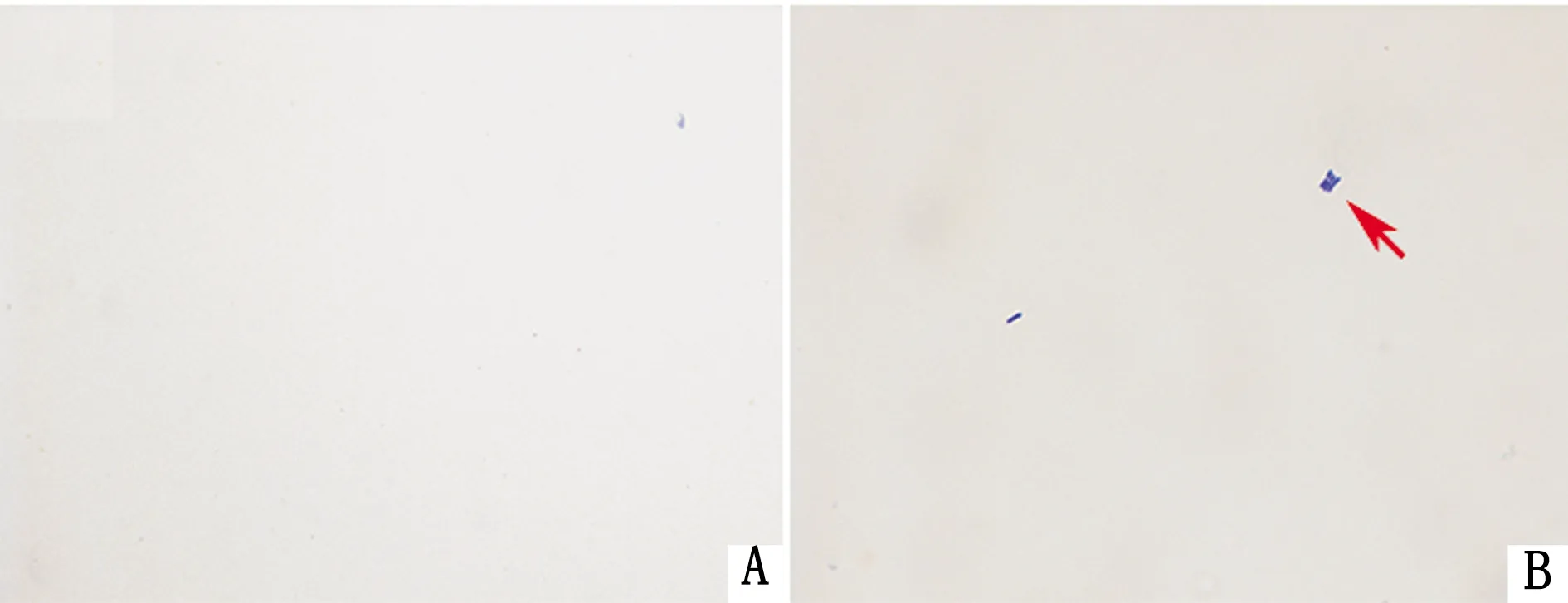
A.空白对照组;B.感染组;红色箭头.杆状菌落
2.3 细菌形态观察及革兰染色结果将采集的感染组小鼠脑脊液涂布于麦康凯琼脂培养基,37℃ 培养24 h后可见菌落呈圆形,微红色,边缘整齐,菌落表面光滑,湿润(图5A)。革兰染色观察结果显示细菌为革兰阴性菌,两端钝圆,短杆棒状(图5B)。
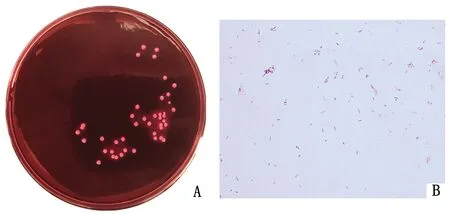
A.细菌培养形态;B.革兰染色镜检结果(1 000×)
2.4 组织病理学检查脑膜和大脑皮层的HE染色切片结果显示,空白对照组小鼠脑膜正常且连续,与大脑皮层贴合紧密(图6A)。感染组小鼠脑膜增厚、水肿、出血,脑膜及脑实质血管扩张充血,大脑皮层有嗜中性粒细胞浸润现象,大脑皮层坏死崩解(图6B)。
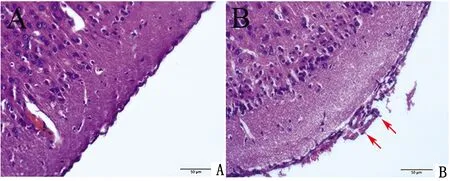
A.空白对照组;B.感染组
2.5 特异性片段扩增结果根据TW-XM菌株的序列设计特异性引物,用PCR方法对脑脊液分离菌进行鉴定。结果显示阳性对照和所有分离菌均能扩增出200 bp的条带,阴性对照未能扩增出相应条带(图7),且测序验证结果正确,说明分离菌与TW-XM的分子特性相符。
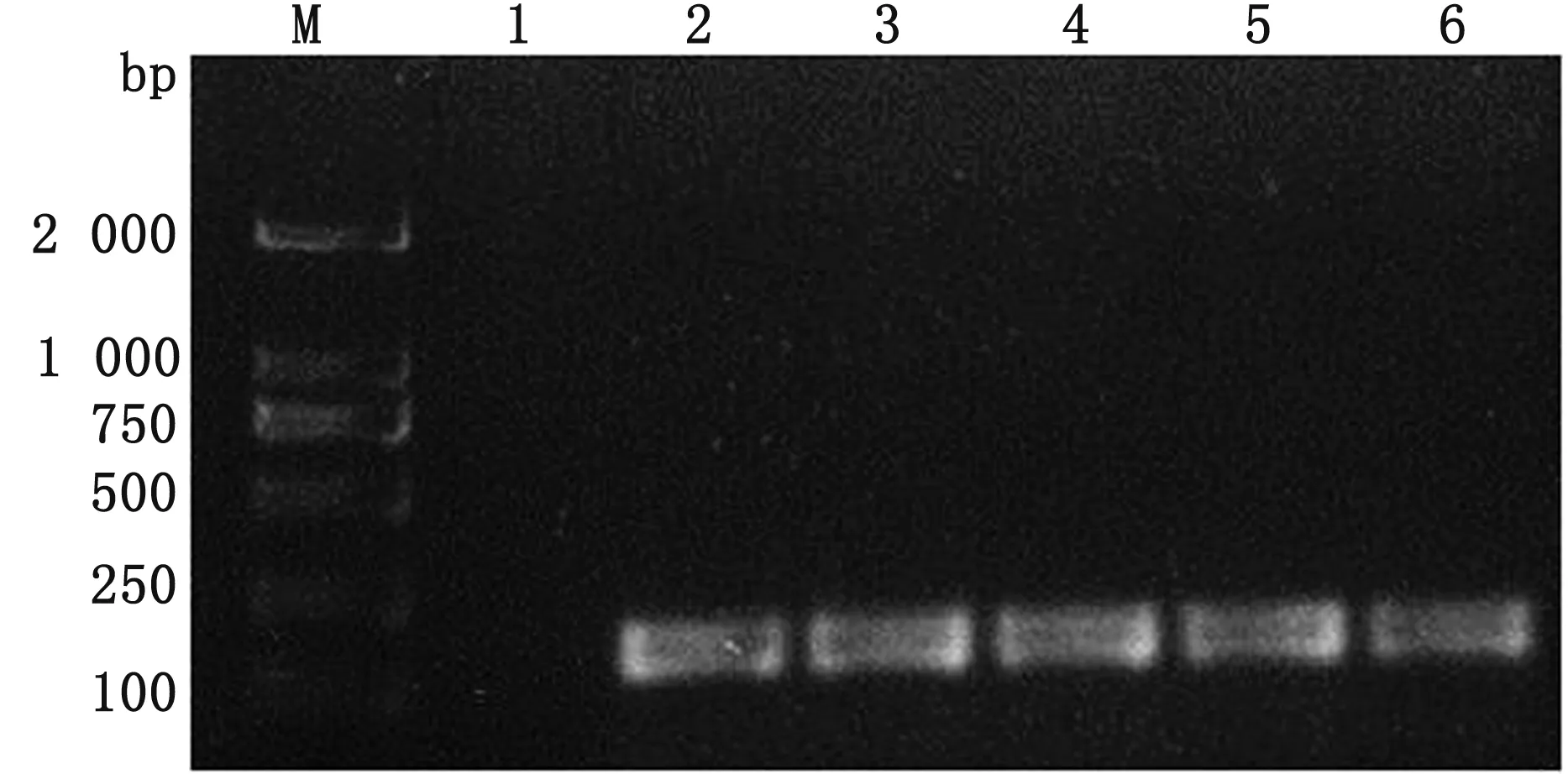
M.Trans2000 DNA Marker;1.阴性对照;2.阳性对照TW-XM;3~6.脑脊液分离菌
3 讨论
细菌性脑膜炎是世界十大威胁生命的感染性疾病之一,其病原菌存在地区差异性[7]。发达国家的脑膜炎致病菌主要为脑膜炎奈瑟菌和肺炎链球菌;而发展中国家的脑膜炎致病菌则更加多样,主要为单增李斯特菌和大肠杆菌[8]。但由于各类型脑膜炎的临床症状不具有特异性,诊断难度较大。上述各种细菌能破坏或者穿越血-脑屏障(blood-brain barrier,BBB),进而对脑部进行侵袭和破坏,而大部分药物无法穿越BBB到达脑部,使治疗难度进一步增加,导致病死率高且预后不良[8-9]。研究表明发展中国家的新生儿与老年患者的病死率更高[7,10]。
细菌性脑膜炎对畜禽养殖业的危害同样巨大,其典型症状为家畜头颈伸直、发热、癫痫、肢体运动障碍等神经症状和脑缺血、脑积液和颅内压增高等中枢神经系统损伤,若产生过度炎症反应则预后不良[11]。禽致病性大肠杆菌(avian pathogenicE.coli,APEC)TW-XM菌株已被证实能引起雏鸭和雏鸡的脑膜炎,且TW-XM与新生儿脑膜炎大肠杆菌(neonatal meningitisE.coli,NMEC)的基因型高度同源,故对该菌株的研究具有重要的公共卫生学意义[4-5,12]。
目前,已有研究报道了多种不同方法建立的细菌性脑膜炎动物模型。董燕等[13]通过小脑延髓池注射肺炎链球菌菌液成功构建大鼠脑膜炎模型,周程远等[14]利用相同的攻菌方法成功构建犬大肠杆菌型脑膜炎模型,而小鼠脑室及蛛网膜下腔狭小,故该方法不适用于小鼠脑膜炎模型的构建。李慧等[15]采用腹腔注射粪肠球菌菌液成功构建了小鼠脑膜炎模型,证明通过腹腔注射细菌菌液构建小鼠脑膜炎模型存在可行性。本方法中,在腹腔注射大肠杆菌TW-XM菌株12 h后,感染组小鼠出现精神沉郁、倦怠懒动、被毛粗乱、眼分泌物增多、拉稀并伴有癫痫、角弓反张等神经症状;采集的脑脊液经Diff-Quik染色后可见感染组小鼠脑脊液中含有杆状菌落,说明大肠杆菌已穿越BBB进入脑部;脑部组织病理学观察可见感染组小鼠脑膜增厚、水肿、出血,脑膜及脑实质血管扩张充血,大脑皮层有嗜中性粒细胞浸润现象,大脑皮层坏死崩解,说明脑部已经发生严重的病理变化。同时,利用革兰染色和分子生物学手段对分离菌进行鉴定,鉴定结果为TW-XM菌株[16-17]。以上试验均可证实大肠杆菌型脑膜炎小鼠模型构建成功。
脑脊液成分变化可以间接反应脑部的生理或病理情况,因此脑脊液的采集分析是CNS疾病诊断常用的技术。各类型脑膜炎的脑脊液检查结果各有不同,当发生细菌性脑膜炎时,脑脊液中嗜中性粒细胞会升高;当发生病毒性脑膜炎时,脑脊液中淋巴细胞会增多。通过观察脑脊液中的异常细胞可以初步诊断出感染类型[3]。脑脊液其他常规检查则包括透明度、颜色以及潘氏试验等,上述试验均可为临床早期的治疗与用药提供参考[18-19]。
由于脑脊液采集方法、材料和技术的限制,脑脊液采集常常成为动物试验中的重要技术之一,尤其在体型小的动物收集更加困难。目前,国内外报道的脑脊液采集方法主要有经皮肤直接穿刺延髓池抽取法、经肌肉穿刺硬脊膜抽取法和暴露硬脊膜直接抽取法[6,20-21]。王伟等[21]利用自制的负压吸引装置,通过皮肤直接穿刺延髓池采集SD大鼠脑脊液,成功率约为75%。朱奕昕等[22]利用脑立体定位仪固定SD大鼠脑部,并用微量进样器分别采用上述3种方法采集大鼠脑脊液,结果显示经肌肉穿刺硬脊膜抽取法的成功率最高。小鼠的脑室及蛛网膜下腔相较于大鼠则更为狭小,脑脊液采集难度更大,经皮肤直接穿刺延髓池抽取法和暴露硬脊膜直接抽取法的失败率较高。故本研究在以往报道的基础上,对经肌肉穿刺硬脊膜抽取法进行以下几点调整:(1)通过自制微量穿刺管,降低材料获取难度及成本;(2)将传统的药物腹腔注射麻醉改为异氟烷吸入麻醉,可根据需要调整麻醉深度,并易于监控小鼠体征。吸入麻醉不仅能降低小鼠在麻醉过程中的应激反应,也能降低因采样操作不当而导致的小鼠死亡率。本方法中的穿刺位置更容易掌握,可减少操作误差,并且能在一定程度上减少因出血而导致的脑脊液污染。
综上所述,通过腹腔注射大肠杆菌TW-XM菌液可成功构建小鼠脑膜炎模型,经过改进的经肌肉穿刺延髓池抽取脑脊液的方法具有简单、快捷、高效等优点,是一种较好的小鼠脑脊液采集方法,并且该方法能成功运用到大肠杆菌致脑膜炎小鼠模型中。该动物模型的构建与脑脊液方法的改良可为小鼠脑脊液的实验室研究提供参考,为脑膜炎致病机制的研究奠定基础。

