河北省部分地区犊牛腹泻大肠杆菌优势血清型筛选及兼性菌毛株的致病性
关一凡,李 妍,高亚桃,常丽云,杨晓彤,贾仲昕,秦建华,赵月兰
(河北农业大学 动物医学院,河北 保定 071000)
犊牛大肠杆菌病(calf colibacillosis)又被称为犊牛白痢,是由某些致病性的大肠杆菌引起犊牛腹泻、脱水、酸中毒及死亡的一种全球性急性传染病。此病呈散发或地方性流行,一年四季均可发生,尤其冬春季节常见。出生1月龄内的牛易感染本病,主要的病理变化大都集中在消化道,有的在脐部或生殖道。大肠杆菌也是一种条件致病菌[1],一般情况下,大肠杆菌存在于人或动物的肠道,与其他有益菌共存,维持肠道菌群平衡状态。在某些因素影响下,导致肠道内致病性大肠杆菌增多,由于犊牛抵抗力低下,难以抵御感染,最终造成大肠杆菌病的发生。大肠杆菌抗原结构复杂多样,至今为止,被发现的O抗原约有180种,K抗原有103种,H抗原有60多种,F抗原有17种[2],而且抗原的种类也在不断变化,常会导致新抗原的产生。据相关学者报道,大肠杆菌可以通过菌毛黏附定居在肠道黏膜的上皮细胞,使肠道黏膜受损,导致功能异常、引发腹泻[3-4]。
近些年来,在我国由大肠杆菌引起犊牛腹泻的发病率高达90%,病死率为40%~50%[5],给我国的养殖业造成了巨大的经济损失。本试验从河北省4个地区奶牛场采集犊牛腹泻粪便,通过对病原的分离鉴定、筛选其优势血清型,并鉴定出菌毛类型,利用小鼠致病性试验分析其毒力,以期为控制犊牛大肠杆菌病的发生提供数据参考。
1 材料与方法
1.1 试验动物21日龄昆明小鼠,购自斯贝福(北京)生物有限公司。
1.2 主要试剂DL1000 DNA Marker、Taq酶、10×Buffer、dNTP等购自大连宝生物工程公司。麦康凯固体培养基、LB液体培养基、Minca培养基、革兰染色液等均购自当地生物公司和化学试剂有限公司。大肠杆菌O因子定型血清诊断液(O101、O9、O78、O102、O2、O38、O104、O137、O64、O15、O141)购自中国兽医药品监察所;细菌基因组DNA提取试剂盒(DP302)购自天根生化科技(北京)有限公司;普通琼脂糖凝胶DNA回收试剂盒购自康为世纪科技(北京)有限公司;细菌生化反应管购自杭州滨和微生物试剂有限公司。
1.3 主要仪器PCR扩增仪购自Biometra;电泳仪购自北京六一仪器厂;化学发光成像系统购自美国Proteinsimple;YS100光学双目显微镜购自Nikon公司。
1.4 引物的合成参考GenBank上公布的EscherichiacoliF41(M21788.1)和K99(M35282.1)菌毛基因序列设计引物:F41F:5′-GCATCAGCGGCAGTATCT-3′,F41R:5′-GTCCCTAGCTCAGTATTATCA CCT-3′;K99F:5′-TATTATCTTAGGTGGTATGG-3′,K99R:5′-GGTATCCTTTAGCAGCAGTATTTC-3′;参考文献[6]设计牛大肠杆菌16S rRNA基因引物序列:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1 492R:5′-TACGGCTACCTTGTTACGACTT-3′。以上引物均委托生工生物工程股份有限公司合成。
1.5 样品的采集从河北省肃宁、定州、望都、曲阳4个地区的奶牛场采集1月龄左右腹泻犊牛的新鲜粪便56份,置于4℃保存,24 h内进行大肠杆菌的分离。
1.6 细菌的分离培养与鉴定将保存的犊牛腹泻粪便样品经生理盐水稀释,均匀涂布于麦康凯培养基表面,37℃培养18 h;挑取单菌落接种于5 mL的LB液体培养基中,37℃、220 r/min培养36 h;按1∶100 的比例将菌液接种于LB液体培养基,37℃ 220 r/min培养36 h;再按同样的将培养后菌液按1∶100 的比例接种于Minca培养基,37℃培养36 h[7]。取培养的菌液经革兰染色,置于1 000倍油镜下镜检,观察并记录菌体形态、大小和染色特性。
经麦康凯鉴别培养基鉴定后的阳性样品,挑取其单菌落,置于LB液体培养基中培养,接种针蘸取菌液接种于硫化氢、苯丙氨酸脱氨酶、枸橼酸盐、尿素、半固体、赖氨酸、鸟氨酸、棉子糖、山梨醇、侧金盏花醇、木糖生化反应管,35℃培养24~48 h,并进行吲哚试验和甲基红试验,观察反应管的现象,鉴定其生化特性。
1.7 分离菌的PCR鉴定及测序鉴定
1.7.1大肠杆菌基因组DNA的提取 将1.6中分离培养菌液按照细菌基因组DNA提取试剂盒的说明书操作,提取细菌基因组DNA,-20℃保存。
1.7.2大肠杆菌16S rRNA基因PCR扩增与测序鉴定 利用牛大肠杆菌16S rRNA引物对提取的细菌基因组DNA进行PCR扩增,预期目的条带长度约1 500 bp。PCR反应体系为:细菌基因组DNA作为:模板1 μL,上、下引物各1 μL,Taq酶0.25 μL,10×PCR Buffer 5 μL,dNTP 4 μL,灭菌水补足至50 μL。PCR反应条件为:预变性98℃ 3 min;变性98℃ 10 s,55℃ 30 s,72℃ 1 min,共循环30次;再延伸72℃ 5 min。PCR产物置于1.5%琼脂糖凝胶进行电泳试验,纯化回收后,送去生工生物工程有限公司进行测序。
1.8 大肠杆菌优势血清型筛选
1.8.1大肠杆菌O抗原的制备 将分离的大肠杆菌株划线接种于麦康凯培养基,37℃培养16 h,挑取单菌落接种于LB液体培养基中,37℃、220 r/min培养12 h;培养好的菌液装入离心管,121℃高压2 h[8]。取高压后的大肠杆菌抗原于离心管中,10 000 r/min 离心2 min,弃上清。使用0.5%石炭酸生理盐水重悬沉淀,此时液体呈浑浊黏稠状,4℃保存[9~11]。
1.8.2大肠杆菌O抗原血清型的鉴定 结合国内学者报道的我国部分地区奶牛场流行的致犊牛腹泻大肠杆菌优势血清型类型,选出11种大肠杆菌 O因子定型血清(O101、O9、O78、O102、O2、O38、O104、O137、O64、O15、O141)分别与制备的大肠杆菌抗原进行玻板凝集试验,鉴定大肠杆菌O抗原的血清型。取大肠杆菌O因子定型血清50 μL滴加到载玻片上,再吸取大肠杆菌抗原 50 μL于玻片上,混匀,呈硬币厚的薄膜状,静置3 min。并用生理盐水做空白对照[12-14]。观察记录是否出现凝集现象,判定大肠杆菌的血清型。
1.9 大肠杆菌菌毛的鉴定对分离鉴定的大肠杆菌进行DNA提取,使用合成的菌毛引物进行PCR扩增。菌毛F41的PCR反应体系为:模板1 μL,上、下引物各1 μL;Taq酶0.15 μL,10×PCR Buffer 2.5 μL,dNTP 2 μL,灭菌水补足至25 μL。PCR反应条件为:预变性98℃ 3 min;98℃ 10 s,55℃ 30 s,72℃ 30 s,共30个循环;72℃ 延伸5 min。菌毛K99的PCR反应体系与菌毛F41的PCR反应体系一致;PCR反应条件为:预变性98℃ 3 min;98℃ 10 s,55℃ 30 s,72℃ 40 s,共30个循环;72℃ 延伸5 min。使用胶回收试剂盒按说明书操作对出现的目的条带进行回收,纯化后的产物进行测序鉴定。
1.10 大肠杆菌致病性试验将分离鉴定的兼性菌毛株O101:F41:K99菌株扩大培养,将菌株菌液稀释成5个浓度,分别是1.5×106,1.5×107,1.5×108,1.5×109,1.5×1010CFU/mL,将21日龄的昆明小鼠分成6组,每组5只,1~5组为试验组,按照5种菌液浓度从高到低分别腹腔注射500 μL菌液;6组为空白对照组,腹腔注射生理盐水500 μL[15]。观察并记录小鼠5 d内的发病和病死情况,解剖小鼠并对有病变的脏器进行细菌分离鉴定。
将分离鉴定的单菌毛菌株O101:F41和O101:K99菌株扩大培养,将菌株菌液稀释成4个浓度,分别是1.5×109,1.5×1010,1.5×1011,8×1011CFU/mL。将21日龄的昆明小鼠分成5组,每组5只,1~4组为试验组,按照4种菌液浓度从高到低分别腹腔注射500 μL;5组为空白对照组,腹腔注射生理盐水500 μL。观察并记录小鼠5 d内的发病和病死情况,解剖小鼠并对有病变的脏器进行细菌分离鉴定。
2 结果
2.1 大肠杆菌的分离鉴定结果从河北省4个地区的奶牛场采集犊牛腹泻的新鲜粪便,经麦康凯培养基鉴别培养,56份犊牛腹泻粪便样品有48份培养基中培养出单菌落,将其编号为DC1-48,有8份未培养出单菌落。肃宁地区和定州地区奶牛场分别采集的12份犊牛粪便样品中均培养出单菌落;首农地区奶牛场18份样品中13份培养出单菌落,5份未培养出单菌落;曲阳地区奶牛场14份样品中11份培养出单菌落,3份未培养出单菌落。可见单个菌落为玫红色、椭圆形,表面呈光滑、湿润的生长状态(图1A)。挑取单菌落经革兰染色后,在1 000倍油镜下观察,可见分离菌为革兰阴性短杆菌(图1B),符合大肠杆菌的形态特征和生长特性。

A.菌落特征;B.菌体特征
将麦康凯培养基鉴别培养后的48份阳性样品培养成菌液后,接种于11种生化反应管,结果可见48份菌液均不产生硫化氢、苯丙氨酸脱氨酶、尿素酶,不能利用枸橼酸盐,在半固体琼脂上不能扩散生长;能使赖氨酸脱羧,但不能使鸟氨酸脱羧;能发酵山梨糖和木糖,但不能发酵侧金盏花醇和棉子糖;甲基红试验和吲哚试验均为阳性结果。以上反应结果均属于大肠杆菌的生化特性,说明48份菌液均为大肠杆菌。
2.2 大肠杆菌16S rRNA基因PCR鉴定结果对分离培养的48份大肠杆菌菌液提取核酸后,经16S rRNA基因PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳检测,均出现特异性目的条带,约为1 500 bp(图2),符合预期结果。

M.DL2000 DNA Marker;1~48.样品16S rRNA基因PCR扩增产物
2.3 大肠杆菌16S rRNA基因序列分析结果经大肠杆菌16S rRNA基因引物PCR扩增后的产物进行测序后,将测序结果与NCBI上公布的大肠杆菌16S rRNA基因序列进行BLAST比对,结果48株分离菌与已发表的大肠杆菌序列同源性均在97%~99.7%范围内,与大肠杆菌MH671460.1同源性最高(图3),说明分离得到的菌株均为大肠杆菌。

1~18.GenBank上发布的大肠杆菌16S rRNA基因序列;19~24.部分分离菌的基因序列
2.4 大肠杆菌优势血清型筛选结果河北省4个地区奶牛场48份犊牛腹泻大肠杆菌抗原与大肠杆菌O因子定型血清经玻板凝集试验鉴定,有36份菌株鉴定出O抗原血清型,12份未鉴定出血清型。其中,肃宁地区12株大肠杆菌中有6份与O101出现凝集,3株与O102出现凝集,1份与O78出现凝集;定州地区12株大肠杆菌中8株与O101出现凝集,1株与O104出现凝集;望都地区13株大肠杆菌,6株与O101出现凝集,3株与O78出现凝集;曲阳地区11株大肠杆菌中4株与O101出现凝集,2株与O102出现凝集,O104和O15各有1株与其出现凝集(表1)。综合来看,48份大肠杆菌抗原有24份与大肠杆菌O101出现凝集反应,占出现凝集反应总数的2/3,表明河北省部分地区犊牛腹泻大肠杆菌的优势血清型主要为O101。

表1 犊牛腹泻大肠杆菌O抗原血清型鉴定结果
2.5 大肠杆菌菌毛鉴定结果利用大肠杆菌菌毛K99和F41基因引物对血清型为O101的24株大肠杆菌进行PCR扩增,鉴定菌毛类型(图4A),有6株大肠杆菌扩增出特异性目的条带,大小约为314 bp,与菌毛基因K99的预期条带大小一致;有7株大肠杆菌扩增出特异性目的条带,约为380 bp,与菌毛基因F41的预期条带大小一致(图4B),其中有1株分离菌可以扩增出菌毛F41基因和菌毛K99基因。

M.DL1000 DNA Marker;A.菌毛K99鉴定结果;A1~A21.菌毛K99基因;B.菌毛F41鉴定结果;B1~B19.菌毛F41基因
扩增的目的基因序列与大肠杆菌K99菌毛基因序列的同源性在94.1%~100%之间,与大肠杆菌K99菌毛MH916617.1序列同源性最高(图5),说明6株大肠杆菌携带的菌毛均为K99。其中兼性菌毛株(O101:F41:K99)扩增的目的基因序列与FJ864678.1、JX987524.1、KR870316.1、KX461930.1、MF955843.1、MH916617.1序列同源性最高,均为99.6%。

1~8.GenBank上公布的大肠杆菌K99菌毛基因序列;9.为兼性菌毛株的K99菌毛基因扩增序列;10,11.部分样品的大肠杆菌K99菌毛基因扩增序列
扩增的目的基因序列与大肠杆菌F41菌毛基因序列的同源性在93.9%~100%之间,与大肠杆菌F41菌毛MF955845.1序列同源性最高(图6),说明7株大肠杆菌携带的菌毛均为F41。其中兼性菌毛株(O101:F41:K99)扩增的目的基因与MF955845.1、M21788.1序列同源性最高,均为100%。

1~6.GenBank上公布的大肠杆菌菌毛F41基因序列;7.部分样品的大肠杆菌F41菌毛基因扩增序列;8.兼性菌毛株的F41菌毛基因扩增序列
2.6 大肠杆菌致病性试验结果大肠杆菌兼性F41-K99菌毛株、F41菌毛株、K99菌毛株通过小鼠致病性试验后,小鼠均在攻毒后24 h内出现死亡,死亡小鼠的病变脏器均分离出大肠杆菌(图7),3种菌株最小致死剂量分别为1.5×1010,1.5×1011,8×1011CFU/mL,说明分离鉴定的3株大肠杆菌均具有较强的致病性。各菌株低浓度剂量组小鼠均出现精神沉郁、食欲不佳、被毛粗糙、两眼半闭、全身颤抖、互相扎堆等症状,表明3株分离菌均具有致病性,其中兼性菌毛株最小致死剂量最低,致病性较强。

A~C.兼性菌毛株病变脏器鉴别培养结果;D~F.F41菌毛株病变脏器鉴别培养结果;G~H.K99菌毛株病变脏器鉴别培养结果
对死亡小鼠进行解剖,兼性菌毛株致死小鼠可见肝脏肿大,肠道弥漫性出血、脾脏肿大,其他脏器未见异常;F41菌毛株致死小鼠肝脏发白,脾脏肿大,肠道弥漫性出血;K99菌毛株致死小鼠,可见脾脏肿大,肠道出血(图8),表明3株分离菌均能引起组织器官的病理变化,兼性菌毛株所引起的病理变化最为严重。根据分离鉴定的3株菌对小鼠的最小致死量大小、各脏器病变严重程度进行比较,得出兼性菌毛株毒力最强,其次是F41菌毛株,最后是K99菌毛株。
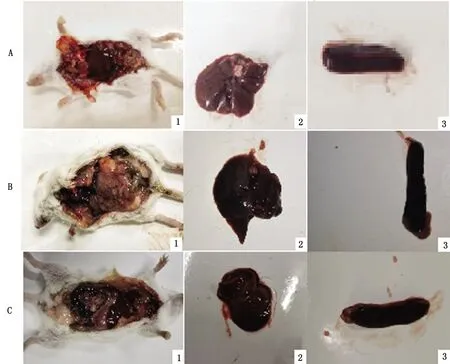
A1.兼性菌毛株致死小鼠各脏器情况;4.F41菌毛株致死小鼠各脏器情况;7.K99菌毛株致死小鼠各脏器情况;A2,B2,C2.肝脏;A3,B3,C3.脾脏
3 讨论
近年来,我国奶牛场规模不断扩大,养殖密度不断增加,在饲养管理条件差和免疫不及时等因素影响下,许多疾病也伴随而来,危害奶牛的健康,给养殖业造成了巨大的经济损失。于大肠杆菌的抗原种类繁多,不同地区不同牛场感染的大肠杆菌血清型也不尽相同,给犊牛大肠杆菌病的防制带来了众多的困扰。本次研究结果证明河北省部分地区犊牛腹泻大肠杆菌优势血清型为O101,为进一步研究和控制大肠杆菌病提供流行病学打下基础。
本试验采用血清学方法鉴别大肠杆菌的O抗原,结果河北省4个地区奶牛场有24份大肠杆菌O抗原均与大肠杆菌O101定型血清出现凝集反应;有10份大肠杆菌抗原分别与O102、O104、O78、O15定型血清出现凝集;但是也有一小部分大肠杆菌未鉴定出血清型。可能是由于大肠杆菌耐高温,在121℃持续2 h也不会改变本身的抗原性,但是位于大肠杆菌细胞壁外侧的决定抗原特异性的脂多糖(LPS)容易受物理或化学因素的影响而发生改变,导致抗原的种类无法识别[16]。也有可能由于大肠杆菌抗原种类复杂多样,导致一小部分大肠杆菌抗原无法被识别。
据报道,大肠杆菌菌毛抗原是引起犊牛腹泻的重要因素之一,菌毛K99和F41是腹泻犊牛和羔羊中常见的2种类型,并且具有较强的免疫原性[17-20]。大肠杆菌和其他革兰阴性菌都是通过菌毛与宿主细胞表面特定受体的结合而产生黏附作用的,所以菌毛黏附素是一类不容轻视的毒力因子。通常一种细菌只表达一种菌毛,但有些菌株可同时表达2种或更多种菌毛,但对细菌携带菌毛种类和毒力强弱关系尚不明确[21]。本试验分离到1株携带F41和K99 2种菌毛的大肠杆菌,又将其与单菌毛F41菌株和K99菌株进行攻毒试验,根据分离鉴定的3株菌对小鼠的最小致死剂量、各脏器病变程度进行比较,得出兼性菌毛株毒力最强,表明细菌携带菌毛种类和毒力强弱关系有一定的正相关性。本试验为下一步研制犊牛腹泻大肠杆菌疫苗提供数据参考。

