早期股骨头坏死动物模型的建立及评价
崔镇海,金美英,李宗洋,谷 天,钱海峰,陶 悦,李驰坤,尹宏兵*,赵文海
(1.长春中医药大学 中医学院,吉林 长春 130117;2.长春中医药大学 附属第三临床医院,吉林 长春 130117;3.长春中医药大学 附属医院,吉林 长春 130021)
股骨头坏死(osteonecrosis of the femoral head,ONFH)是因股骨头缺少血液供应,继而导致股骨头结构改变,股骨头塌陷,引起髋关节疼痛和活动受限[1]。虽然在临床上应用中药治疗股骨头坏死已经得到了一定的成效,但其机理尚未明确。为了深入研究ONFH的病因及防治方法,故需要可行、简单、成功率较高的ONFH的动物模型。以往国内外很多学者选择四足类动物(如大鼠、兔、犬、猪、羊)来建模,其中大鼠模型获取方便、重复性高,且通过使用激素来建立激素性股骨头坏死(steroid-induced avascular necrosis of femoral head,SANFH)动物模型相对可控,故此次选择了SD大鼠。由于大鼠股骨头直径小,并尽可能模拟人类的站立行走,加大股骨头负重,故建立直立+单纯激素的模型,继而通过影像学、生化血清实验数据综合评价出股骨头坏死的病情变化,为早期股骨头缺血性坏死的治疗提供坚实的理论基础。
1 材料与方法
1.1 实验动物50只雄性SD大鼠(SPF级),体质量100~130 g,购自辽宁长生生物技术股份有限公司(许可证号:SCXK(辽)2015-0001)。动物分笼饲养,5只/笼,正常喂食水,自然光照,适应性饲养。后期作为试验补充再次购进SD大鼠10只(SPF级),体质量350~400 g,购自辽宁长生生物技术股份有限公司(许可证号:SCXK(辽)2015-0001)。刚购进动物作为空白对照组,正常饲养。试验过程中对动物处置符合2006年科技部发布的《关于善待实验动物的指导性意见》。
1.2 药物及主要试剂注射用甲泼尼龙琥珀酸钠(注册证号:HC20160039,规格:40 mg×10瓶,产品批号:1E8170),南光化学制药股份有限公司产品。戊巴比妥钠溶液、生理盐水、蒸馏水、动物饲料、垫料、饲养笼、操作台、试剂盒,均由长春中医药大学动物中心提供。苏木精、伊红、中性树脂封固剂等辅助试剂由长春中医药大学附属医院提供。
1.3 主要仪器TDL-5M医用离心机由长春中医药大学动物中心提供。CT使用X射线计算机断层摄影设备(TOSHIBA),型号:ActivionTSX-031A,最多输出功率(120 kV 300 mA;135 kV 260 mA)由长春中医药大学动物中心提供。
1.4 动物分组及造模按照体质量随机将实验动物分为4组:空白组12只,激素组16只,激素+直立组16只,直立组16只。试验于2019年7月10日-2019年12月21日在长春中医药大学动物中心完成,采用激素+直立诱导大鼠激素性股骨头坏死模型。
激素组和激素+直立组、直立组动物按体质量用3%戊巴比妥钠溶液(1 mL/kg)腹腔注射麻醉后,将其双前肢剪毛和清洁后,用碘伏消毒大鼠上肢皮肤,取前臂近端1/3处横向切开皮肤,剥离筋膜和肌肉,暴露三角肌下血管神经束,并用丝线结扎,在结扎处远端用咬骨钳咬断肱骨,再用剪刀剪断皮肤、肌肉、血管和神经,使上肢截断。再将肌肉、筋膜、皮肤逐层缝合,最后再缝合处涂青霉素防止感染。使大鼠逐步抬高饮食。
正常饲养2个月后,臀肌注射激素药物40 mg/kg,每日1次,连续6 d。激素组注射激素时间、剂量同模型组。直立组、正常组同时间注射同剂量生理盐水。
1.5 标本制作造模后正常饲养3个月后,分批麻醉(20%乌拉坦溶液,0.5 mL/100g),拍CT片。腹主动脉取血,加0.1%肝素抗凝,取1 mL全血用血流变仪测定其全血黏度。3 000 r/min离心15 min,取1 mL血浆,测定其血浆黏度;血浆剩余部分于-20℃冻存备用;取大鼠双侧股骨头、肝脏,放置于10%甲醛溶液中固定,备用。后期利用乙醇脱水,常规石蜡切片(片厚3~5 μm),包埋,依次做好标记。脱蜡和水化后常规苏木精伊红染色,光镜下观察。
1.6 测定指标
1.6.1一般观察 造模后即开始观察动物精神、毛发、饮食、二便、体质量及活动状况。
1.6.2死亡现象观察 记录动物死亡时间,并分析死因,统计各组的最终死亡数量。
1.6.3血清生化及血液流变学检查 造模后取血,以测定血清生化(高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、甘油三酯(TG)、总胆固醇(CHO))及血液流变学(全血3.0,30.0,100.0,180.0)数值。
1.6.4病理组织学检查 光镜下观察组织学切片,肝组织细胞的变化以及骨细胞坏死病理改变以空骨陷窝率体现,即在100倍放大率下,任选5个视野,经ipp6.0图像分析软件计算单位视野骨小梁面积百分比和空骨陷窝所占百分比。
1.6.5CT观察 分别于用药后8,16周,分批取双髋蛙式位固定于实验动物台上,进行CT检测。

2 结果
2.1 一般形态观察结果4组动物股骨头仍保持圆形,但激素组和激素+直立组动物的股骨头色泽灰暗,局部充血明显,骨质松脆,易于凿开,软骨面光滑,软骨未见明显塌陷,切面肉眼观察未见明确的坏死灶。
2.2 血清生化及血液流变学(试验对血脂各项指标的影响)
2.2.1血清生化指标的变化 结果见表1。HDL分析结果显示,直立组与直立+激素组的标准差相比较小,说明相同造模条件下,予以直立或增加直立方法诱导建立模型的方法的稳定性更好;激素组P<0.01,具有显著性差异,说明激素可以引起HDL的增高且具有统计学意义;直立+激素组的标准差相比较大,说明相同造模条件下,予以联合方法诱导建立模型的方法的稳定性欠佳,空白组数值分别与其余3组比较,差异具有统计学意义(P<0.05)。LDL分析结果显示,4组标准差中直立+激素组的数值相比较大,说明相同造模条件下,予以联合方法诱导建立模型的方法的稳定性欠佳;试验组与空白组相比较,P值均>0.05,无统计学意义。CHO分析结果所示,直立组与直立+激素组的均值较高,说明通过诱导直立状态对CHO的影响较大,直立+激素组的标准差相比较大,说明相同造模条件下,予以联合方法诱导建立模型的方法的稳定性欠佳;试验组P值均>0.05,差异无统计学意义;组间对照中,激素组与空白组对照,差异具有统计学意义,(P<0.05)。TG分析结果显示,直立+激素组的标准差相比最小,说明相同造模条件下,予以联合方法诱导建立模型的方法的稳定性最佳,组间对照中空白组分别于激素组及直立+激素组的差异具有统计学意义(P<0.05),空白组与直立组的差异无统计学意义(P>0.05)。
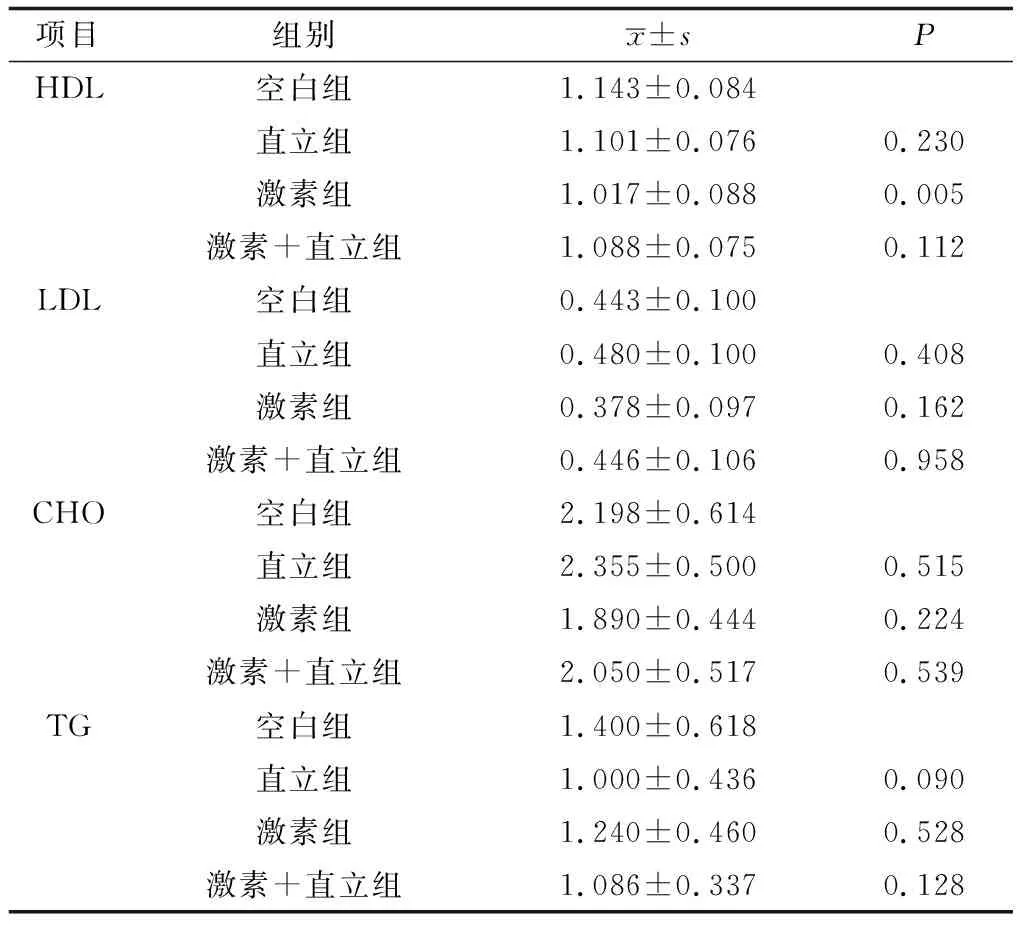
表1 试验对血脂指标的影响
2.2.2试验对血液流变学的影响 结果见表2。血流变全血3.0分析结果显示,激素组与直立+激素组的标准差相比较小,说明相同造模条件下,予以激素及联合激素方法诱导建立模型的方法的稳定性更好;激素组与直立+激素组的均值相对较小,可见本方式对以上2组全血3.0数值的影响较大,组间对照直立+激素组P<0.05,具有显著性差异,说明直立联合激素对全血3.0组有显著影响,且P<0.05,具有统计学意义,其余试验组P值均>0.05,无统计学意义。血流变全血30.0分析结果显示,激素组与直立+激素组的标准差相比较小,说明相同造模条件下,予以激素方法诱导建立模型的方法的稳定性更好;组间比较各试验组P值均>0.05,无统计学意义。血流变全血100.0分析结果显示,直立+激素组均值明显高于其余3组,说明本方法对全血100.0的影响较大,4组标准差中直立+激素组的数值最大,且与其他组差距明显,说明相同造模条件下,予以直立+激素方法诱导建立模型的方法的稳定性较差;组间对照激素组P值<0.05,具有显著性差异,说明激素对全血100.0组有显著影响,且具有统计学意义,P<0.05,其他试验组P值均>0.05,无统计学意义。血流变全血180.0分析结果显示,4组标准差中激素组的数值相比较小,说明相同造模条件下,予以激素方法诱导建立模型的方法的稳定性更好;且激素组的均值相对较小,说明通过单纯使用激素对全血180.0组有显著影响,且具有意义,P<0.05,组间对照其他试验组P值均>0.05,无统计学意义。
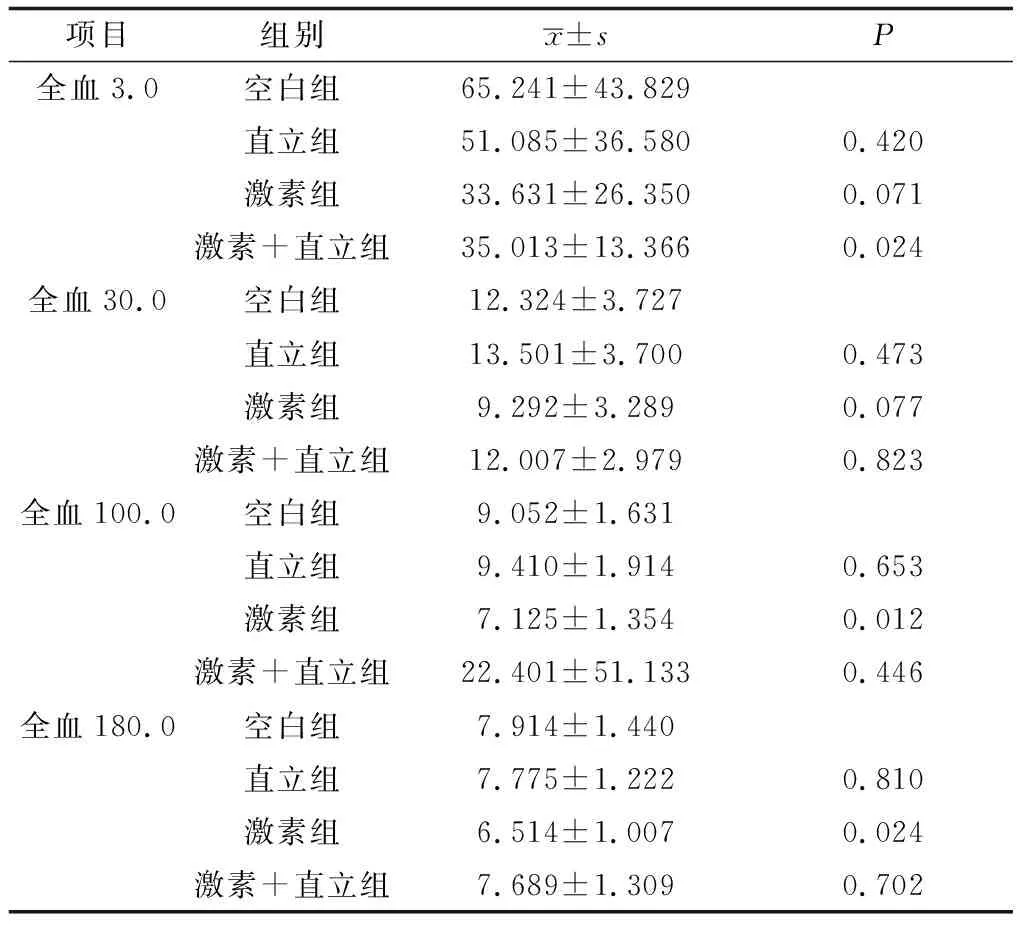
表2 试验对血液流变学的影响
结果表明,单纯运用直立方式建立大鼠股骨头坏死较为困难,且对血液流变学及血脂影响较小,效果不佳;使用激素及激素联合诱导大鼠直立建立大鼠股骨头坏死模型且对有一定效果,对血液流变学及血脂均具有一定影响;而激素联合直立建立大鼠股骨头坏死在4组里效果最佳,对血液流变学及血脂影响最大。
2.3 影像学变化CT结果所示,在试验进行第8周时,每组取2只大鼠,4组动物均未见骨缺血坏死表现。第16周时,空白组及直流组,均未见骨缺血坏死病变。激素组及激素+直立组,骨小梁密度不均匀增粗,斑片状高密度硬化带影,边缘模糊,股骨头前上部硬化周围和边缘部出现类圆形低密度区,局部骨质疏松(图1)。
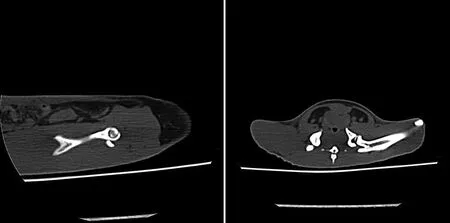
图1 CT扫描横断面(左,16周)和矢状位(右,16周)
2.4 病理学变化
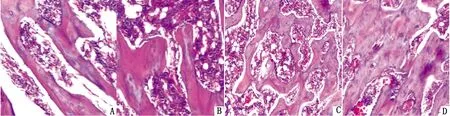
2.4.1肝脏变化 小叶中央静脉附近有炎细胞浸润,小叶中央区肝细胞(水样变性),胞浆疏松化,肝窦变窄(图2A)。小叶中央静脉增宽,小叶中央区肝细胞胞浆淡染,少量肝细胞脂肪变性,肝索排列基本整齐(图2B)。小叶中央静脉居中,肝细胞索排列整齐,以小叶中央静脉为中心,向四周放射状,汇管区可见,动脉、静脉、胆管(图2C,D)。
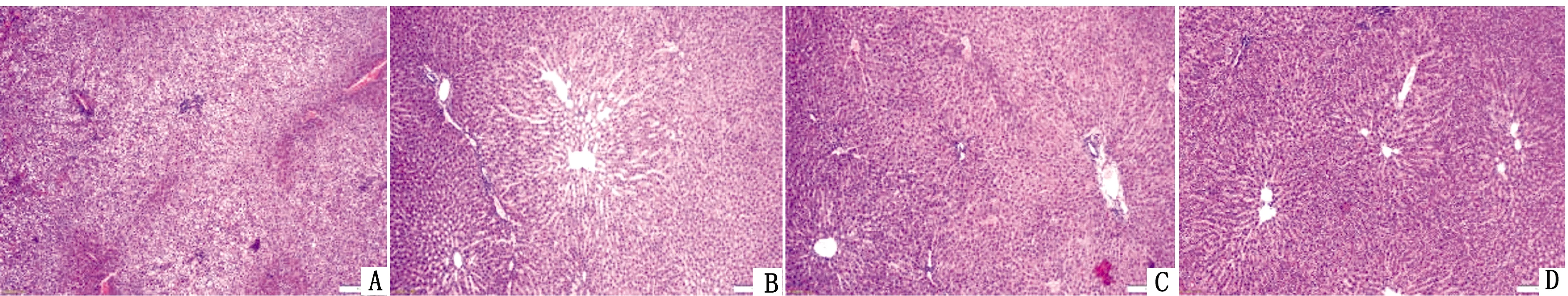
A.激素+直立组;B.激素组;C.直立组;D.空白组
2.4.2空骨陷窝率 使用3%戊巴比妥钠溶液(1 mL/kg)腹腔注射麻醉处死4组大鼠,经后外侧切口取双侧股骨头,剔除股骨头周围肌肉和软组织后,便可从感官上看出股骨头外形有着细微改变和关节软骨面变化,而后用刀将股骨头从冠状面劈为两半,放到10%中性甲醛中固定7 d后再在5%硝酸溶液中浸泡3 d进行脱钙。使用针灸的针扎入股骨头中,可完全扎入视为脱钙完全。然后在用梯度乙醇脱水。经乙醇常规梯度脱水和常规石蜡包埋,把股骨头放到切片机上切出4 μm的连续切片,然后将切片后脱蜡,用苏木精-伊红进行常规染色,将切片用OLYMPUSBX61正置显微镜分析切片结构。利用高倍镜镜片分析每一切片,选择5个观察点统计出数量为50个骨细胞的空骨陷窝阳性数,进行空骨陷窝率计算。病理学把衡量激素性股骨头缺血性坏死的确诊技术参数标准是:在骨小梁中存在大量空骨陷窝的形成或者核固缩现象,存在着伴有周围骨髓细胞坏死的现象,而试验中具有这种表现至少1处坏死病症的实验动物可确诊为股骨头坏死(表3,图3,4)。
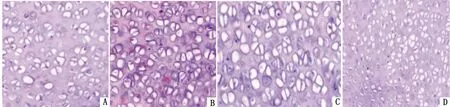
A.空白组;B.直立组;C激素组;D.激素+直立组

表3 试验对股骨头结构的影响 %
结果说明,单纯建立直立或者激素动物模型,相对空白组而言无明显差异,而使用激素联合直立2种方式建立模型的方式对模型动物的空骨陷窝率及骨小梁面积百分比均有较大影响。
A.空白组;B.直立组;C激素组;D.激素+直立组
3 讨论
据报道,激素性股骨头坏死有着较高的致残率,JONES等[2]发现糖皮质激素会诱发ONFH,但截止目前学者们还没有一致的发病机制的研究。因此,能够制备理想的ONFH的动物模型,是探究ONFH病因及发病机制十分重要的手段,也是为今后临床工作提供基础依据。根据文献报道,目前建立股骨头坏死动物模型的方法主要有:直立法[3-5]、物理法[6-7]、化学法[8]和非创伤法[9-11]。
激素引起ONFH的机制尚未明确,目前3种假说如脂肪代谢紊乱、血管内凝血和骨质疏松。激素影响内分泌调节紊乱导致局部血脂增高,易堵塞微小血管,进而导致ONFH。在足量的激素刺激下,股骨头局部容易发生高凝状态及血管内凝血,很有可能导致ONFH。目前,医学界对于ONFN的病理演变过程已具备一定的认识,一般认为,首先出现骨细胞的坏死,继而通过血管再生,从而出现新骨的形成与死骨的吸收[12]。ONFN的病理改变主要是脂肪代谢紊乱。
目前,在激素造模动物试验中,激素种类的选取以及激素用量尚未有统一的标准,随之导致的动物模型坏死部位亦不确定性;当前选择四足动物在ONFH建模中运用较多,但其四足动物与人类负重方式有着明显的差异,因此如何使其与人类负重方式相接近需要进一步探索,并通过一些人为干预采取双足站立或许是一种解决方式。
在本试验中,试验组(激素+直立组)用药8周后未见股骨头塌陷等;用药16周后出现骨小梁密度不均匀增粗,斑片状高密度硬化带影,边缘模糊,股骨头前上部硬化周围和边缘部出现类圆形低密度区,局部骨质疏松。本研究也存在着一些不足:一方面研究的样本量相对较少,应用2~4倍的激素剂量后有个别出现不良反应,因而在数据统计分析时说服力较弱;另一方面试验组观察的时间较短,不利于动态观察ONFH的病理和影像学变化。此外,四足动物造模的最大限制在于其与人类髋关节负重模式有很大不同,因为大鼠在患侧疼痛情况下会采取保护性肢体回缩,同时给模型的建立提升了难度。

