亚铁氰化钾分光光度法测定微量铁含量
吴小说,夏婷,岑呈安,陈建兵
(1.池州学院 材料与环境工程学院,安徽 池州 247000;2.神华工程技术有限公司安徽分公司,安徽 合肥 230041)
铁元素广泛存在于地壳中,是人们日常生活和社会生产中使用最广泛、用量最大的金属元素之一,也是人体生命活动必需的微量元素之一。紫外可见分光光度法是测量微量铁含量的重要方法之一,常用的显色试剂有邻二氮菲、2,2’-联吡啶、硫氰化钾、磺基水杨酸、苯基荧光酮、铁氰化钾、偶氮试剂等[1-9]。目前使用的显色剂大多与Fe2+离子显色,在实际操作中,Fe2+离子易被空气中的氧气氧化,使测量的标准曲线线性不够理想[10]。本文利用稳定性更好的Fe3+离子与亚铁氰化钾反应生成稳定的普鲁士蓝在可见光区有特征吸收,建立了一种微量铁含量测量方法。
1 实验部分
1.1 试剂与仪器
硫酸铁铵、亚铁氰化钾、双氧水(30%)、硫酸溶液(3 mol/L)均为分析纯。
722N型可见分光光度计;U-3900型紫外可见分光光度计;FA2004N型电子天平;DHG-9036A型电热鼓风干燥箱。
1.2 溶液的配制
1.2.1 Fe3+铁标准溶液(0.1 mg/mL) 准确称取硫酸铁铵0.215 9 g,置于100 mL烧杯中,加入 30 mL 去离子水和5 mL 3 mol/L H2SO4溶液,溶解后转移至250 mL容量瓶中,用去离子水稀释至刻度,摇匀。使用时再稀释为0.01 mg/mL工作液。
1.2.2 6 g/L亚铁氰化钾溶液 称取0.3 g亚铁氰化钾,溶于50 mL去离子水中。
1.2.3 0.3%双氧水溶液 将30%双氧水溶液用去离子水稀释至0.3%。
1.2.4 0.15 mol/L硫酸溶液 将3 mol/L硫酸溶液用去离子水稀释至0.15 mol/L。
1.3 实验原理
在pH=1~3的条件下(为了防止Fe3+离子的水解影响测量结果),Fe3+离子与亚铁氰化钾反应生成稳定的蓝色络合物普鲁士蓝,在700 nm 处有最大吸收。Fe3+离子浓度在一定范围内与吸光度值符合朗伯比尔定律,适用于微量铁含量的测定。反应方程式如下:
Fe3++K++[Fe(CN)6]4-→KFe[Fe(CN)6]
1.4 实验方法
加入体积≤10.00 mL的0.01 mg/mL Fe3+铁标准溶液于25 mL比色管中,依次加入 0.15 mol/L 硫酸溶液1.0 mL(控制pH=1~3)、6 g/L亚铁氰化钾溶液1.0 mL,用去离子水稀释至刻度后摇匀,以试剂空白为参比,在500~900 nm波长范围内进行光谱扫描,测量结果见图1。
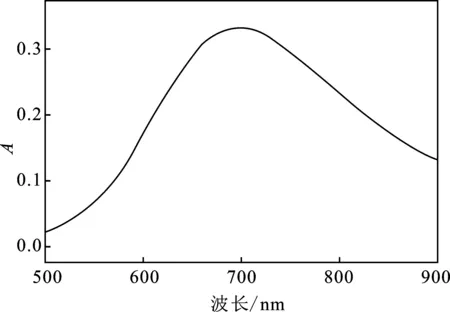
图1 吸收曲线Fig.1 Absorption curve
由图1可知,最大吸收波长为700 nm。故选择700 nm为测定波长。
2 结果与讨论
2.1 显色时间的影响
取Fe3+铁标准溶液10.00 mL,按实验方法配制溶液,以试剂空白为参比,测定不同显色时间条件下的吸光度,绘制吸光度-显色时间曲线,见图2。

图2 显色时间与吸光度关系图Fig.2 Diagram of chromogenic time and the absorbance
由图2可知,显色时间30 min时,吸光度值达到最大值,之后随着显色时间的增加,吸光度值基本保持稳定。故选择30 min为显色时间。
2.2 显色剂用量的影响
准确移取8份10.00 mL Fe3+铁标准溶液,置于25 mL比色管中,分别加入0.15 mol/L硫酸溶液1.0 mL、0.1~1.2 mL 6 g/L亚铁氰化钾溶液,显色30 min后,在最大吸收波长700 nm处测定不同显色剂用量样品的吸光度,绘制吸光度-显色剂用量曲线,见图3。

图3 显色剂用量与吸光度关系图Fig.3 Diagram of addition of chromogenic agent and the absorbance
由图3可知,显色剂加入量>0.3 mL时,吸光度值达到最大,之后随着显色剂加入量的增加,吸光度值保持稳定,由于显色剂需要过量加入来保证显色完全,而显色剂稍过量还可以加快颜色时间,故在实际测量时选择的显色剂加入量为1.0 mL。
2.3 标准曲线
分别移取 0.00,2.00,4.00,6.00,8.00,10.00 mL Fe3+铁标准溶液于25 mL比色管中,分别加入 0.15 mol/L 硫酸溶液1.0 mL,6 g/L亚铁氰化钾溶液 1.0 mL,用去离子水稀释至刻度,摇匀,静置 30 min 后,测定各溶液在700 nm波长处的吸光度。以铁含量(c,μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,结果见图4,线性回归方程为A=0.171 54c+0.004 43,相关系数R2=0.999 6。
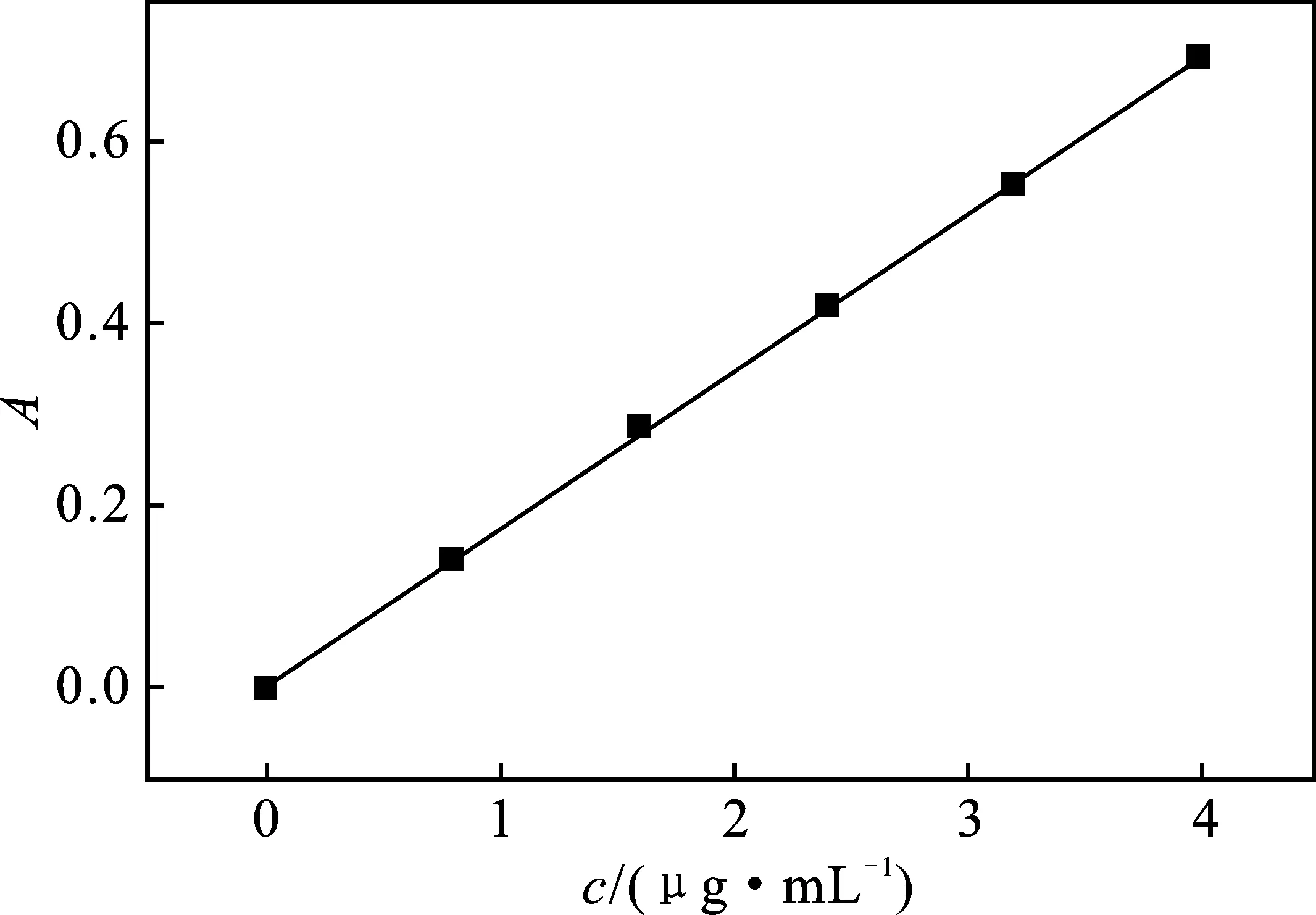
图4 标准曲线Fig.4 Standard curve
2.4 铁氰化钾的影响
该方法在实际应用时利用双氧水为氧化剂,将测量体系中的铁离子氧化为Fe3+离子。为了保证氧化完全,双氧水需要过量加入,过量的双氧水会将部分亚铁氰化钾显色剂氧化为铁氰化钾,而铁氰化钾本身具有荧光黄色,测量体系的颜色会变为黄绿色。为了探究铁氰化钾的存在对测量结果的影响,测量了铁氰化钾水溶液的吸收曲线,见图5。
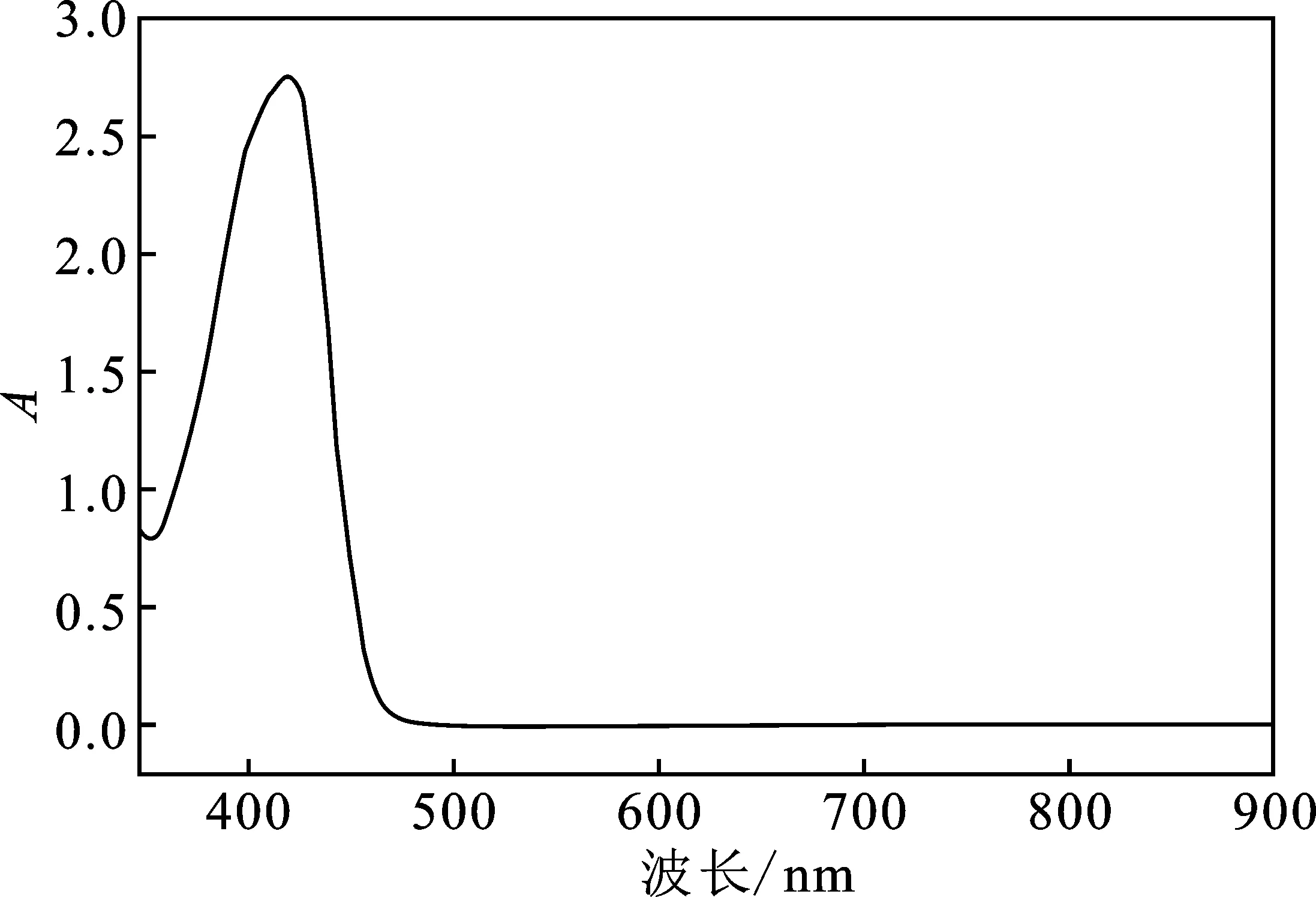
图5 铁氰化钾水溶液的吸收曲线Fig.5 Absorption curve of potassium ferricyanide aqueous solution
由图5可知,铁氰化钾溶液在700 nm波长处几乎没有吸收,说明在测量过程中铁氰化钾呈现的荧光黄色对测量结果没有明显影响。
2.5 共存离子的影响
在实际测量中,待测体系中通常同时存在其他金属离子,研究其他金属离子的存在对铁含量测量结果的影响是判断该方法实用性的重要方式。分别探究了常见金属离子K+、Na+、Ca2+、Mg2+、Al3+、Zn2+、Mn2+、Co2+、Ni2+、Cu2+对该方法测量铁含量的影响。结果表明,K+、Na+、Ca2+、Mg2+、Al3+离子与亚铁氰化钾作用没有明显现象,Zn2+、Mn2+离子与亚铁氰化钾反应有白色浑浊物产生,Co2+、Ni2+离子与亚铁氰化钾反应产物呈绿色,Cu2+离子与亚铁氰化钾反应产物呈暗红色。在测定结果相对误差 ≤±5%时,100倍K+、Na+、Ca2+、Mg2+、Al3+离子存在时,不影响铁含量测量结果,20倍Co2+、Ni2+离子存在时,不影响铁含量测量结果,10倍Mn2+离子存在时,不影响铁含量测量结果,而Zn2+、Cu2+离子的存在对测量结果有明显影响。
2.6 西山焦枣中铁含量的测定
2.6.1 样品前处理 市售西山焦枣去核后切片烘干,研磨为粉末。称取该粉末约1.0 g(精确至0.000 1 g),置于聚四氟乙烯内衬中,加入5 mL浓硝酸,将聚四氟乙烯内衬密封于不锈钢高压反应釜中,在140 ℃烘箱中加热3 h。冷却后,样品消解为澄清溶液,将消解液转移至小烧杯中,在电炉上将过量的硝酸加热去除,消解液用去离子水稀释定容至25 mL,待测。
2.6.2 铁含量的测定 移取4份5.00 mL待测液于25 mL比色管中,分别加入0.15 mol/L硫酸溶液1.0 mL、0.3%双氧水溶液0.5 mL(将铁离子氧化为Fe3+离子)、6 g/L亚铁氰化钾溶液1.0 mL,用去离子水稀释至刻度,摇匀后,静置显色30 min。以试剂空白为参比,在700 nm波长处测定溶液的吸光度,结果见表1。
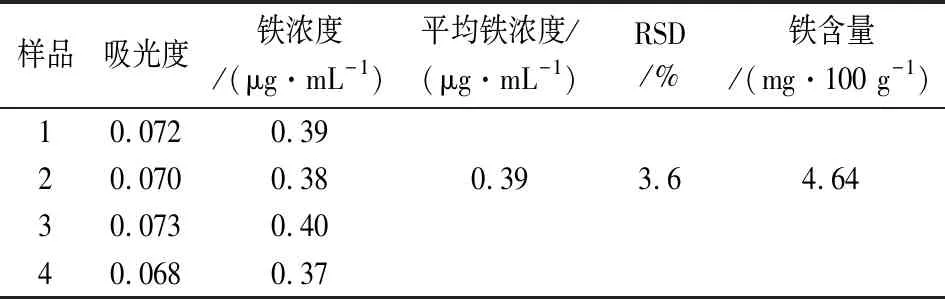
表1 样品中铁含量的测定Table 1 Determination of iron content in samples
2.6.3 加标回收率 移取4份5.00 mL焦枣待测液于25 mL比色管中,分别加入1.00 mL Fe3+铁标准溶液进行回收实验,按照样品测定方法显色后测定其吸光度,结果见表2。
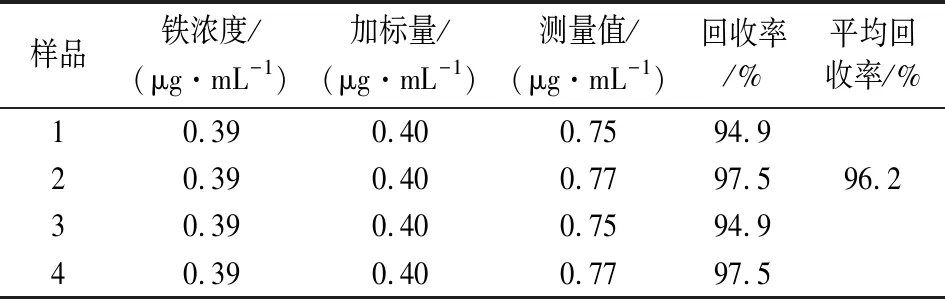
表2 加标回收实验结果Table 2 Results of the recovery test
3 结论
(1)以亚铁氰化钾为显色剂,建立了一种新的测定微量铁含量方法,确定了测量最佳条件:显色时间为30 min,显色剂6 g/L亚铁氰化钾用量为1.0 mL,最大吸收波长为700 nm。该方法的线性范围为0.00~4.00 μg/mL,线性回归方程为A=0.171 54c+0.004 43,相关系数R2=0.999 6。
(2)常见共存离子K+、Na+、Ca2+、Mg2+、Al3+等对测定铁含量无干扰,但Zn2+、Cu2+离子的存在对测量结果有明显影响。

