乙炔与二氯乙烷反应体系热力学分析
董志林,任仕杰,李培丞,姜战,曹海金,赵基钢
(绿色能源化工国际联合研究中心 华东理工大学,上海 200237)
氯乙烯(VCM)是生产聚氯乙烯的重要化工原料[1]。氯乙烯生产工艺有乙烯氧氯化和乙炔氢氯化两种方法,其中乙炔氢氯化法在我国占据主导地位。乙炔氢氯化法催化剂氯化汞存在严重的环境污染问题。为解决该工艺汞污染问题,有多名学者对无汞催化剂生产氯乙烯做了大量研究[2-9],也有学者提出以乙炔与1,2-二氯乙烷为原料生产氯乙烯的新路线[10-11]。本文通过化工流程模拟软件中的RGibbs与REquil反应器模块对乙炔与1,2-二氯乙烷反应体系进行热力学模拟分析,热力学平衡的计算能够考察化学反应方向与限度,具有一定的理论和现实意义[12]。
1 乙炔与二氯乙烷反应过程分析
乙炔与1,2-二氯乙烷制备氯乙烯过程,一般认为该反应分两步进行,首先1,2-二氯乙烷在催化剂条件下裂解,生成氯乙烯和氯化氢,如反应式(1)。

(1)
反应生成的氯化氢与乙炔在催化剂条件下生成氯乙烯,如反应式(2)。

(2)
二者反应结合为乙炔与1,2-二氯乙烷在催化剂条件下生成两分子氯乙烯,如反应式(3)。

(3)
在实际反应过程中还存在副反应,氯化氢与氯乙烯加成,生成1,1-二氯乙烷,如反应式(4)。

(4)
此外,反应过程中也会出现聚合反应。由于聚合反应较为复杂,本文只讨论两分子之间的聚合反应。反应生成的氯乙烯可能自身发生聚合反应,生成1,3-二氯-二丁烯,如反应式(5)。原料乙炔存在自身反生聚合反应,生成乙烯基乙炔,如反应式(6)。氯乙烯和乙炔也可以发生聚合反应,如反应式(7)。

(5)

(6)

2 热力学参数和反应体系计算方法
2.1 标准状态下热力学参数
各物质在298 K、0.1 MPa下的标准熵和标准摩尔生成焓见表1[13-14]。

表1 标准热力学性质表Table 1 Standard thermodynamic properties table
2.2 标准状态下反应可行性热力学分析
标准熵变:
标准摩尔反应焓:

表2 298 K时反应热力学计算结果Table 2 Calculation results of reaction thermodynamics at 298 K
标准Gibbs 自由能:
2.3 模拟计算
在AspenPlus11.0 中建立主工艺流程,RGibbs 工艺流程图见图1。

图1 RGibbs 工艺流程图Fig.1 RGibbs process flow chart1.C2H2;2.CH2ClCH2Cl
C2H2与CH2ClCH2Cl的摩尔流量均为1 mol/h,在25 ℃常压下进行混合。混合气体进入RGibbs反应器进行反应,反应器压力为0.1 MPa;物性方程选用RK-SOAVE,采用灵敏度分析Sensitivity工具,分别计算了单一反应时乙炔的平衡转化率以及不考虑聚合反应和考虑聚合反应两种理想反应情况下100~500 ℃时各产物的平衡收率。REquil反应器流程图见图2。

图2 REquil反应器流程图Fig.2 Flow chart of REquil reactor1.C2H2;2.CH2ClCH2Cl
以乙炔氢氯化反应为例,C2H2与CH2ClCH2Cl的摩尔流量为1 mol/h,在25 ℃常压下进行混合,混合气体进入REquil反应器反应,使用灵敏度Sensitivity工具,分别考察了二氯乙烷裂解反应、乙炔氢氯化反应以及二者协同反应三种理想情况下,在100~600 ℃时的反应平衡转化率,并估算了二者的平衡常数。
3 结果与讨论
3.1 标准状态下反应可行性分析
由表3可知,反应式(1)即二氯乙烷裂解生成氯乙烯与氯化氢的反应的标准摩尔反应焓与标准吉布斯自由能均为正值,表明该反应在标准条件下为吸热反应,并且在室温下无法自发进行。需要在较高温度下反应才能发生。假设T1为反应进行所需的最低温度,那么可以计算出:
简化方程进行估算:
得T1=489 K,即二氯乙烷进行裂解所需的最低温度216 ℃。
反应式(3)即乙炔与二氯乙烷协同反应生成氯乙烯的标准摩尔反应生成焓为负值且绝对值较小,表明该反应为微放热反应,低温有利于该反应进行。因此设计反应温度时,需要同时兼顾二氯乙烷裂解反应的最低温度与协同反应转化率,以寻求较优的温度条件。
其余各反应标准摩尔反应焓和标准吉布斯自由能均为负值,表示反应均为放热反应,在室温下能自发进行。此外,聚合反应的标准吉布斯自由能绝对值均小于0,并且绝对值较大,表示聚合反应很容易发生,聚合产物容易沉积在催化剂表面,形成积碳,进而影响催化剂活性。
3.2 吉布斯反应器模拟结果分析
3.2.1 单一反应时乙炔平衡转化率随温度变化 只考虑单一反应时,乙炔平衡转化率随温度变化情况见图3。

图3 单一产物时各反应乙炔平衡转化率随温度变化Fig.3 The acetylene equilibrium conversion rate of each reaction varies with temperature in the case of a single product
由图3可知,在温度低于250 ℃时,各个反应均具有很高的乙炔平衡转化率,均超过99%。当反应温度超过250 ℃时,随着温度的升高,主反应中的乙炔转化率下降明显,而聚合副反应中乙炔转化率只有缓慢下降,表明提升温度不利于反应的进行,并且无法达到抑制聚合副反应发生的目的。此外,对于反应式(4),反应副产物1,1-二氯乙烷,模拟结果显示反应过程中乙炔转化率为0,1,2-二氯乙烷转化率稳定在37%~38%,表明反应温度对副反应生成 1,1-二氯乙烷影响不大。
3.2.2 非聚合副反应各产物平衡摩尔分率随温度的变化 图4为不考虑聚合反应时不同温度下各产物的平衡摩尔分率。
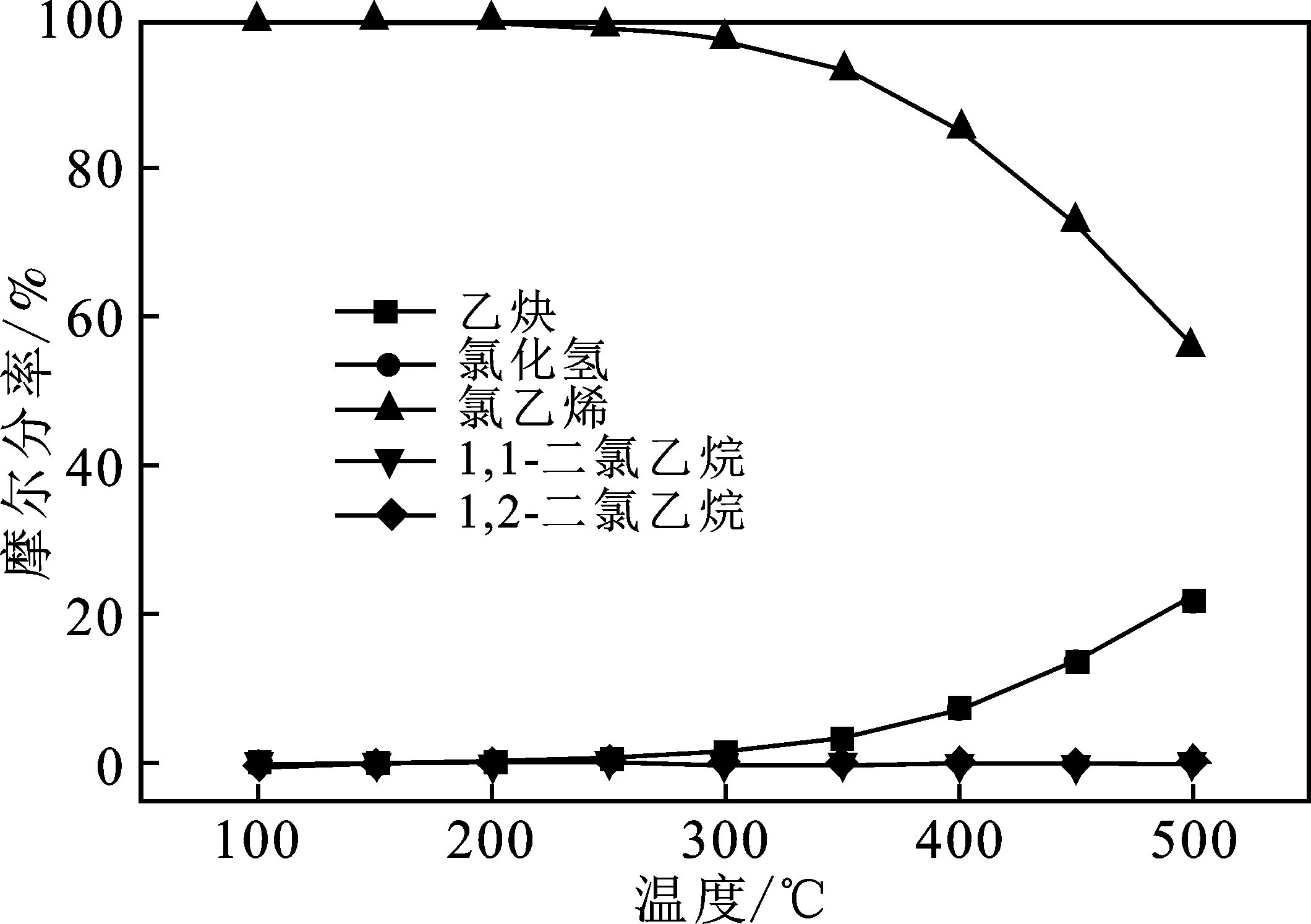
图4 仅考虑非聚合副反应时各产物平衡摩尔分率随温度的变化Fig.4 The acetylene equilibrium conversion rate of each reaction varies with temperature in the case of regardless of the polymerization reaction
由图4可知,当温度超过250 ℃时,氯乙烯的摩尔分率快速下降,乙炔与氯化氢的摩尔分率快速上升,1,2-二氯乙烷与1,1-二氯乙烷的平衡摩尔分率很低,二者不超过0.4%,表明在温度较高时,由于1,2-二氯乙烷裂解生成氯乙烯与氯化氢为强吸热反应,反应进行得很彻底,而乙炔与氯化氢加成生成氯乙烯为强放热反应,受温度影响较大,这与热力学计算结果基本一致,表明非聚合副反应对主反应的影响很小。
3.2.3 聚合反应时各产物在不同温度下的平衡摩尔分率 聚合反应时各组分在不同温度条件下平衡摩尔分率见图5。
由图5可知,在100~500 ℃的温度范围内,氯乙烯的摩尔分率都很低,最高不超过1%。在温度低于200 ℃时,主要发生聚合反应,生成1,3-二氯-2-丁烯与氯丁二烯;当温度超过200 ℃时,则主要生成氯丁二烯,即未反应的乙炔与生成的氯乙烯聚合反应,并且几乎不受温度影响。在温度超过450 ℃时,氯丁二烯的摩尔分率出现下降的趋势,乙烯基乙炔出现了上升,由于温度过高,实际意义不大,这里不作讨论。值得注意的是,氯化氢气体的摩尔分率一直很高,考虑为在温度上升时,1,2-二氯乙烷容易裂解生成氯化氢。

图5 聚合副反应时各产物平衡摩尔分率随温度的变化Fig.5 The acetylene equilibrium conversion rate of each reaction varies with temperature in the case of the polymerization
3.3 平衡反应器模拟结果分析
3.3.1 二氯乙烷裂解反应 1,2-二氯乙烷裂解反应平衡转化率与平衡常数(K)随温度变化见图6、图7。
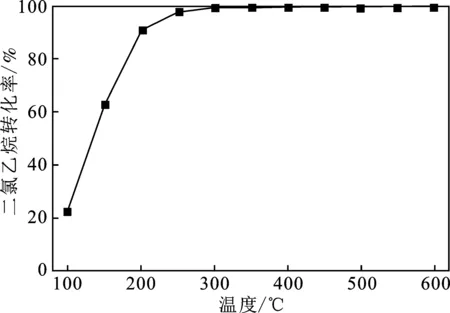
图6 1,2-二氯乙烷平衡转化率随温度的变化Fig.6 1,2-Dichloroethane equilibrium conversion rate varies with temperature

图7 1,2-二氯乙烷裂解反应平衡常数随温度的变化Fig.7 1,2-Dichloroethane cracking reaction equilibrium constant varies with temperature
由图6可知,在100~450 ℃的温度范围内,1,2-二氯乙烷转化率随着温度增加而增高,在100~250 ℃的温度范围内,1,2-二氯乙烷的平衡转化率快速升高,反应平衡受温度影响较大;在温度超过250 ℃时,1,2-二氯乙烷平衡转化率超过98%,随温度增加而缓慢上升,反应平衡受温度影响较小。
由图7可知,在较低温度时,反应平衡常数较小,在100~300 ℃温度范围内,平衡常数最大值仅为184.89,当温度超过300 ℃时,平衡常数快速增加。
3.3.2 乙炔氢氯化反应 乙炔平衡转化率与反应平衡常数(K)对温度变化见图8、图9。
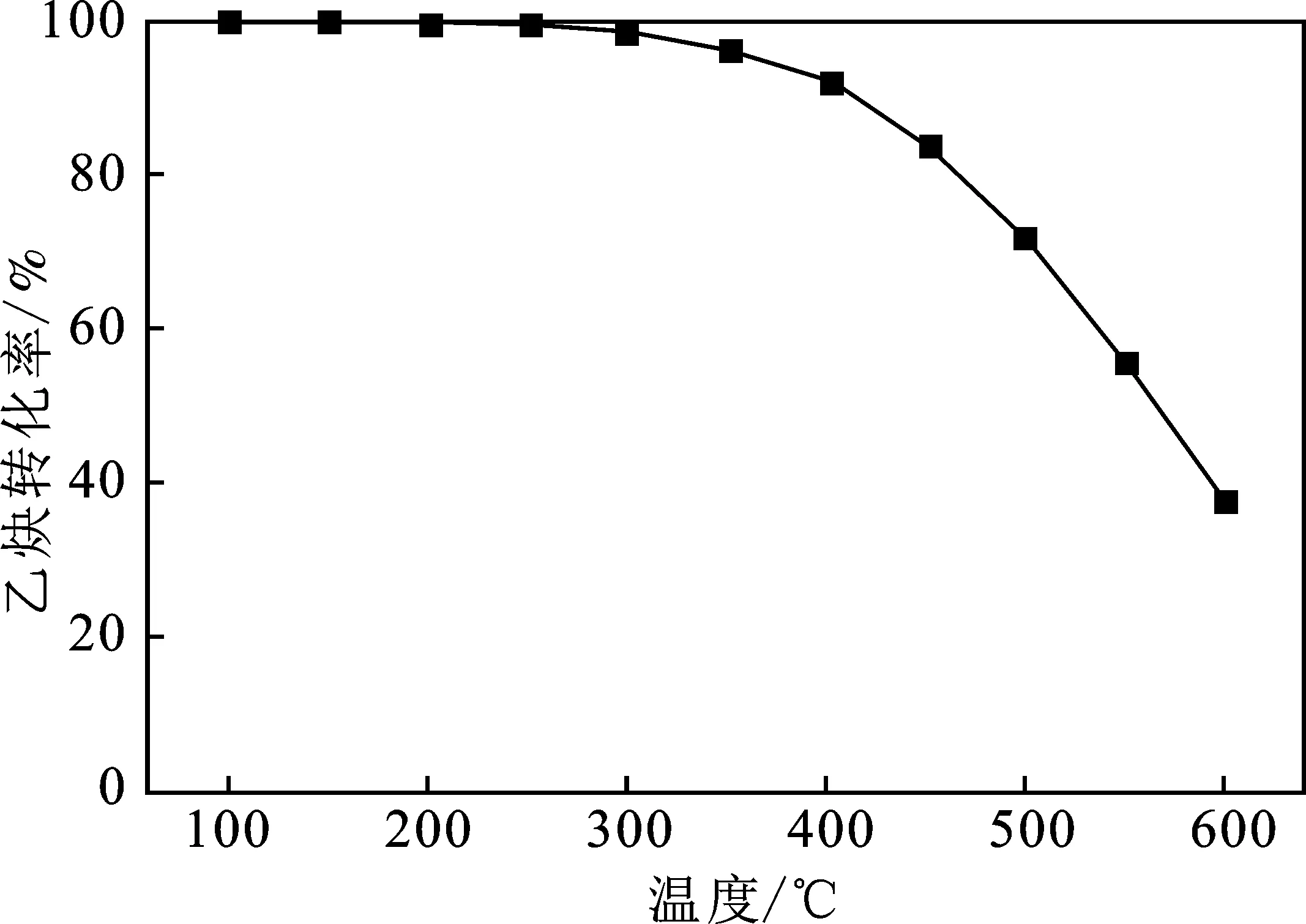
图8 乙炔转化率随温度的变化Fig.8 Acetylene equilibrium conversion rate varies with temperature

图9 乙炔氢氯化反应平衡常数随温度的变化Fig.9 The equilibrium constant of acetylene hydrochlorination reaction varies with temperature
由图8可知,在100~600 ℃的温度条件下,乙炔平衡转化率随着温度增加而逐渐下降。在较低的温度条件下,乙炔平衡转化率很高,乙炔平衡转化率受温度变化影响较小;在100~250 ℃时,平衡转化率超过99.5%;当温度超过250 ℃时,乙炔平衡转化率下降较为明显,当温度超过400 ℃时,乙炔平衡转化率下降到91%左右。
由图9可知,反应平衡常数随温度增加快速下降,在较低温度条件100~300 ℃的范围内,反应平衡常数很大,反应几乎为不可逆反应;当温度超过300 ℃时,反应平衡常数变小,反应平衡受温度变化影响较大。
3.3.3 二氯乙烷裂解与乙炔氢氯化协同反应 考虑1,2-二氯乙烷裂解与乙炔氢氯化同时达到反应平衡时,氯乙烯平衡收率随温度变化见图10。
由图10可知,氯乙烯的收率随着温度升高而下降。在100~300 ℃的较低温度范围条件下,氯乙烯平衡收率较高,超过98.5%,氯乙烯平衡收率受温度影响较小;当温度超过300 ℃时,氯乙烯平衡收率逐渐减小,在500 ℃时,氯乙烯平衡收率仅为71%,受温度影响较大。

图10 二者协同反应氯乙烯平衡收率随温度的变化Fig.10 Variation of the equilibrium yield of vinyl chloride varies with temperature
4 结论
(1)热力学上1,2-二氯乙烷裂解反应不能自发进行,其余各反应均能自发进行,二氯乙烷与乙炔协同反应制备氯乙烯为微放热反应,乙炔转化率随温度升高而降低,高温不利于主反应进行。
(2)只考虑非聚合副反应时,副反应对氯乙烯收率影响不大,但氯乙烯收率受温度影响较大;当考虑聚合副反应时,聚合反应相对于主反应更容易发生,反应产物氯乙烯较容易与乙炔发生聚合反应,在反应过程中应考虑降低积碳问题。
(3)1,2-二氯乙烷裂解反应中,二氯乙烷转化率随温度上升而上升,乙炔氢氯化反应中,乙炔转化率随温度上升而降低,二者协同反应,氯乙烯收率随着温度上升而降低,反应温度不宜超过300 ℃。

