LncRNA H19通过上调HIF-1α的表达促进人口腔鳞癌细胞增殖侵袭能力及细胞周期
姑丽米日·依马木 王巧云 林成
长链非编码RNA(Long non-coding RNA,LncRNA)H19作为最早发现的印记基因,参与多种肿瘤的发生发展[1-2],然而,其在口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)组织中的表达及其对OSCC生长和转移的影响尚不清楚。缺氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)是调控肿瘤细胞Warburg作用的核心分子,与OSCC发生发展密切相关[3-4]。本研究探讨了H19和HIF-1α在人OSCC组织中的表达及其相互关系,并检测了H19对OSCC细胞增殖、侵袭和细胞周期进程的影响以及HIF-1α表达的调控。
1 材料与方法
1.1 组织样本来源
纳入2017 年1月~2018 年1 月解放军474医院口腔科收治的45 例OSCC患者(6 例女性,39 例男性);34~75 岁,中位年龄54 岁;TNM I-II期:18 例,TNM III-IV期:27 例;病理分化低/中:21 例,病理分化高:24 例。手术切取肿瘤组织及癌旁组织(距离原发灶>5 cm),所有患者均初次被诊断为OSCC,术前未接受任何抗肿瘤治疗, 研究前签署知情同意书。
1.2 细胞系、细胞培养及慢病毒转染
RPMI-1640+10%FBS(Gibco,美国)培养人OSCC细胞系SCC-4、SCC-9、SCC-25、Cal-27、TCA8113及KB(上海中国科学院),在293T细胞系中进行慢病毒包装,过表达及干扰病毒(上海汉恒生物)分别感染Cal-27及SCC-9细胞3 d, 1/1000 Polybrene促进感染效率,嘌呤霉素筛选细胞直至稳定生长状态。
1.3 逆转录定量聚合酶链反应(RT-qPCR)
Trizol(Takara,日本)提取OSCC组织及细胞系中总RNA,逆转录得到cDNA产物,设计合成引物:H19、HIF-1α及内参基因GAPDH,10 μL Sybrgreen(ThemoFisher, 美国)中加入0.5 μmol/L引物和5 μL cDNA,置RT-qPCR(7500, ThemoFisher,美国)中进行荧光定量PCR反应,反应条件:95 ℃, 5 min; 95 ℃, 5 s for 40 cycles; 60 ℃, 30 s. 2-ΔΔCt法计算H19及HIF-1α的相对表达水平。
1.4 MTT实验
待检测细胞以1×104个细胞/孔接种到96孔板中,培养过夜,直到细胞在37 ℃、5%CO2条件下贴壁生长。将MTT与RPMI-1640+10%FBS培养基1∶5混合,加入10%FBS,在37 ℃、5%CO2条件下培养4 h,同时避光。用酶标仪检测490 nm处0、24、48、72 h时的吸光度。用24、48、72 h的吸光度与0 h的吸光度之比表示细胞的相对增殖能力。
1.5 细胞侵袭实验
50 mg/L基质胶覆盖Transwell小室,RPMI-1640+1%FBS稀释细胞至5×104个/mL,取200 μL加入上小室,600 μL RPMI-1640+10%FBS加入下室,培养24 h,棉签拭去上室面细胞,多聚甲醛固定10 min后采用0.1%结晶紫染色30 min,40×10显微镜(DM1000,Leica, 德国)观察拍照,ImageJ软件进行细胞计数。
1.6 细胞周期分析
待检细胞消化后重悬, 4 ℃预冷70%乙醇固定过夜100 μg/mL RNase A孵育30 min,250 μL 0.05 g/L碘化丙啶(PI)室温避光处理细胞30 min,流式细胞仪(BD,美国)进行细胞周期分析。
1.7 蛋白质印迹实验(Western blot)
RIPA裂解液裂解细胞蛋白,10% SDS-PAGE电泳分离蛋白质,转移到PVDF膜(0.45 μm,Thermo-Scientific, 美国),5%脱脂牛奶37 ℃封闭2 h,HIF-1α(1∶500稀释,93 kDa,abcam,ab113642),β-Actin(1∶2 000稀释, 42 kDa,abcam,ab8226)抗体4 ℃孵育过夜,洗膜后鼠二抗(1∶2 000稀释,abcam,ab6728)室温孵育2 h,加入ECL化学发光检测试剂,化学发光仪(Geldoc XR, Bio-Rad,美国)检测条带信号强度。
1.8 统计方法
2 结 果
2.1 H19及HIF-1α在组织中的表达及其相关性
RT-qPCR结果显示H19及HIF-1α在OSCC组织中高表达(图 1A、1B),Pearson相关分析结果显示H19 及HIF-1α表达在OSCC组织中显著正相关(Pearson's rho=0.558,P<0.001,图 1C)。

图 1 H19及HIF-1α在口腔鳞癌及正常组织中的表达及其相关性
2.2 H19在Cal-27细胞中的表达及H19的过表达及干扰细胞系构建
在检测OSCC细胞系H19差异表达的基础上,构建了以Cal-27细胞系为模型的H19过表达细胞系及以SCC-9细胞系为模型的H19干扰细胞系(图 2)。

图 2 H19在OSCC细胞系中的表达及H19的过表达及干扰细胞系构建
2.3 H19过表达及干扰对OSCC细胞增殖的影响
MTT实验结果表明,与Cal-27 oecontrol相比,Cal-27 oeH19细胞活力明显增强(图 3A),而与SCC-9 sicontrol 相比,SCC-9 siH19细胞活力明显抑制(图 3B)。
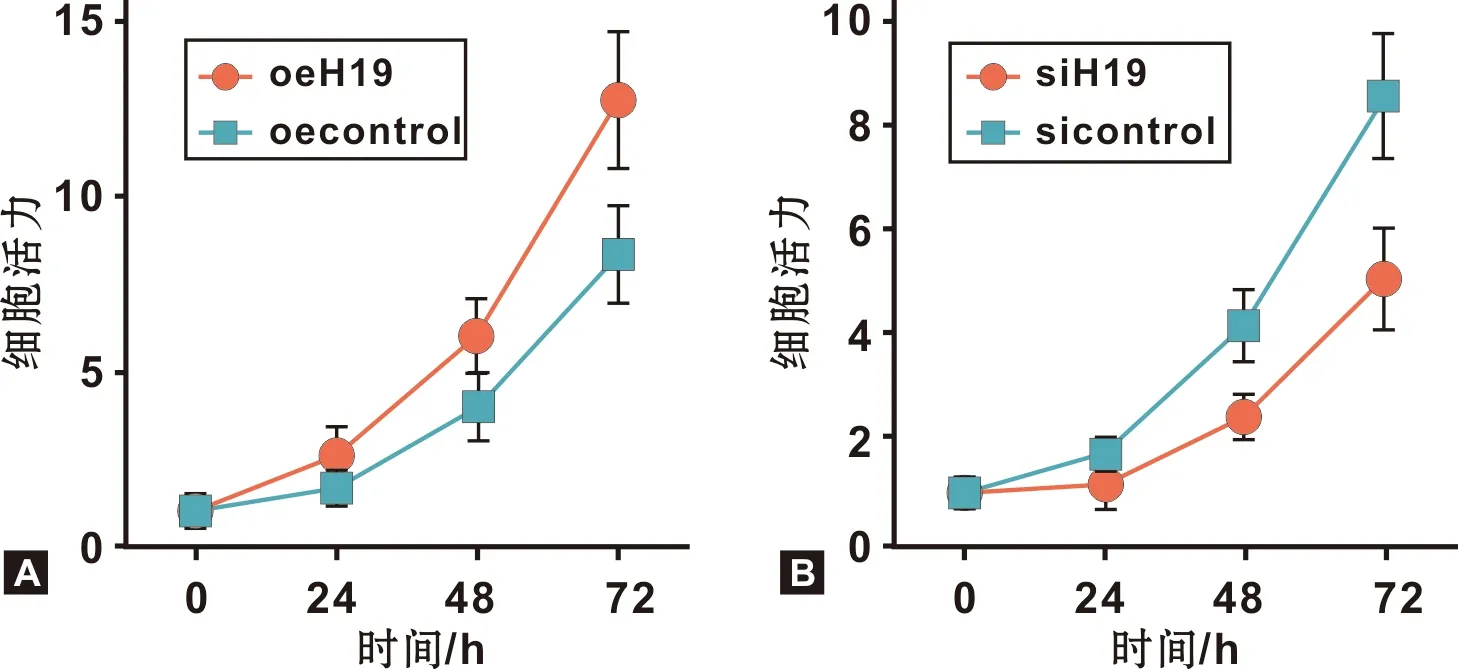
图 3 H19过表达及干扰对OSCC细胞增殖的影响
2.4 H19过表达及干扰对OSCC细胞侵袭的影响
Transwell侵袭实验结果表明,与Cal-27 oecontrol(50.6±7.7 个/视野)相比,Cal-27 oeH19侵袭细胞数(124.1±13.5 个/视野)显著增多(图 4A);而与SCC-9 sicontrol(57.2±8.4 个/视野)相比,SCC-9 siH19侵袭细胞数(107.5±11.3 个/视野)显著减少(图 4B)。

图 4 H19对Cal-27细胞侵袭的影响
2.5 H19过表达及干扰对OSCC细胞周期的影响
细胞周期分析结果表明,H19过表达使G0/G1期比值显著降低,而G2/M期增高,干扰H19使G0/G1期比值显著增高,而S及G2/M期显著降低(图 5)。
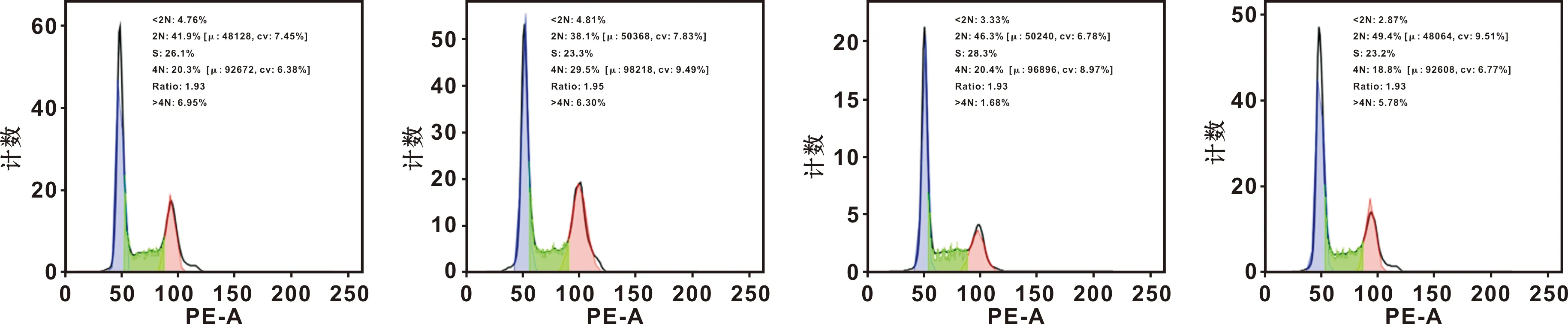
图 5 H19对Cal-27细胞周期的影响
2.6 H19过表达及干扰对HIF-1α mRNA及蛋白表达的影响
RT-qPCR结果显示,H19过表达显著上调HIF-1α mRNA及蛋白表达,干扰H19显著抑制HIF-1α mRNA及蛋白表达(图 6)。

图 6 H19对Cal-27细胞中HIF-1α mRNA及蛋白表达的影响
3 讨 论
H19基因位于人类染色体11p15.5, 在胚胎组织中表达较高[5]。近年来许多研究报道 H19参与乳腺癌、胃癌及结直肠癌等多种肿瘤的发生发展:H19可通过调控17β-雌二醇及泛素连接酶E3,促进乳腺癌细胞的增殖及转移[6-8],并通过靶向CALN1和miR-141促进胃癌细胞的增殖、迁移和侵袭[9-10],同时也在结直肠癌及非小细胞肺癌中发挥促癌作用[11-12],但其在OSCC中的生物学功能仍是空白。
HIF-1α作为糖酵解的主要调节因子,参与肿瘤细胞Warburg效应[13-14],在OSCC中,研究表明HIF-1α表达与患者不良预后正相关[15],在体外,其可促进OSCC细胞的迁移、侵袭和放疗抵抗[16-17],且HIF-1α也参与细胞周期进程的调节[18]。近年有研究指出,H19可促进骨髓间充质干细胞体外缺血缺氧环境下的生存能力[19],提示H19可能通过调节缺氧相关分子如HIF-1α发挥生物学作用。
本研究发现H19及HIF-1α在OSCC组织中高表达,且呈显著正相关。在体外,H19可促进OSCC细胞增殖、侵袭和细胞周期进程,同时可显著上调HIF-1α mRNA及蛋白表达水平,提示H19促进HIF-1α转录或维持其mRNA稳定性,这为揭示OSCC发生发展的潜在分子机制和治疗提供了新的依据。

