不同强度流体剪切应力作用下成骨细胞的形态学改变
岳二丽 李夏宁 赵红宇
流体剪切应力(fluid shear stress,FSS)通过细胞表面不同信号通道将力学信号传导到细胞内部,引起细胞发生一系列适应性改变,这是骨骼功能适应性的基本细胞学原理[1-2]。至今为止,生物应力作用下细胞形态学改变的研究尚较少,本研究拟采用精密的定常流加载系统对成骨细胞MG-63分别给予强度为7 dynes/cm2和12 dynes/cm2的FSS作用,通过观察不同时间成骨细胞MG-63形态学的改变,从细胞动力学角度对种植体周围骨重建的发生机理进行探讨。
1 材料与方法
1.1 主要设备和仪器
清洁超净台(SW-CJ-IFD,苏州净化设备公司);二氧化碳恒温培养箱(BB15,Heraeus,德国);倒置相差显微镜(CKX41,Olympus,日本);台式低速离心机(BS400,DENLEY);纯水制备系统(Rios 150,Millipore,美国);定常流加载系统(MASTERFLEX蠕动泵系统,Fisher Scientific International Inc公司,美国)。
1.2 主要试剂
胎牛血清(FBS)、双抗(青霉素100 U/L,链霉素100 μg/L)(Gibco公司,美国);DMEM低糖培养基、0.25%胰蛋白酶&0.02%EDTA(Hyclone公司,美国);PBS平衡盐缓冲液(武汉博士德公司);DMSO(Sigma公司,美国)。
1.3 主要试剂的配制
细胞完全培养液:DMEM培养基加体积分数为10%的FBS及1%~5%双抗。
1.4 细胞培养
成骨细胞MG-63(四川大学华西口腔医院)培养于完全低糖DMEM培养液[内含10%胎牛血清,1%~5%双抗(青霉素100 U/L,链霉素100 μg/L),pH 7.2],置于CO2孵箱(37 ℃,5%CO2,95%空气),每隔2 d换1 次液。
1.5 细胞爬片制作
取对数生长期的MG-63细胞进行消化,制成单细胞悬液,细胞计数并调整细胞密度,以5×104/mL接种于已处理好的载玻片,加液,孵箱孵育2~4 h,备用。
1.6 成骨细胞性能鉴定
碱性磷酸酶(alkaline phosphatase,ALP)测定采用改良钙钴法(Gomori Ca-co法);骨钙素(bone glaproyein,BGP)测定采用免疫细胞化学SABC显色法,操作步骤按试剂盒说明书进行。矿化结节染色采用茜素红染色和钙染色(Von Kossa染色)2 种方法。
1.7 流体加力条件优化
本研究采用定常流加载系统对MG-63细胞施加FSS,该系统包括流室、MASTERFLEX蠕动泵和储液池等。FSS强度决定于液体流动速度并用公式σ=6μQ/H2W得出,其中μ(mPa.s)为粘滞系数,Q(mL/min)为单位时间内通过流室的液体体积,H为流室顶壁和置入载玻片表面的垂直距离。W为流室的宽度。DMEM培养基为细胞加载所用液体,粘滞系数经测定为0.86×10-2dynes.s/cm2。
1.8 细胞加力、染色和拍照
采用密闭流室加力系统,通过蠕动泵产生FSS。将细胞融合(约80%)铺满载玻片的细胞爬片置入密闭无菌流室的平行池槽,固定,对MG-63细胞进行7 dynes/cm2和12 dynes/cm2加力。作用时间分别为15、30、60和120 min。将细胞分为9 组,其中1组为对照组(同等条件培养但未加力);余下8组分别施以不同强度不同时间的FSS作为实验组,加力过程中保持应力大小稳定,加力结束后即刻收获细胞。苏木素(精)-伊红染色,倒置相差显微镜下观察细胞形态并照相。
1.9 统计学方法

2 结 果
2.1 成骨细胞性能检测
MG-63细胞ALP染色、BGP免疫组化染色及矿化能力检测均呈阳性(图 1)。
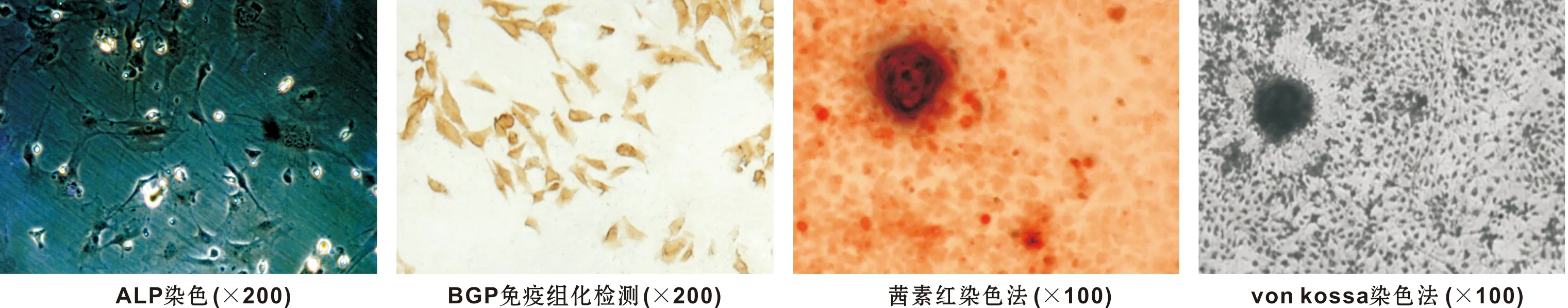
图 1 MG-63成骨细胞性能检测
2.2 对照组MG-63的细胞形态
无剪切力作用的对照组MG-63细胞有梭形、三角形、球形和纺锤形等不规则的形态,偶见巨细胞、多核细胞及多极分裂相细胞,核质比较大,细胞核形状不规则,核仁多,多为3~5 个,染色质呈颗粒状,细胞质着色深且体积小,突起有多种形状,如锯齿状或片状(图 2)。
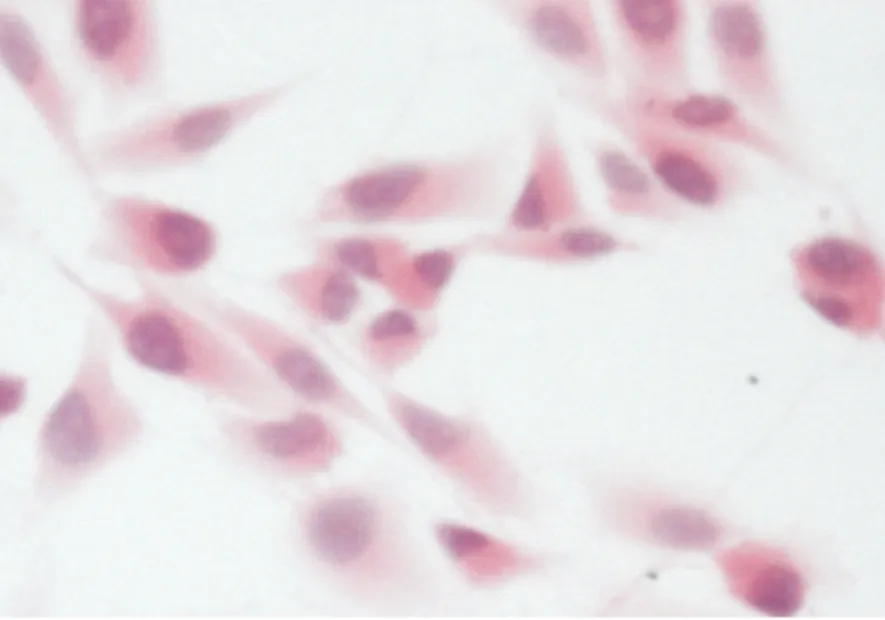
图 2 对照组MG-63成骨细胞(HE, ×400)
2.3 强度为7 dynes/cm2的FSS作用不同时间时的细胞形态比较(HE染色)
在生理负荷应力范围内,随着强度为7 dynes/cm2的FSS作用时间的增加(15、30和60 min),细胞极性增强,细胞形态逐渐呈纺锤样改变,细胞排列由原来杂乱不规则逐渐变规则,尤其是细胞长轴与剪切应力方向一致的细胞胞体被拉伸;胞核偏移,胞核分裂现象增加或核质比增大,表现出细胞增殖能力增强。当细胞加力时间为120 min时,细胞开始出现较多的细胞胞突,细胞形态不规则,核分裂相增多或核质比例变大,偶出现核边集,凋亡等现象,胞浆内偶见空泡(图 3)。
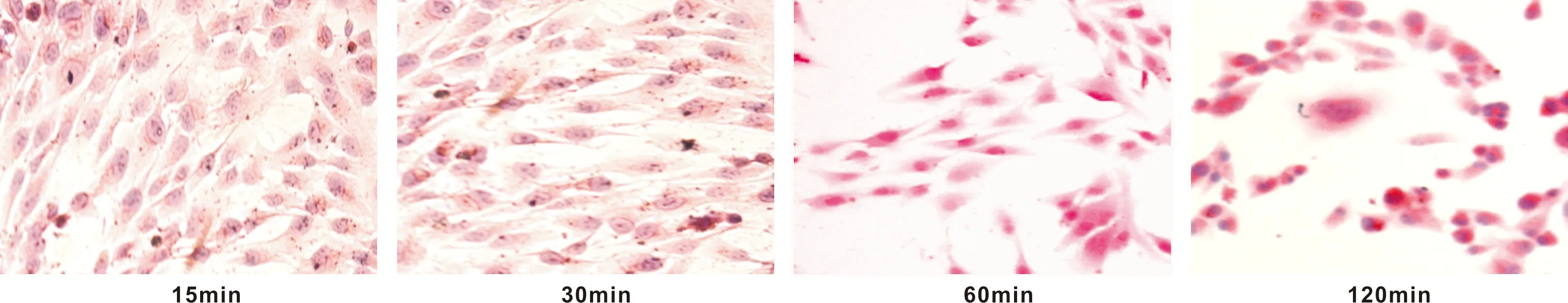
图 3 7 dynes/cm2的FSS作用MG-63细胞不同时间时的细胞形态比较 (HE,×200)
用Image-pro plus图像分析软件对细胞照片进行处理,由图 4可以看出随着受力时间的延长,强度为7 dynes/cm2的FSS作用下细胞的形态变化不规则,但细胞面积均有增大的趋势,并且与对照组(细胞平均面积为25 865.90±3 782.21)相比,应力作用30、60和120 min时(细胞平均面积为40 187.55±1 674.31、40 892.39±1 792.75和44 564.74±3 875.77)MG-63细胞面积均增加(P<0.05),此时的应力刺激信号可诱导细胞形态变化。组间比较结果表明,应力作用0、15 min(细胞平均面积为27 974.90±2 758.49)时细胞面积变化无明显差异(P>0.05),且应力作用30、60与120 min时3 组之间细胞面积变化差异亦无统计学意义(P>0.05)。
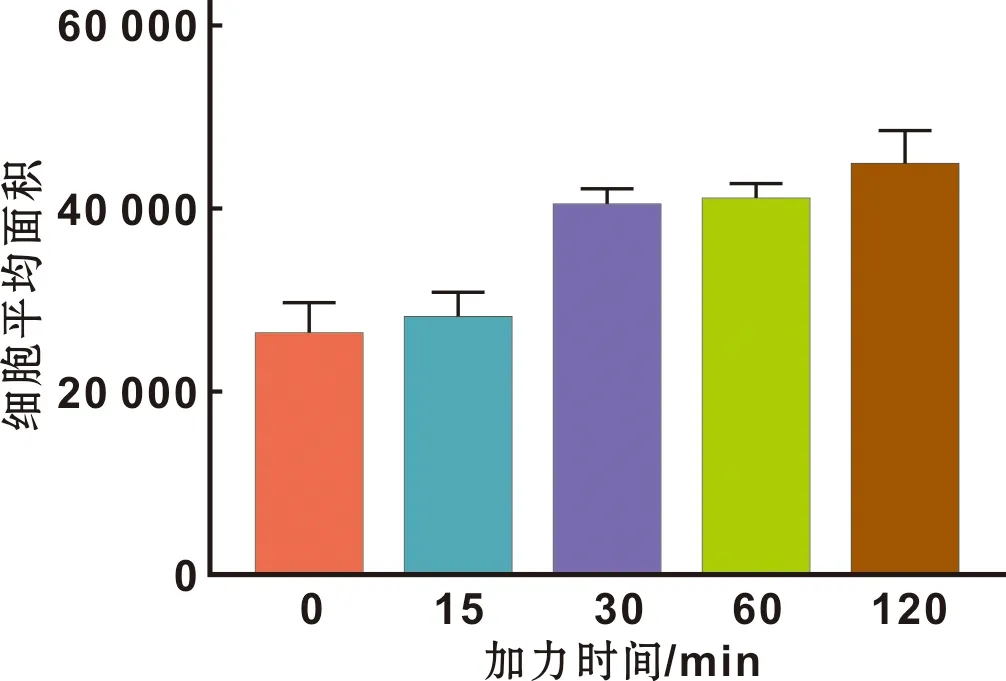
图 4 7 dynes/cm2的流体剪切应力作用下细胞面积比较
2.4 强度为12 dynes/cm2的FSS作用不同时间时的细胞形态比较(HE染色)
如图 5,在强度为12 dynes/cm2的FSS作用下,随着加力时间(0、15、30和60 min)增加,细胞极性改变,细胞形态由不规则逐渐向纺锤状改变,细胞长轴改变明显,细胞排列由原来杂乱无序逐渐变为规则排列。
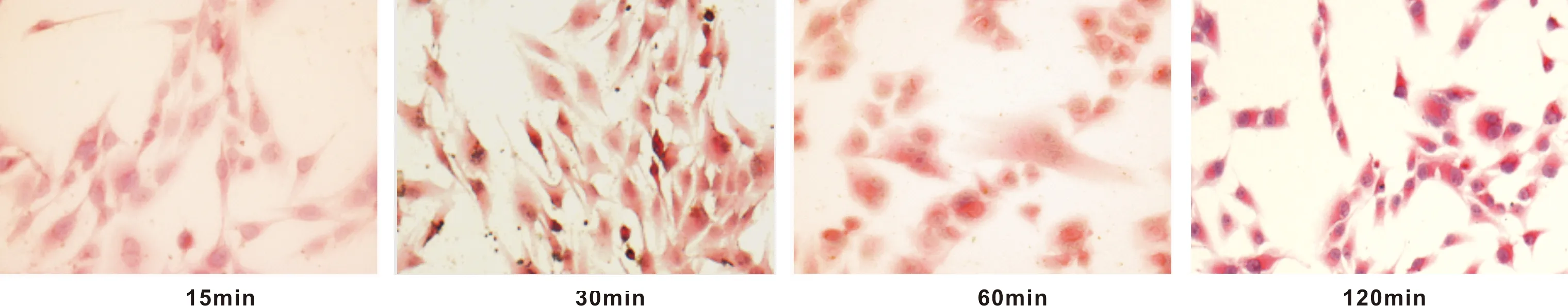
图 5 强度为12 dynes/cm2的FSS作用不同时间时的细胞形态比较(HE,×200)
其中,强度为12 dynes/cm2的FSS作用15 min和30 min时可观察到细胞极性增强,细胞长轴与FSS方向一致的细胞胞体被拉伸,且有部分细胞胞突摆动的方向与应力方向趋于一致。当应力作用60 min时细胞骨架改变较明显,细胞胞突增加,细胞形态规则性稍差,但细胞排列与应力方向的一致性较为明显,细胞内出现明显的胞核偏移,且受力细胞中核质比例增加明显,约(1∶1~1.5∶1)胞核分裂相增加,表现出细胞增殖能力增强。当应力作用120 min时,细胞形态变化更为明显,胞突增加,胞体膨胀或皱缩,可见较多细胞核出现核碎裂,核边集,甚至出现细胞凋亡,细胞脱落现象。
用Image-pro plus图像分析软件对细胞照片进行处理,由图 6可见,在强度为12 dynes/cm2的FSS作用下,随着受力时间的延长,细胞的形态变化不规则,但直径和面积均有增大的趋势,并且与对照组(加力0 min)(细胞平均面积为25 865.90±3 782.21)相比,应力作用60 min和120 min时(细胞平均面积为42 248.61±1 425.53、49 025.22±2 174.47)细胞面积均增加(P<0.05)。组间比较结果表明:应力作用0、15、30 min时(细胞平均面积为31 916.79±8 053.22和28 657.32±1 145.16)细胞面积之间无明显差异(P>0.05);应力作用60 min和120 min时细胞面积之间差异亦无统计学意义(P>0.05)。
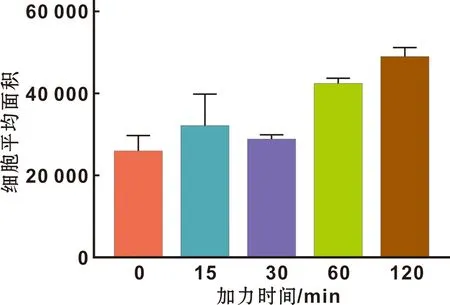
图 6 12 dynes/cm2的流体剪切应力作用下细胞面积比较
2.5 强度为7 dynes/cm2和12 dynes/cm2的FSS分别作用不同时间时细胞平均面积比较
从图 7可以看出,强度为7 dynes/cm2和12 dynes/cm2的FSS分别作用不同时间(15、30、60和120 min)时细胞面积平均值均有增加。用Image-pro plus图像分析软件检测结果显示:在相同作用时间段内,除在作用30min时两种流速的FSS下细胞平均面积差异具有统计意义外(P<0.05),其他时间两种作用力下的细胞平均面积差异均无统计学意义(P>0.05)。
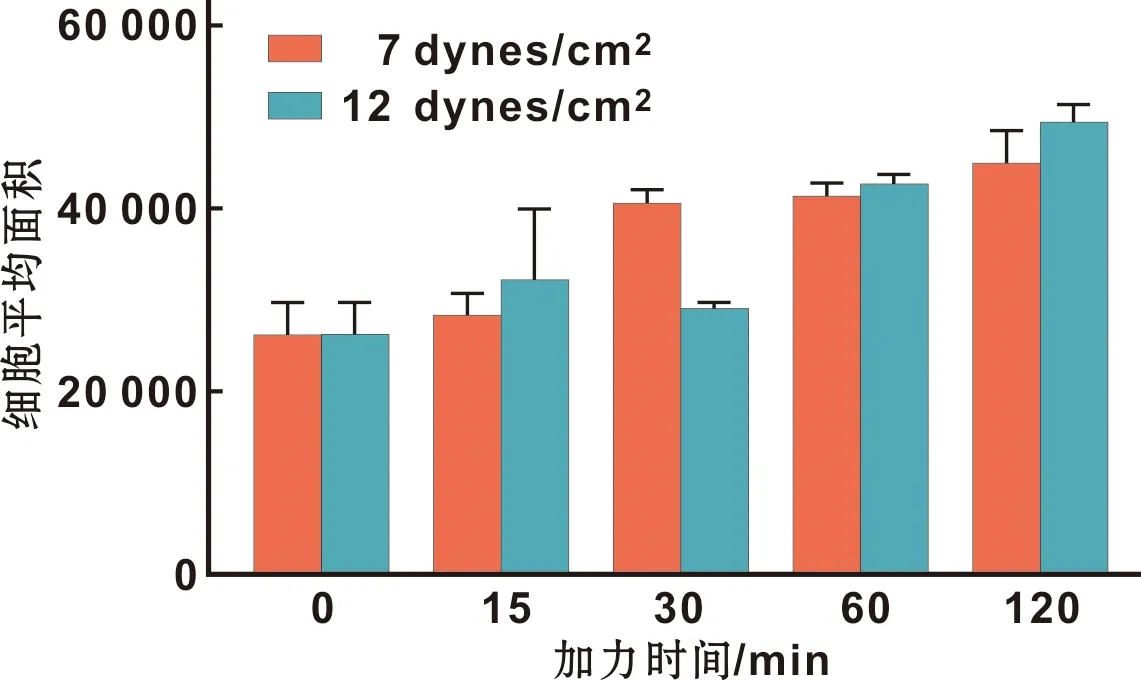
图 7 不同FSS作用下MG-63细胞面积的比较
3 讨 论
机械刺激诱导成骨细胞的正性调节对于骨的生成和修复具有至关重要的作用,而FSS是作用于骨组织的一种常见机械刺激。研究表明,FSS在细胞增殖、分化、基因表达和凋亡等过程中起着重要的作用[3-5]。在机械刺激的作用下,细胞整合素、第二信使系统和应力反应元件等做出响应,细胞骨架的构件通过重排分散了张力和压力,最终导致细胞发生形变[6-8]。
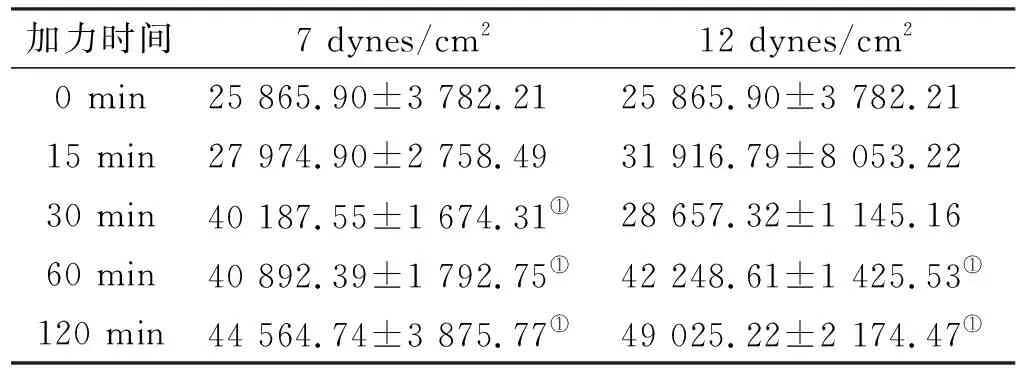
表 1 7 dynes/cm2和12 dynes/cm2的流体剪切应力对MG-63细胞平均面积影响的比较
至今为止,机械应力作用下细胞形态学改变的研究尚较少。本研究所使用的定常流加载系统,是通过精密蠕动泵提供恒定的流体速度,以保证对成骨细胞施以可控的剪切应力。本次研究中分别对成骨细胞MG-63施以不同强度的FSS,运用HE染色相差显微镜观察细胞形态发现:FSS可以促进成骨细胞形态发生改变,这些改变包括:细胞呈纺锤样改变,细胞形态拉长,细胞表面胞突增多等,约有一半的细胞出现与应力方向一致的方向性改变。
MG-63起源于成骨细胞的前体或分化为成骨细胞的骨髓间充质干细胞,它是具有成骨细胞表性特征的一类特殊肿瘤细胞群体,其分化过程类似于成骨细胞[9-10]。研究证实MG-63是一种具有成骨细胞表性特征的标准成骨细胞,其生长过程与正常人成骨细胞一样可分为细胞增殖、骨基质成熟和骨基质矿化阶段。本研究中选用成骨细胞MG-63作为研究对象,并通过预试验又一次对其成骨细胞特性做了印证,检测发现MG-63细胞形态与成骨细胞相似,具有不规则外形、碱性磷酸酶活性和骨钙素表达阳性的特点,而且体外培养MG-63约3~4 周时可观察到矿化结节形成。
近年来已有许多学者对机械应力作用下的成骨细胞增殖数目及相关基因蛋白表达的变化进行了研究并取得了一定的成果,但应力的大小和作用时间对细胞的生物学行为及细胞形态学变化的影响等尚不明确[11-13]。通过反复调试观察并结合相关文献,本实验选择两种强度(7 dynes/cm2和12 dynes/cm2)的FSS作用,以4 个时间段(15、30、60和120 min)分组,观察不同强度的FSS在不同作用时间下成骨细胞的形态及面积改变。该实验发现成骨细胞对不同强度的FSS信号的敏感性不同,并且同一FSS作用时间不同成骨细胞的形态的改变亦不同。与强度为7 dynes/cm2的FSS相比,强度为12 dynes/cm2的FSS对成骨细胞形态具有明显的影响;并且加力时间不超过60 min时,强度为12 dynes/cm2的FSS对细胞的促进增殖和分化作用更为明显,其中,强度为12 dynes/cm2的FSS对成骨细胞作用60 min时,应力对细胞形态影响较大,细胞核分裂增殖最为明显。FSS作用下成骨细胞形态发生了适应性变化[14-16],可能改变成骨细胞的细胞骨架、微管及微丝重新排列、微管极性改变等,目的在于促进应力部位的骨形成,相对较少骨吸收。而细胞排列改变是因为细胞长轴与剪切应力方向一致能使细胞受到的应力降低,减少对流体的阻力,有利于细胞更好地维护自身的生理功能,此能力可能与成骨的方向有关。
该实验结果为进一步探索FSS大小、作用时间与细胞增殖、分化和凋亡的量效及时效关系提供了依据,并且从细胞形态学方面为探讨FSS作用下力学信号在种植体细胞界面的转导机制提出了新思路。

