基于生物信息学分析miR-655在口腔鳞状细胞癌中的表达及功能探讨
王曦 戈春城 童国勇 徐佳
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC),是口腔颌面部常见的恶性肿瘤,占比约为90%[1]。OSCC具有浸润性强、淋巴结易转移的特点,是导致患者5 年内总的生存率不到50%的主要原因[2-3]。研究OSCC的发病机制,寻找有效的分子靶点对OSCC的诊断及治疗具有重要意义。目前随着高通量基因测序技术在肿瘤中的应用,已有研究探讨了某些mRNA或miRNA分子对OSCC的发生发展和预后的影响[4-5]。
microRNAs(miRNAs)是在真核生物中发现的一类可在转录及转录后水平调控靶基因表达的非编码RNA,长约20~25 个核苷酸,目前已成为肿瘤研究的热点[6-7]。miR-655位于14号染色体的 q32.31位点,参与基因表达的调控,影响细胞增殖和生长等生物学过程。研究报道miR-655具有抑制肿瘤的作用[8],然而目前对miR-655在OSCC的研究国内尚未见报道,因此本研究拟利用公开发表的的RNA-seq数据,探讨miR-655在OSCC患者中的表达及临床意义。
1 资料与方法
1.1 数据资料收集
1.1.1 TCGA数据收集 从癌症和肿瘤基因图谱(the cancer genome atlas,TCGA)(https://cancergenome.nih.gov/)数据库中下载342 例OSCC样本及临床数据(年龄、性别、肿瘤分级、肿瘤分期、吸烟、饮酒史、总生存期)和44 例癌旁样本,该miRNA数据集采用RNA-seq技术检测基因表达。
1.1.2 OSCC患者样本收集 2018 年01 月~2020 年01月经恩施土家族苗族自治州中心医院口腔科手术切除的40 例OSCC患者,术后病理科确诊,收集癌组织及癌旁组织两份标本,入组患者未行放化疗、靶向治疗等治疗方案,置于-80 ℃保存备用。本研究征得患者及家属的知情同意,并获得本院伦理委员会批准。
1.1.3 主要试剂及仪器 正常人口腔上皮细胞HOK及OSCC细胞系(TSCCa、CAL-27、SCC-4、HN-6)(中科院上海细胞库);胎牛血清、脂质体Lipofectamine2000、DMEM培养基(Gibco公司,美国);TRIzol试剂、逆转录试剂盒和SYBR Green PCR Master mix[宝生物工程(大连)有限公司];Transwell小室和Matrigel胶(BD公司,美国);细胞增殖试剂盒(CCK8)(上海碧云天生物科技有限公司);miR-655模拟物(Mimics)和阴性对照(NC)(广州市锐博生物科技有限公司)。
1.2 研究方法
1.2.1 miR-655的表达水平 分析miR-655在342 例OSCC样本及44 例癌旁样本的表达水平。同时,TRIzol法提取总RNA,采用ND-1000行核酸定量,One Step PrimeScript®miRNAcDNA合成试剂盒,按步骤进行逆转录反应,qRT-PCR条件为: 95 ℃预变性10 min,40 个循环(95 ℃ 10 s、60 ℃ 45 s、72 ℃ 30 s)。miR-655上游引物:5' -TCCGAACATGGTTAA-3' ,下游引物:5' -GTGCAGGGTCCGAGG-3' ,以U6核小分子RNA为内参,表达量采用2-ΔΔCt法计算。
1.2.2 数据筛选及分组 整理342 例OSCC样本及其临床数据,以 miR-655表达的中位值,将OSCC样本分为miR-655高表达组(n=171)和低表达组(n=171)。比较miR-655表达与OSCC患者的临床特征和预后的相关性。
1.2.3 qPCR检测miR-655在OSCC细胞的表达及转染 将正常人口腔上皮细胞HOK及OSCC细胞系(TSCCa、CAL-27、SCC-4、HN-6)加入到DMEM完全培养基中,置于37 ℃、5%CO2的条件下培养。每隔1~2 d更换培养基,当细胞融合度达80%以上时传代,qRT-PCR检测miR-655在OSCC细胞的表达。设立脂质体向OSCC细胞转染miR-655 Mimics组、miR-655 NC组及脂质体处理的空白对照组,按CCK8试剂盒说明,检测转染后的细胞增殖水平。
1.2.4 转染Mimics后OSCC细胞的迁移及侵袭能 取对数生长期及状态良好的转染Mimics人OSCC细胞,设为miR-655 Mimics组、miR-655 NC组及脂质体处理的空白对照组,胰酶消化,无血清培养基重悬,备用。低温环境下在24 孔板中预先加入500 μL的含有10%胎牛血清的培养基,放入Transwell小室,在上室面接入100 μL(1×105/mL)细胞悬液,置于37 ℃ 5%CO2孵箱培养24 h,取出Transwell小室,用棉签将上室未迁移的细胞擦干净,迁移至下室的细胞予以甲醛固定25 min,0.1%结晶紫染色,室温放置20 min,光学显微镜计算细胞数目,随机5 个视野计数。侵袭实验,预先采用,Matrigel胶预先在4 ℃冰箱过夜融化,用培养基按1∶8比例稀释,包被Transwell小室,余步骤同迁移实验。
1.3 统计分析
2 结 果
2.1 miR-655在OSCC中的表达水平
342 例 OSCC组miR-655的表达量为(1.81±0.05),44 例癌旁组的表达量为(2.43±0.18)(t=1.141,P<0.001)(图 1A);qRT-PCR测定miR-655在40 例OSCC患者中,癌及癌旁组织标本的表达。结果示:癌和癌旁组织中的miR-655的表达分别为1.94±0.12和2.68±0.21(t=3.077,P=0.003),miR-655在癌组织中低表达,验证了TCGA分析结果(图 1B)。
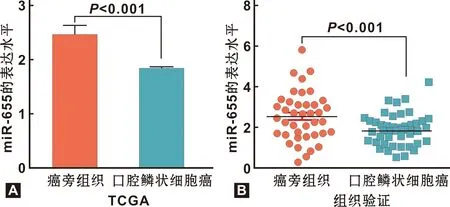
图 1 miR-655在OSCC和癌旁组织中的表达水平
2.2 miR-655与OSCC患者临床特征的相关性
342 例OSCC患者,miR-655高、低表达组与患者的年龄(P=0.102)、性别(P=0.567)、肿瘤分期(P=0.526)、吸烟史(P=1.000)和饮酒史(P=0.642)均无显著差异。两组与患者的肿瘤分级存在相关(P=0.044),提示miR-655的表达与OSCC肿瘤分级有关(表 1)。
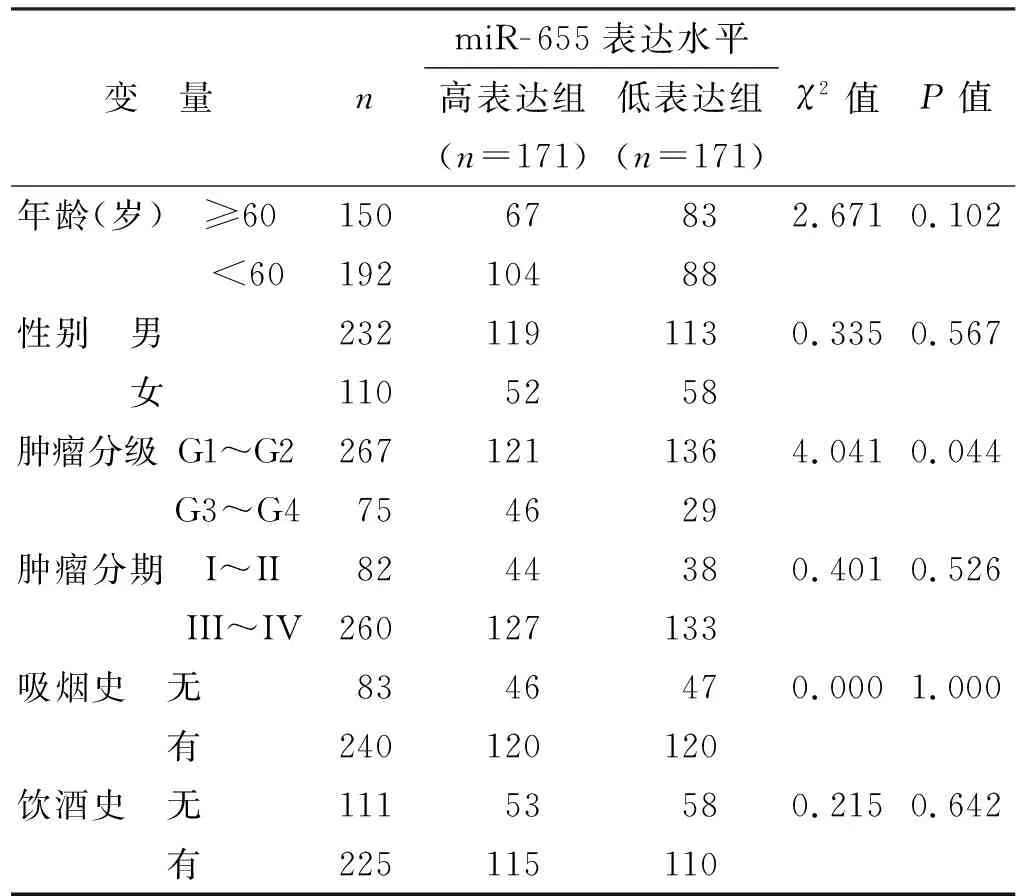
表 1 miR-655表达与OSCC患者临床特征的关系
2.3 miR-655与OSCC患者预后的关系
342 例OSCC患者随访时间为0.36~182.6 月(中位随访时间为21.3 月)。分析高、低表达组患者的总生存期,miR-655高表达患者总生存率优于低表达组(Log-rankP=1.19E-02)(图 2)。Cox回归分析提示:miR-655表达(HR:0.59,95% CI:0.53~0.95,P=0.020)、肿瘤分期和年龄是OSCC患者预后的独立因素(表 2)。
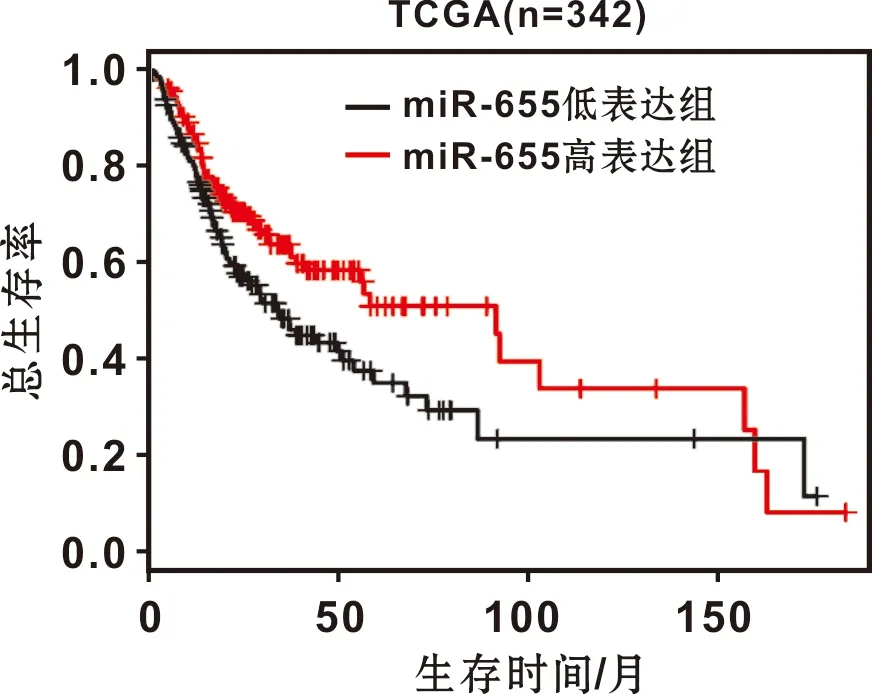
图 2 miR-655表达与OSCC患者总生存率的关系
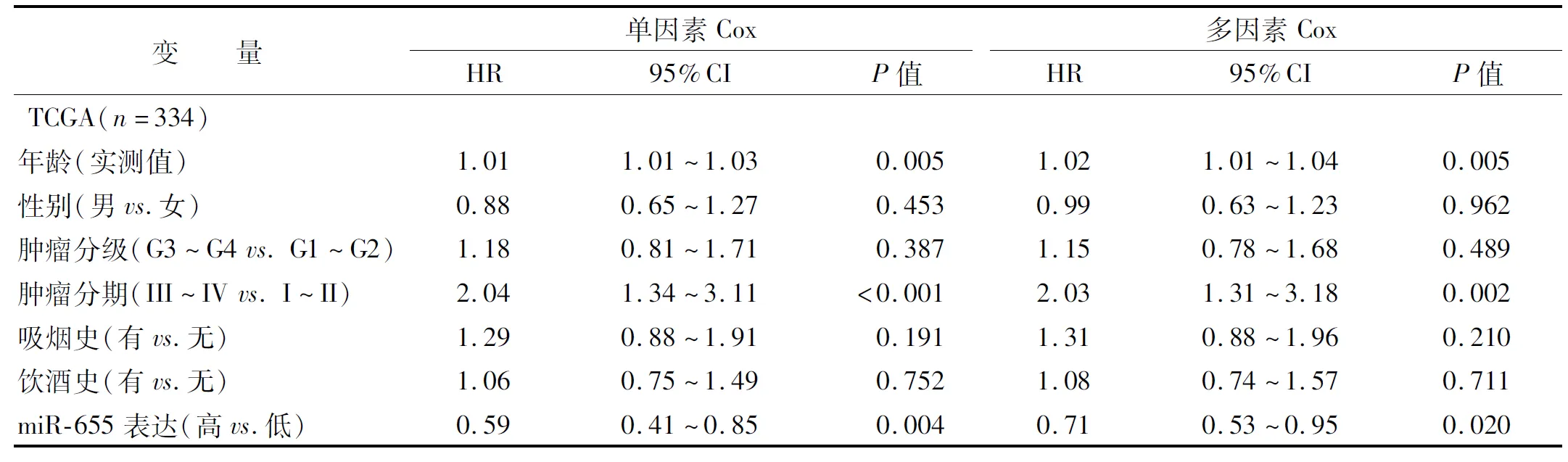
表 2 OSCC预后因素的Cox回归分析
2.4 PCR检测miR-655在OSCC细胞的表达及转染
qRT-PCR检测miR-655在OSCC细胞的表达水平,结果示:miR-655在OSCC细胞中表达与人口腔上皮细胞HOK比较表达下调,其中CAL-27细胞表达水平明显降低(t=5.074,P<0.001),本研究选择该细胞株进行后续实验(图 3A)。脂质体向CAL-27细胞转染,设立miR-655 Mimics组、miR-655 NC组及脂质体处理的空白对照组,按CCK8检测结果提示,转染后第2天,miR-655 Mimics组CAL-27细胞的增殖能力较空白组和NC组显著下降(P<0.001)(图 3B)。
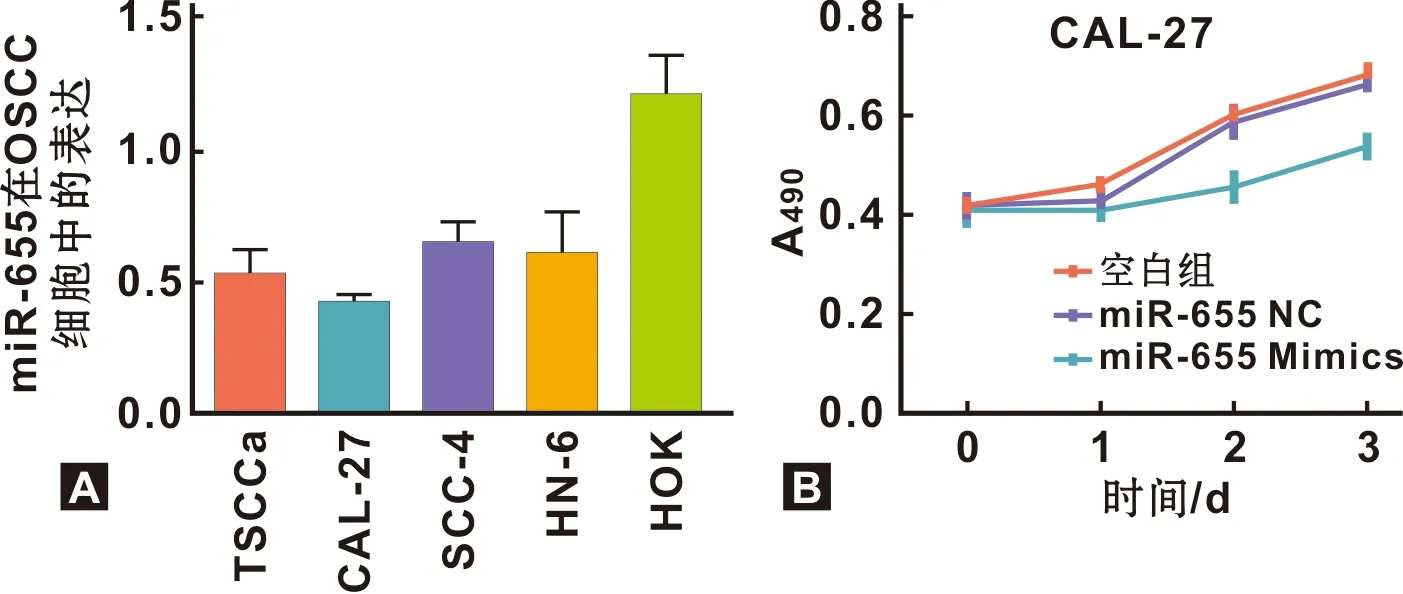
图 3 miR-655在OSCC细胞中的表达及其转染后的增殖影响
2.5 miR-655对OSCC细胞迁移及侵袭能力的影响
Transwell迁移及侵袭实验结果提示,与空白组及NC相比,转染Mimics的CAL-27细胞的迁移及侵袭能力减弱(图 4),差异具有统计学意义(P<0.001)。表明过表达miR-655可以明显抑制CAL-27细胞的迁移及侵袭能力。
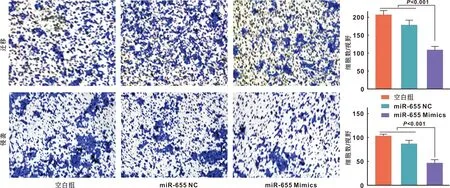
图 4 miR-655转染对CAL-27细胞细胞的迁移及侵袭能力的影响
3 讨 论
OSCC是严重威胁人类健康的一类恶性肿瘤,由于OSCC早期难以诊断、进展快,导致其预后情况较差[9-10]。目前OSCC的发病机制,可能是涉及多条通路、多个基因调控、环境等导致的多种复杂生物学过程。miRNA作为调控功能的非编码RNA,在肿瘤的发生及发展中,可作为肿瘤的潜在诊断及治疗的生物标志物[11]。本研究通过挖掘OSCC高通量测序数据,发现miR-655在OSCC组织中呈低表达,并且高表达组miR-655的OSCC患者的肿瘤分级较好、预后优于低表达组,提示miR-655在OSCC中的抑癌作用。
目前关于miR-655对OSCC的临床表达及预后,国内尚未见报道,但miR-655作为新报道的非编码RNA,目前已有研究报道miR-655在一些肿瘤中低表达,呈抑癌基因的作用。Gajera等[12]研究报道了miR-497-5p和miR-655的表达通过调节人类非综合征型唇腭裂的候选基因来抑制细胞增殖,提供了关于miRNA在非综合征型唇腭病因中的作用的可能机制,并提出了诊断非综合征型唇腭的可能策略。Zha等[13]的研究报道,miR-655可能通过调控VEGF的表达抑制卵巢癌细胞的增殖和侵袭,因此miR-655/VEGF途径可作为卵巢癌患者的新型治疗靶点。Oshima 等[14]研究提示将靶向肿瘤的miR-655与奥沙利铂通过纳米粒子的共同传递,抑制了肝癌的生长,提示通过使用肿瘤特异性纳米粒子共同递送microRNA和常规细胞毒剂,可以潜在地治疗转移性肝癌。本研究采用大数据挖掘发现miR-655在OSCC组织中呈低表达,并通过qRT-PCR验证了miR-655在OSCC患者表达情况,与以上研究结果是相一致的,因此推测miR-655在OSCC具有抑制肿瘤的作用。在进一步分析中,首次探讨了miR-655与OSCC患者的肿瘤分级及预后相关性,发现miR-655高表达患者总生存率明显优于低表达组,与肿瘤分级负相关。Cox回归分析提示miR-655表达水平是OSCC患者预后的独立因素。有研究发现血浆中低水平的miR-655与淋巴浸润和不良预后有关,血浆中miR-655水平的恢复可能抑制食管鳞状细胞癌的淋巴进展,改善预后[15]。Zhao等[16]研究证实miR-655的低表达与肝癌患者的血管浸润、肿瘤分级、淋巴进展显著有关,为肝癌的独立预后因素(HR=1.533, 95%CI:0.988-3.891;P=0.002),可能为潜在的不利预后生物标志物。这些研究支持本研究的结果,表明了miR-655在OSCC中可能的预测价值。
目前miR-655在OSCC的具体作用机制,尚未见报道,这也是进一步研究的重点。本研究首次对miR-655在OSCC中可能的影响进行了初步的功能探讨,结果提示,miR-655在OSCC细胞系中表达下调,过表达miR-655可以明显抑制CAL-27细胞的增殖、迁移及侵袭能力,体外实验证实了生物信息学分析的结果。相关研究证实miR-655通过直接靶向PAX6并抑制ERK和p38 MAPK信号通路来抑制视网膜母细胞瘤细胞的恶性生物学行为,以及通过调节肝细胞癌中的ADAM10和β-catenin途径而发挥抑癌作用[17-18]。以上研究表明了miR-655在恶性肿瘤的可能作用机制,可能与磷酸化/去磷酸化调控及信号传导分子的表达或活性抑制相关,进一步支持miR-655在OSCC中具有较大的生物学意义。
综上所述,本研究结果提示miR-655在OSCC组织中呈低表达,与肿瘤病理分级有关,可作为其预后评估的潜在标志物,为OSCC的治疗提供新的靶点,其作用机制可能与miR-655影响OSCC的增殖、迁移及侵袭能力有关。

