LINC00705通过调控miR-143-3p影响口腔鳞癌细胞增殖及转移能力的探究
马稔秋 崔丽娟 杜炜
2018 年口腔癌新发病例约35.5 万,引起相关死亡约17.7万[1],其中口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)占全部口腔癌的90%以上。手术联合化疗的治疗方案在临床收获了较好的疗效,但中晚期及复发OSCC的患者预后不佳,明确OSCC进展的机制对于相关诊断标志物及药物靶标的发现具有重要价值。长链非编码RNA(long non-coding RNA,LncRNA)是表观遗传及转录调控的关键参与者,与肿瘤的发生发展密切相关,包括OSCC[2-3],但以目前的发现仍不足以完全阐明影响OSCC进展的调控网络。本研究通过生物信息学检索发现与OSCC患者预后密切相关的LncRNA LINC00705,并通过分子生物技术明确了LINC00705的体外生物学效应及相关机制,揭示了该分子在OSCC诊断及治疗应用中的潜在价值。
1 材料与方法
1.1 主要实验材料及仪器
人胚肾细胞293T、人口腔上皮细胞系HOEC及人OSCC细胞系CAL-27、SCC-4、SCC-9、SCC-25及Tca8113(上海生命科学研究院);DMEM、DMEM/F12培养基及胎牛血清(FBS)(Hyclone,美国);RNAiso Plus(Trizol)、逆转录试剂盒PrimeScript RT reagent Kit、核酸荧光染料SYBR Green I(Takara,日本);慢病毒包装载体、plvx-LINC00705及plvx-Vector载体、miR-143-3p mimic及NC mimic(上海汉恒生物);转染脂质体Lipofectamine MessengerMAX(Thermo,美国);CCK-8试剂(上海翊圣生物);Tranwell小室及Matrigal基质胶(BD,美国);Passive Lysis Buffer(PLB)裂解液、Luciferase Assay Reagent II及psiCHECK2载体(Promega,美国)。
1.2 临床样本资料
收集内蒙古赤峰学院附属医院口腔科2018 年09 月 01日~2019 年12 月20 日收治的46 例OSCC患者,所有患者均首次诊断为恶性肿瘤,术前未行任何形式的抗肿瘤治疗,所有提供肿瘤及癌旁组织的患者均对本研究知情同意,并签字。
1.3 细胞培养及处理
293T、CAL-27、SCC-4、SCC-9、SCC-25细胞采用DMEM+10%FBS培养,Tca8113细胞采用DMEM/F12+10%FBS培养,培养环境:37 ℃+5%CO2。利用慢病毒转染技术在Tca8113细胞中转染LINC00705过表达及相应的空白对照载体作为过表达组及空白组,在过表达组细胞中转染miR-143--3p mimic作为回复组;在SCC-9细胞中转染LINC00705敲降载体1#、2#及相应的干扰对照载体作为干扰1组、干扰2组及对照组。转染方法:在对数生长期的293T细胞中利用脂质体转染慢病毒包装载体+目的载体(1.5 μg),收集病毒悬液与完全培养基1∶1混合培养Tca8113或SCC-9细胞3 d,1 μg/mL嘌呤霉素筛选细胞2 周以上。
1.4 实时荧光定量PCR(RT-qPCR)
TRIzoL试剂提取临床组织样本或各组细胞的总RNA,逆转录试剂盒对1 μg总RNA进行逆转录,另取1 μg总RNA进行miR-143-3p特异性的逆转录,转录产物cDNA稀释至500 μL,将β-Actin、LINC00705及miR-143-3p引物与相应cDNA产物混合,在10 μL SYBR Green I体系中进行反应,反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min扩增循环30 次;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。以β-Actin为内参基因,2-ΔΔCT公式计算LINC00705及miR-143-3p的相对表达水平。
1.5 CCK-8实验
以1 000 个/孔细胞密度接种各组细胞于96孔细胞培养板中,每组设置5 个重复孔,在细胞贴壁后的0、24、48、72 h及96 h于待测孔中加入10 μL CCK-8试剂,避光于37 ℃+5%CO2环境下培养3 h,检测450 nm处吸光度(A)值,以各时间点相比0 h A值增高的倍数衡量细胞相对增殖能力。
1.6 Transwell侵袭及迁移实验
无血清培养基稀释10×Matrigel基质胶,滴加至Transwell小室上室面中央,风干6 h后无血清培养基水化10 min备用。各组细胞消化重悬后进行细胞计数,调整细胞浓度至5×105个/mL并以含培养基+1%FBS重悬,200 μL细胞悬液接种至Transwell小室,下室面加入600 μL培养基+10%FBS,以含Matrigel基质胶的Transwell小室为侵袭模型,未含Matrigel基质胶的Transwell小室作为迁移模型,37 ℃+5%CO2环境下培养48 h,无水乙醇固定细胞10 min,0.1%结晶紫染色20 min,40×显微镜下拍照,采用ImageJ软件进行细胞计数。
1.7 荧光素酶报告基因实验
构建LINC00705全长序列+psiCHECK2载体(psiCHECK2-705),接种293T细胞于6孔细胞培养板中,分为NC组及miR组,NC组通过脂质体转染psiCHECK2-705载体及NC mimic,miR组转染psiCHECK2-705载体及miR-143-3p mimic,转染后48 h,200 μL PLB裂解液处理细胞30 min,取10 μL加入避光的96孔板中,100 μL预混Luciferase Assay Reagent II检测荧光强度为RLU1,加入100 μL预混Stop&Glo Reagent检测荧光强度为RLU2,以RLU1/RLU2作为各组相对荧光强度。
1.8 统计学方法
使用SPSS 23.0软件进行统计学分析,单因素方差分析比较计量资料多组间差异,两两比较采用SNK-q法,检验水准α=0.05。
2 结 果
2.1 生物信息技术分析LINC00705在 OSCC组织中的临床表达特征
根据GEPIA平台(http://gepia.cancer-pku.cn/index.html)中提供的数据显示,头颈鳞癌(head and neck squamous carcinoma,HNSC)组织中LINC00705表达显著高于正常癌旁组织(P<0.01,图 1A),且高表达LINC00705的HNSC患者无病生存时间显著低于低表达患者(P<0.01,图 1B)。

图 1 LINC00705在 OSCC组织中的表达特征
2.2 病理组织中LINC00705和miR-143-3p的表达
RT-qPCR结果显示,相比正常癌旁组织,OSCC组织中LINC00705表达显著增高(P<0.01,图 2A),miR-143-3p表达显著降低(P<0.01,图 2B),两者在OSCC组织中表达显著负相关(R=-0.484,P<0.01,图 2C),图 2D为口腔鳞癌组织HE染色。
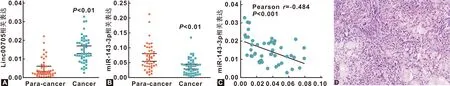
图 2 OSCC中LINC00705及miR-143-3p的表达及其相关性
2.3 各组细胞LINC00705及miR-143-3p的表达比较
RT-qPCR结果显示,相比空白组,过表达组Tca8113细胞中LINC00705表达显著增高,miR-143-3p表达显著降低(P<0.01),相比过表达组,回复组LINC00705表达无显著变化(P>0.05),miR-143-3p表达显著增高(P<0.01,图 3A);相比对照组,干扰1组及干扰2组SCC-9细胞中LINC00705表达显著降低(P<0.01),miR-143-3p表达显著增高(P<0.01,图 3B),图 3C为细胞转染后荧光表达情况。
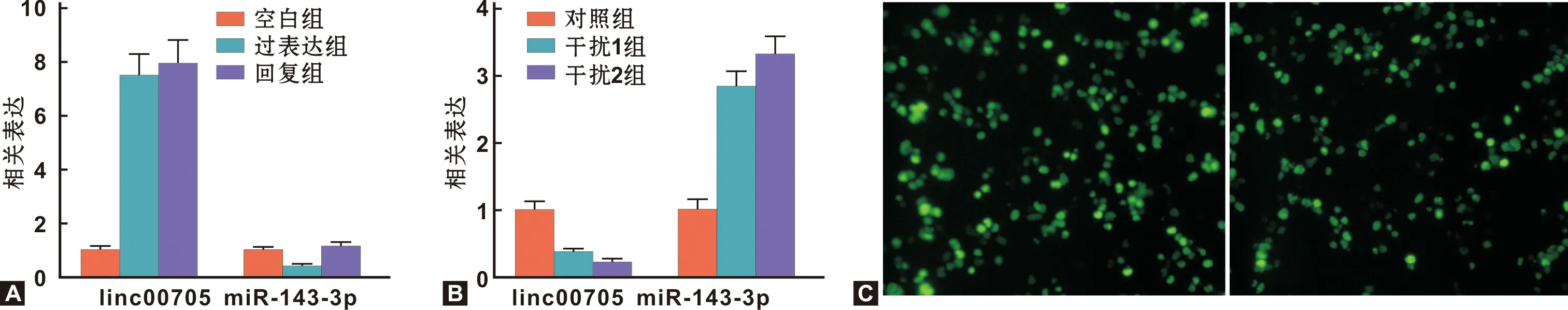
图 3 各组细胞中LINC00705及miR-143-3p表达的比较
2.4 各组细胞增殖能力的比较
CCK-8结果显示,相比空白组,过表达组48 h及以后增殖能力显著增高(P<0.05),相比过表达组,回复组48 h及以后增殖能力显著降低(P<0.01,图 4A);相比对照组,干扰1组及干扰2组48 h及以后增殖能力显著降低(P<0.01,图 4B)。
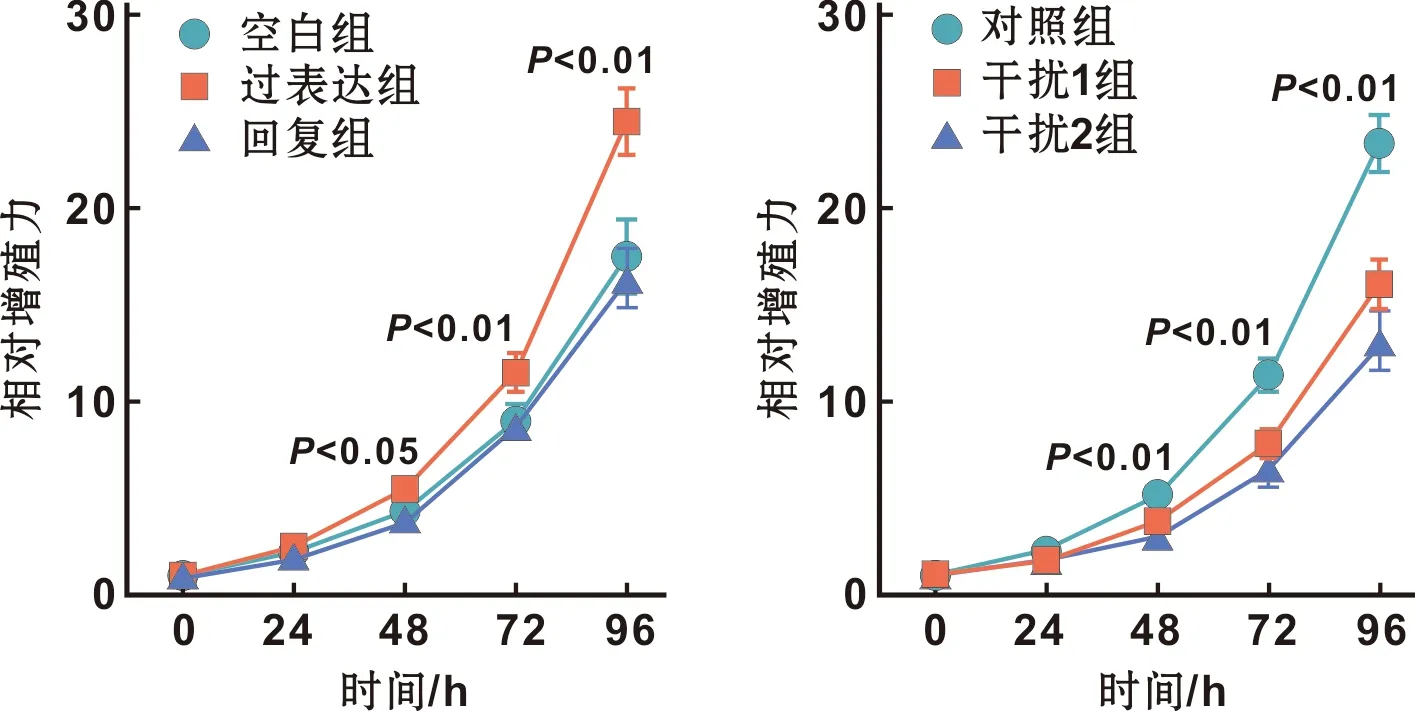
图 4 各组细胞相对增殖能力的比较
2.5 各组细胞侵袭及转移能力的比较
Transwell侵袭及迁移结果显示,相比空白组,过表达组侵袭及迁移细胞数显著增多(P<0.01),相比过表达组,回复组侵袭及迁移细胞数显著降低(P<0.01,图 5);相比对照组,干扰1组及干扰2组侵袭及迁移细胞数显著降低(P<0.01,图 5)。
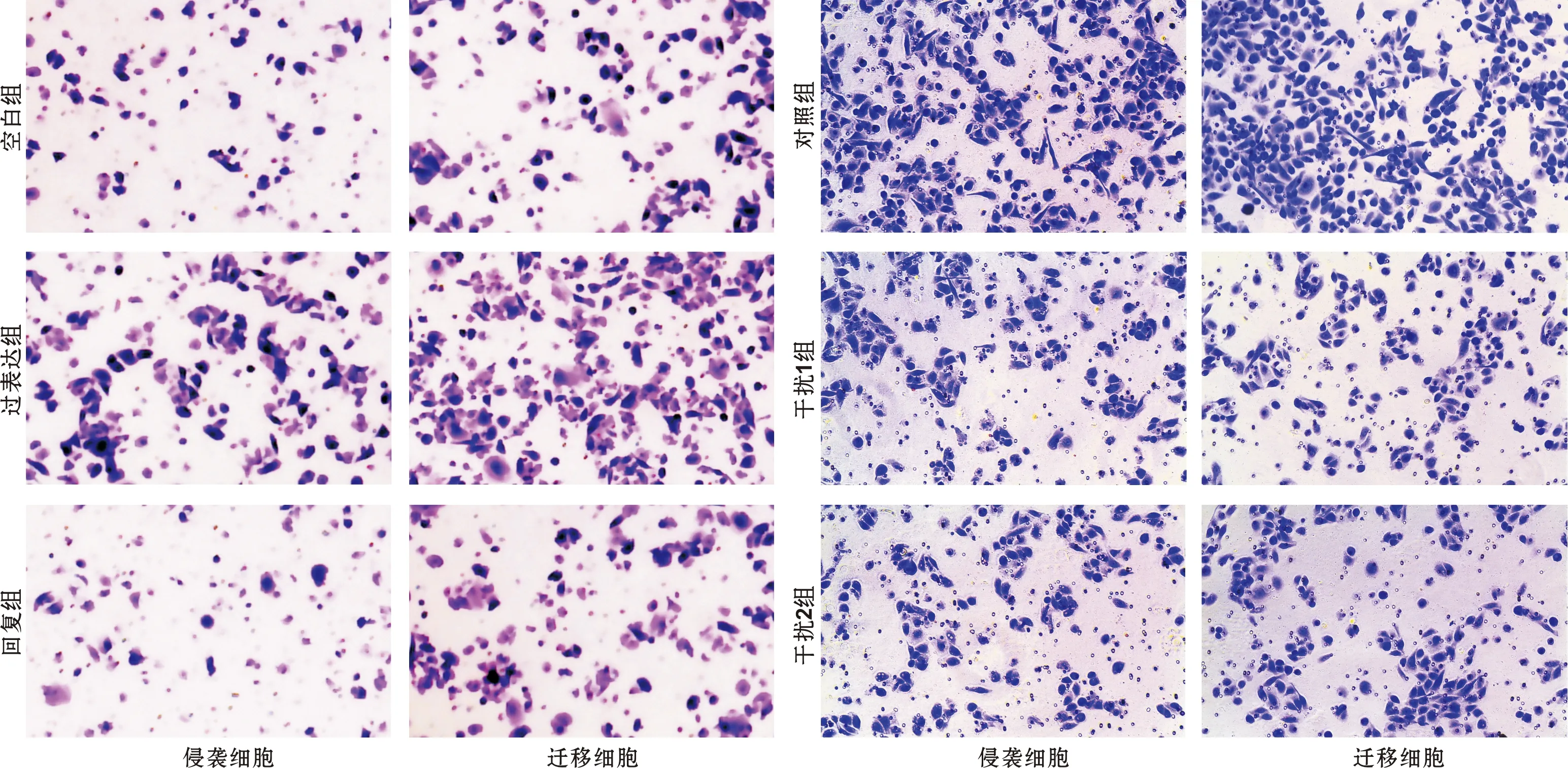
图 5 各组细胞的相对增殖能力
2.6 miR-143-3p对LINC00705荧光素酶表达的影响
LncBase Predicted v2平台(http://carolina.imis.athena-innovation.gr/diana_tools/web)分析结果显示,LINC00705与miR-143-3p存在碱基互补配对序列(图 6)。荧光素酶报告基因结果显示,相比共转染NC mimic载体(NC mimic相对荧光表达量:1.000±0.126),转染miR-143-3p mimic可显著降低LINC00705荧光素酶的表达(miR-143-3p mimic相对荧光表达量:0.319±0.045,P<0.01)。

图 6 LINC00705与miR-143-3p预测结合区域
3 讨 论
LncRNA在恶性肿瘤中重要的生物学价值已被广泛的研究证实[4],其可与蛋白直接结合,直接影响靶蛋白的结构及功能[5],但更多是作为内源竞争RNA(competing endogenous RNAs,ceRNA)影响靶微小RNA(microRNA,miRNA)的生物学效应,进而间接调控miRNA的靶蛋白[6-7]。本研究通过生物信息技术发现LINC00705在OSCC组织中高表达,并与患者预后不良密切相关,提示LINC00705在OSCC中可能具有重要研究价值。而Liu等[8]研究发现LINC00705在乳腺癌复发患者的肿瘤组织中表达显著上调,暗示了LINC00705可作为乳腺癌预测复发的潜在标志物,因此,对LINC00705的靶miRNA进行分析,结果显示miR-143-3p与LINC00705转录本229-253序列存在互补序列,且连续互补片段为9-mer,提示结合可能性较强。而miR-143-3p被多项研究证实在不同来源的恶性肿瘤中发挥抑癌作用:He等[9]发现miR-143-3p在食管鳞癌组织中表达显著降低,且其低表达与患者预后不良密切相关,体内外研究显示RNA结合蛋白QKI-5是miR-143-3p的直接靶蛋白,miR-143-3p可通过抑制QKI-5 mRNA的表达,介导细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)及细胞增殖转移能力的抑制;Chen等[10]发现miR-143-3p在乳腺癌组织中低表达,且受到MYB原癌基因样蛋白2(MYBL2)的负向调控,miR-143-3p的过表达可抑制乳腺癌细胞体内外的恶性表型;同时,miR-143-3p也参与调控OSCC的恶性表型,其被发现在OSCC组织中表达显著降低,且作为lncRNA UCA1及MALAT1的靶基因,显著抑制OSCC细胞的恶性行为[11-12]。另外miR-143-3p在结直肠癌、胰腺导管腺癌及宫颈癌中发挥抑癌作用[13-15]。
上述研究表明miR-143-3p作为抑癌因子在不同来源的恶性肿瘤中发挥生物学作用,而考虑到LINC00705在OSCC中有待阐明的生物学意义及其与miR-143-3p潜在的相互作用,本研究在OSCC临床组织样本中进行了LINC00705与miR-143-3p表达相关性的分析,结果显示两者表达显著负相关,提示了两者在OSCC中存在潜在的调控作用,体外研究显示,过表达LINC00705可促进OSCC细胞的恶性表型,而干扰LINC00705则抑制细胞的增殖转移能力。在回复miR-143-3p表达后,LINC00705的促癌作用被完全拮抗,同时,miR-143-3p对LINC00705荧光素酶的抑制作用提示两者存在相互结合作用。综上,本研究表明LINC00705可下调OSCC细胞中miR-143-3p的表达,促进细胞增殖及转移能力。在接下来的研究中将以balb/c裸鼠为体内模型探究LINC00705的体内生物学效应,并通过扩大临床样本及长期随访,明确LINC00705的临床意义,以期为相关药物靶标及诊断试剂盒的研发提供关键依据。

