激素受体阳性的男性乳腺癌列线图模型的构建*
汤蕾,符德元,沈楷文,王建文
225001 江苏 扬州,扬州大学医学院 甲状腺乳腺外科(汤蕾、沈楷文、王建文);225001 江苏 扬州,苏北人民医院 甲状腺乳腺外科(符德元)
男性乳腺癌(male breast cancer,MBC)具有罕见性,约占男性恶性肿瘤的0.1%,因此大多数主要的试验仅仅包括女性乳腺癌患者,目前对MBC缺乏系统性的研究,MBC治疗策略的制定也主要是基于女性乳腺癌的临床试验,往往达不到预期的疗效[1]。而且由于男性患者对乳腺癌的危害性认识不足,MBC患者确诊时往往年龄较大,分期更晚,肿瘤分级更高,预后更差[2]。
大部分MBC都是激素受体(hormone receptor,HR)阳性的,然而针对HR受体阳性的MBC的研究并不多见,此类患者预后的影响因素尚不明确[1]。本研究基于美国国立癌症研究所的监测、流行病学和结果数据库(The Surveillance, Epidemiology, and End Results,SEER)分析1990年至2015年诊断的2 735例符合条件的HR阳性的MBC患者的病例资料,探讨其临床病理学特征及预后影响因素,通过构建列线图以期对HR阳性的MBC患者的1、3、5年生存率进行准确预测,为医师的临床决策提供参考意见。
1 资料与方法
1.1 研究对象
通过SEER*Stat(8.3.5版本)软件提取1990年1月至2015年12月期间的MBC患者。纳入标准:1)雌激素受体(estrogen receptor,ER)或孕激素受体(progesterone receptor,PR)阳性[3];2)仅一种原发癌;3)单侧乳腺癌;4)病理学确诊为浸润性乳腺癌。排除标准:1)原位癌及原发癌瘤未查出患者(Tis及T0期患者);2)原发癌瘤及区域淋巴结无法评估的患者(TX及NX期患者);3)出现远处转移的患者或远处转移无法评估的患者(MX及M1期患者);4)临床分期未知的患者;5)死亡原因未知的患者;6)随访时间小于3个月或随访信息不完整的病例。
1.2 研究方法
最终纳入2 735例符合条件的HR阳性的MBC患者。本研究纳入生存时间为总生存期(overall survival,OS), 随访的主要终点事件定义为患者死亡,随访结束时间为2020年6月30日,随访时间小于3个月或随访信息不完整的病例为失访病例。
将年龄、种族、原发部位、病理类型、病理分级、部位、是否行手术治疗、是否行化疗、分期、T分期、N分期以及确诊时的婚姻状况纳入研究。根据ICD-O-3(国际疾病分类肿瘤学专辑第三版)将病理类型分为浸润性导管癌组(invasive ductal carcinoma,IDC)、浸润性小叶癌组(invasive lobular carcinoma,ILC)以及其他组;将确诊时的婚姻状态分为已婚组以及其他组。
由于大部分病例放疗信息不完整,并且人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)状态2010年后才可获得,故本研究不将是否行放疗与HER-2状态纳入分析。因病例来自1990年至2015年,年度跨度较大,为统一标准,所有病例均采用第六版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)乳腺癌TNM分期进行划分。
1.3 统计学方法
将病例按3∶1随机分为训练组(2 052例)与验证组(683例)后,使用 X-tile软件对训练组进行连续性变量年龄的相关分析,选取年龄的截断值;对训练组患者使用单因素和多因素Cox比例风险回归分析HR阳性MBC预后的影响因素,通过Kaplan-Meier法展示相关因素对于MBC患者生存率的影响,生存分析采用Log-Rank检验,以上统计均通过SPSS 26.0软件,Graphpad Prism(8.3.0版本)及R- 3.4.5软件分析完成。检验水准α=0.05。采用R-3.4.5软件进行列线图预后模型的构建,使结果可视化,并使用一致性指数(C-index)及绘制校准曲线检验模型的准确性。
2 结 果
2.1 年龄截断值的确认
X-tile软件分析结果显示,在2 052例训练组中的HR阳性的MBC患者中年龄最佳的截断值为64岁与79岁,因此训练组患者分为三组(22~64岁,65~79岁,≥80岁,图1)
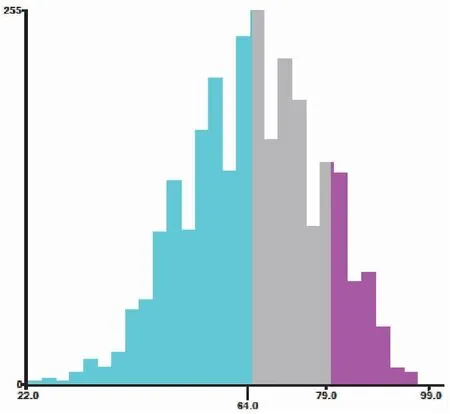
图1 X-tile软件SEER数据库HR阳性的MBC患者的最佳年龄截断值
2.2 HR阳性的MBC患者的临床病理学特征
共评估了2 052例训练组中的HR阳性的MBC患者,患者随访时间为3~299月,中位随访时间为61月。结果显示,大多数患者为白种人(82.3%),已婚患者(71.9%),病例类型为浸润性导管癌(87.7%),病理分级I/II级(66.0%)。48.5%的患者年龄在22~64岁之间,原发部位在乳房中央部的患者占58.8%,T1期和T2期的患者分别占50.0%和41.6%。HR阳性的MBC患者中病理性淋巴结分期为N0期占55.9%,N1期占29.9%,N2期占9.3%,N3期占4.9%。98.5%的患者行手术治疗,40.2%的患者行化疗。训练组与验证组HR阳性MBC患者的临床病理学特征差异无统计学意义(P>0.05)。具体的临床病理学特征见表1。
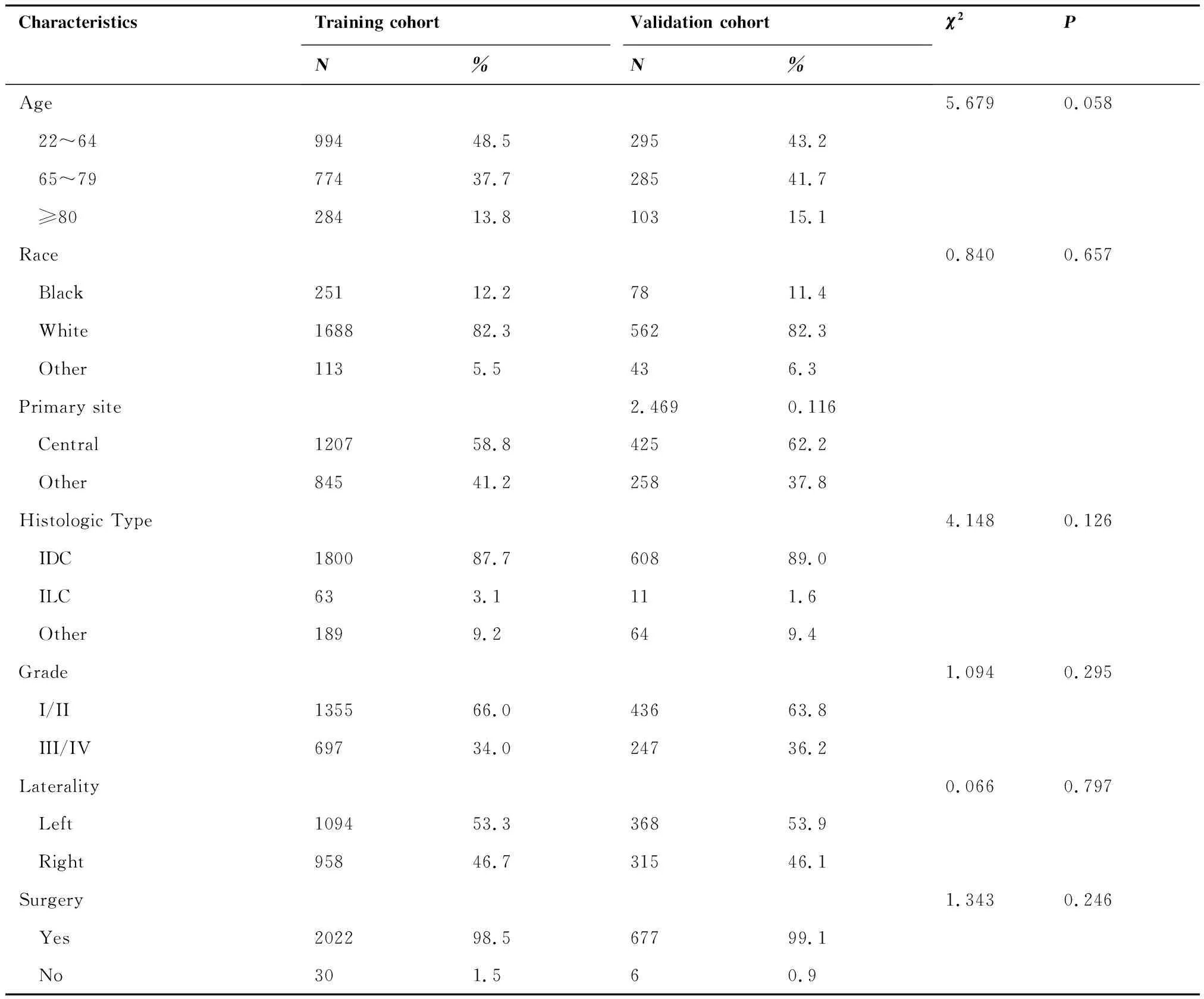
表1 训练组与验证组HR阳性MBC患者的临床病理学特征
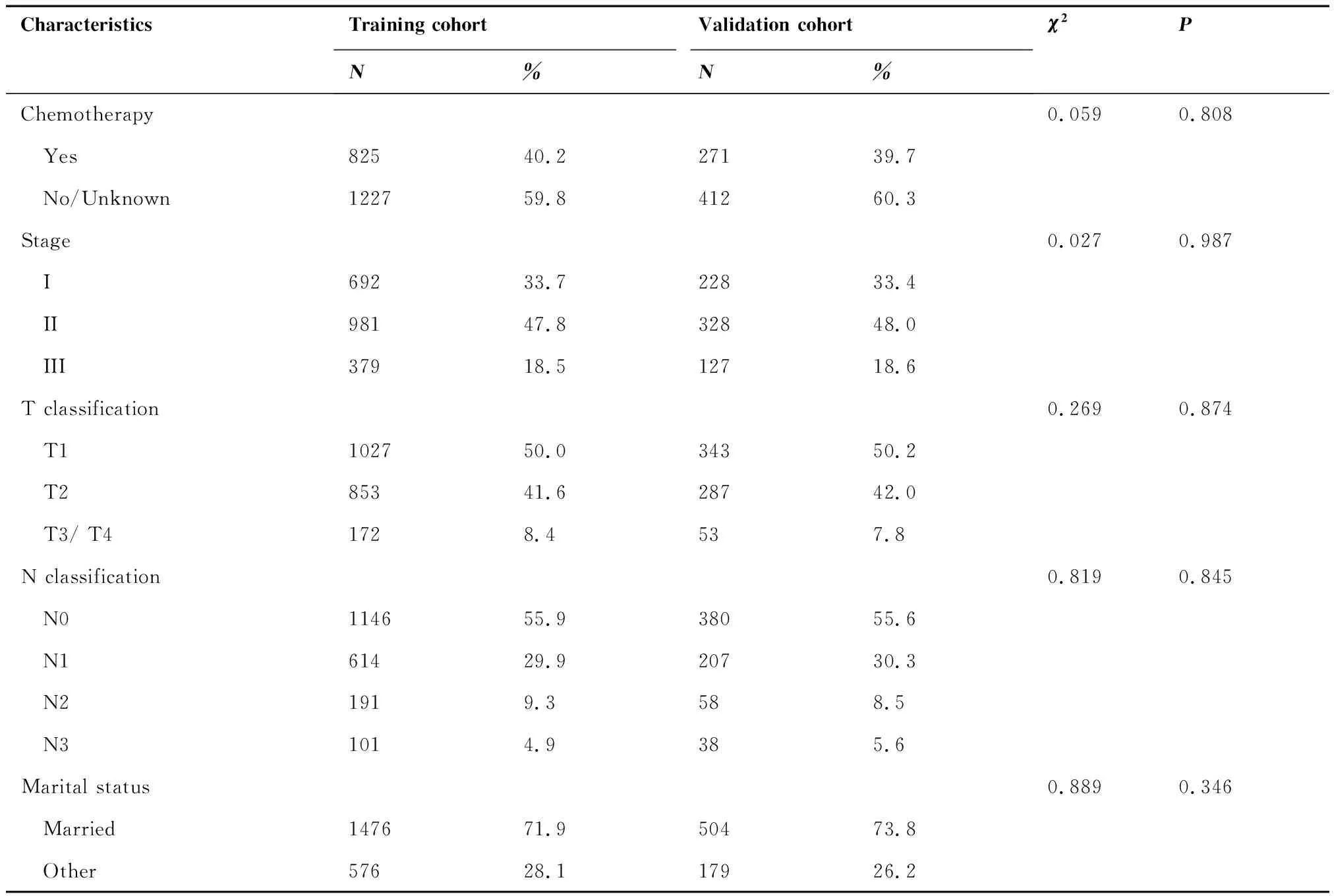
CharacteristicsTraining cohortValidation cohortN%N% χ2PChemotherapy0.059 0.808 Yes82540.2 27139.7 No/Unknown122759.8 41260.3 Stage0.027 0.987 I69233.7 22833.4 II 98147.8 32848.0 III37918.5 12718.6 T classification 0.269 0.874 T1102750.0 34350.2 T285341.6 28742.0 T3/ T41728.4 537.8 N classification0.819 0.845 N0114655.9 38055.6 N161429.9 20730.3 N21919.3 588.5 N31014.9 385.6 Marital status0.889 0.346 Married147671.9 50473.8 Other57628.1 17926.2
2.3 HR阳性的MBC患者总体生存率的影响因素
对训练组进行单因素Cox比例风险回归分析,结果显示,除病理类型和部位因素外,年龄、种族、原发部位、病理分级、是否行手术治疗、是否行化疗、分期、T分期、N分期、确诊时的婚姻状态均与HR阳性的MBC患者的总生存率存在显著相关性(P<0.05)。由于原发部位在乳房内上象限、内下象限、外上象限、外下象限及重叠病变的总生存率之间没有明显的统计学差异,因此将这四种原发部位合并为其他部位,将原发部位分为乳房中央部与其他部位之后纳入Cox回归模型。
将年龄等单因素Cox比例风险回归分析有统计学意义的变量纳入多因素Cox比例风险回归分析。结果显示,年龄、种族、病理分级、是否行手术治疗、是否行化疗、T分期、N分期以及确诊时的婚姻状态为HR阳性MBC的独立预后因素。训练组患者的单因素及多因素Cox比例风险回归分析结果见表2。
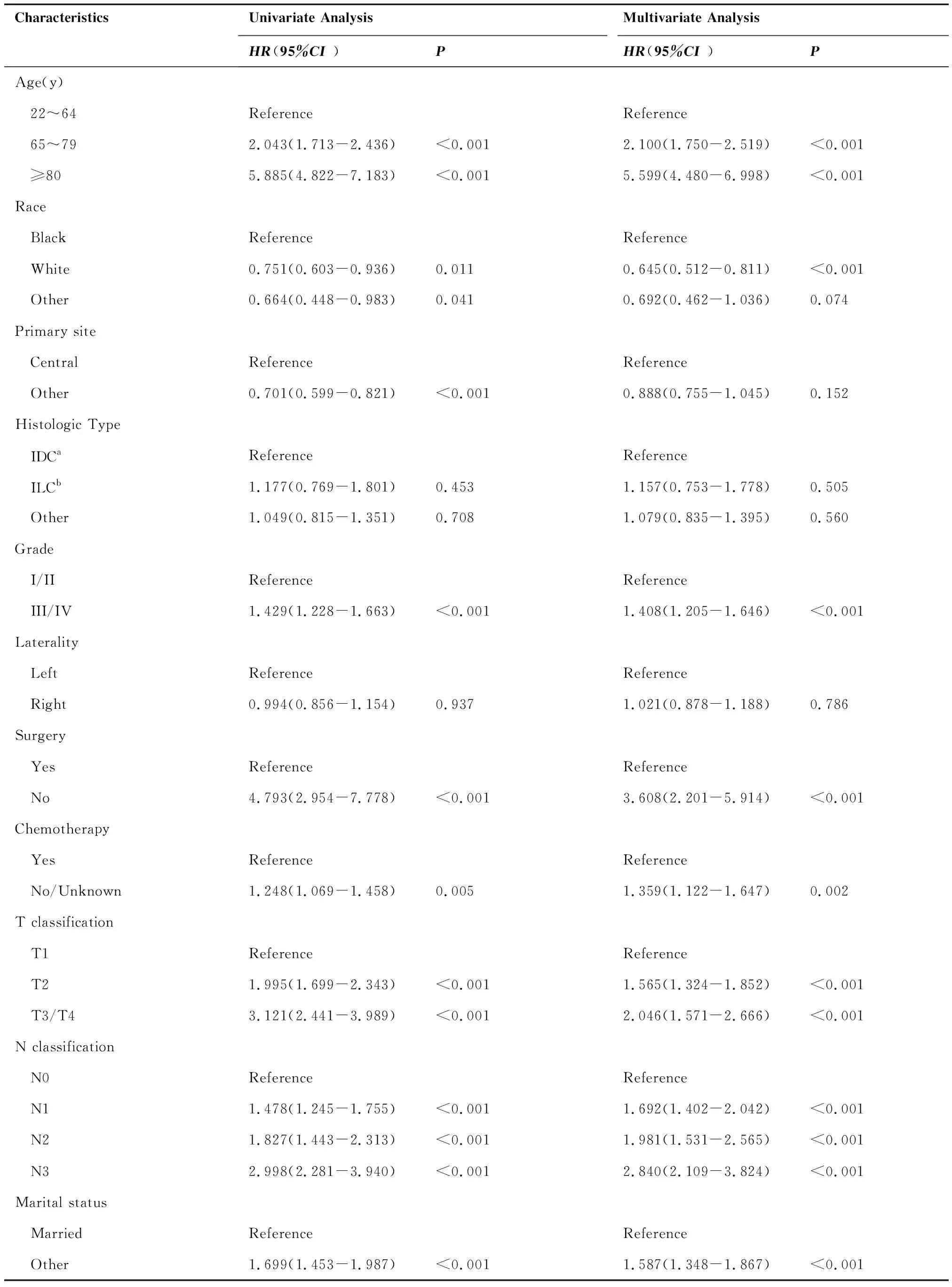
表2 训练组患者的单因素及多因素Cox比例风险回归分析
使用Graphpad Prism(8.3.0版本)软件的Kaplan-Meier法绘制生存曲线,图2示年轻的(22~64岁),接受化疗与手术治疗,病理学分级I/II级的,TNM分期为T1M0N0期的已婚的其他种族(美洲印第安人/阿拉斯加原住民,亚洲/太平洋岛民)患者生存曲线明显不同于其他组病人,使用Log-Rank检验差异具有显著统计学意义(P<0.05)。
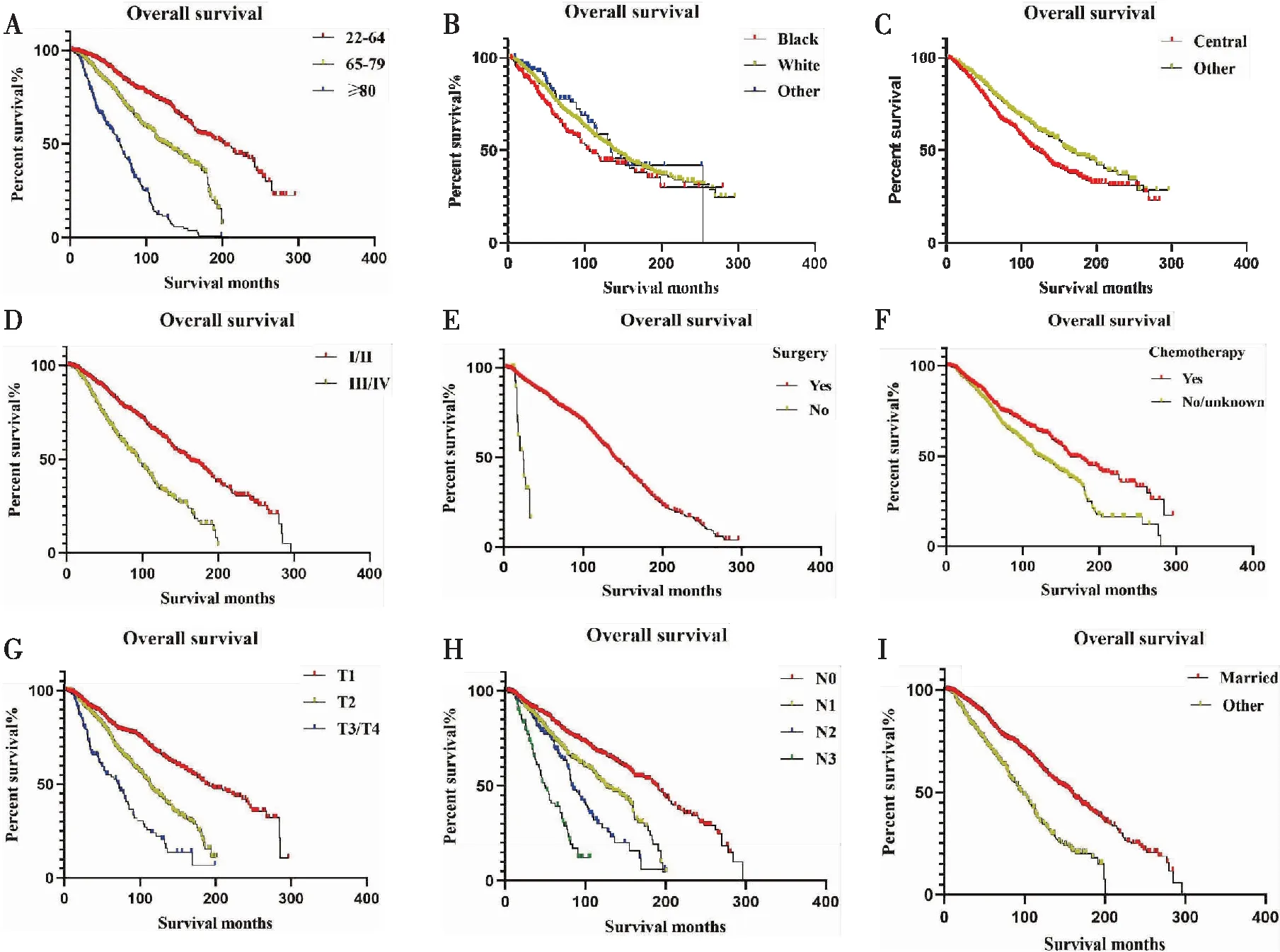
图2 Kaplan-Meier法绘制生存曲线(A~I)
2.4 列线图的构建及验证
使用R-3.5.3软件将与HR阳性的MBC患者总生存率有相关性的因素包括年龄、种族、原发部位、病理分级、是否行手术治疗、是否行化疗、T分期、N分期、婚姻状态在内的9个因素纳入到列线图的绘制,得出HR阳性的MBC患者1、3、5年的总生存率的预测图(图3),采用C-index对模型的预测能力与准确性进行检验,C-index越大表明预测能力越强。然后,使用Bootstrap法对列线图进行内部验证,自抽样次数B=1 000,训练组C-index=0.745[95%CI为(0.725,0.765)],验证组C-index=0.753[95%CI为(0.721,0.785)]。使用R-3.5.3软件绘制训练组与验证组列线图模型生存状况与实际生存状况的拟合曲线(图4、5)。训练组与验证组1、 3 、5年生存率的拟合曲线均靠近理想的 45°参考线,提示列线图模型预测生存状况与实际生存状况具有良好的一致性。
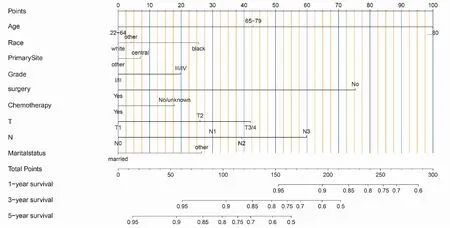
图3 基于训练组绘制激素受体阳性男性乳腺癌列线图
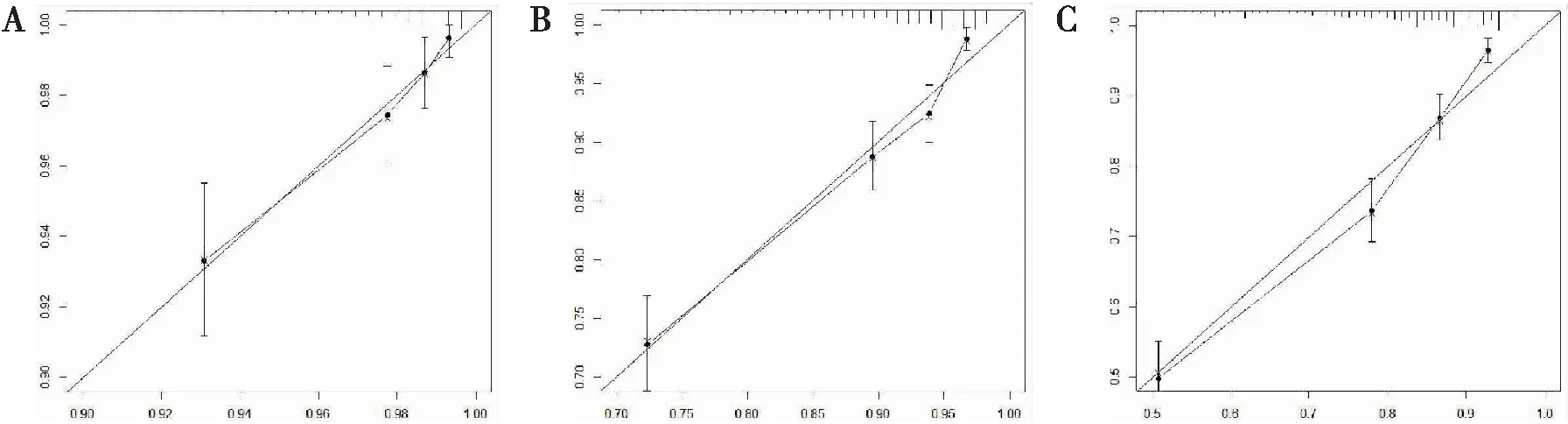
图4 训练组列线图模型生存状况与实际生存状况的拟合曲线(A:1年;B:3年;C:5年)
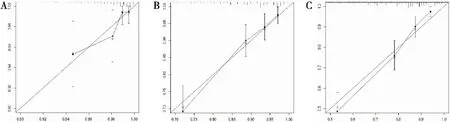
图5 验证组列线图模型生存状况与实际生存状况的拟合曲线(A:1年;B:3年;C:5年)
3 讨 论
HR阳性的MBC的病因学和治疗方法与绝经后女性乳腺癌相比更加复杂,同样的治疗手段往往无法产生预期的治疗效果。Losurdo等[2]研究发现大多数MBC患者主要表现为乳晕下无痛性肿块,最常见的病理类型为导管癌;MBC通常表现为HR阳性,Venigalla等[1]研究证实约99.3%的MBC患者表现为雌激素受体(estrogen receptor,ER)阳性,81.9%表现为孕激素受体(progesterone receptor,PR)阳性,除此之外,MBC的发病模式与女性乳腺癌也有所不同,女性乳腺癌的发病率呈现双峰模式,而MBC的发病年龄随着年龄的增长而增加,患者平均发病年龄晚于女性乳腺癌患者发病高峰,因此确诊时往往病情较重,预后更差[4-5]。根据Leone等[6-7]研究显示,I期和II期 MBC患者的OS与女性乳腺癌患者相比较差,而III和IV期MBC患者则与女性乳腺癌患者的OS相似。综上所述,尽管HR阳性的MBC是一种罕见的恶性肿瘤, 仍然需要对其特点及预后影响因素进行深入研究,以期改善HR阳性的MBC患者的OS。
EORTC 10085/TBCRC/BIG/NABCG[7]这项研究评估了1990年至2010年间诊断出的男性乳腺癌患者的回顾性队列,提供了有关MBC临床病理特征的最可靠的数据,研究结果如下:肿瘤分期为T1占49%,T2占38%,T3占2%,T4占11%。 病理性淋巴结分期为:N0(59%)、N1(32%)、N2(5%)和N3(3%)[8]。虽然本研究仅限于HR阳性的MBC患者,但是临床病理特征与EORTC 10085/TBCRC/BIG/NABCG研究得出的结论基本一致。
本研究利用SEER数据库进一步探讨了HR阳性的MBC的临床病理学特征及预后影响因素,将年龄、种族、原发部位、病理分级、是否行手术治疗、是否行化疗、T分期、N分期、确诊时的婚姻状态纳入预后模型以预测患者的1、3、5年生存率。利用SEER数据库对HR阳性的MBC患者的临床数据进行单因素Cox比例风险回归分析发现原发部位影响HR阳性的MBC患者的预后,由Kaplan-Meier曲线可知,原发部位在中央部的患者的预后劣于位于其他部位的患者,这可能是由于男性乳腺的乳头及乳晕下有丰富的淋巴管网,然而丰富的淋巴管网通常意味着更容易出现转移,因此预后往往更差。另外,由Kaplan-Meier曲线可知,接受手术治疗的患者的预后优于未接受手术治疗的患者,由于既往研究认为男性乳腺癌患者接受乳房切除术以及保乳手术的OS相似,因此本研究未将手术方式分为乳房切除术以及保乳手术进一步研究[9]。
雌激素治疗前列腺癌是MBC发展的另一个危险因素,原发性MBC与其他的癌症也密切相关,发生第二种癌症的风险增加34%[10-11]。本研究仅纳入仅乳腺癌一种原发癌的HR阳性的MBC患者,排除前列腺癌等其他激素依赖性恶性肿瘤对本研究的影响。另外,婚姻状况被认为是不同癌症类型中的保护性生存因素已被证实[12-14]。Adekolujo等[15]研究证实与已婚男性相比,未婚男性罹患IV期乳腺癌的风险更高,并且预后较差。Liu等[16]研究证明已婚是HR阳性的MBC患者的保护性生存因素,由于已婚组的HR阳性的MBC患者与其他组患者(单身、分居、离婚或丧偶的患者)相比,经济负担与心理压力小,因此已婚组患者相比其他组患者预后更好,这与本研究结果大致一致。但是由于本研究大部分患者年龄≥65岁,患者年龄可能对婚姻状态也会产生影响,年龄较大的患者的婚姻状态出现丧偶的几率更大,丧偶的患者与已婚的患者相比生存率更差。另外,年龄较大的患者可能因为经济原因或者因为无法耐受手术、化疗及化疗的毒副作用而选择不进行手术治疗与化疗,这可能也是造成年龄较大患者组的生存率低于其他组的原因之一。
本研究也存在一些局限性。首先,本研究主要集中在HR阳性的MBC患者,但由于病例来源于1990~2015年,年份跨度大,导致ER、PR的状态可能会随临床检测技术提高和阳性判定标准的改变产生偏差。另外有研究证实96.9%的MBC患者表达为雄激素受体(androgen receptor,AR)阳性,在Cardoso等的研究中,AR在87%的男性乳腺癌样本中高度阳性,AR已经逐渐成为MBC患者的一个新的治疗靶点,MBC中AR的表达预示了他莫昔芬治疗的不良预后和不良反应,而SEER数据库并不提供AR表达的相关信息[17-19]。另外,SEER数据库不提供内分泌治疗的相关信息,也不提供化疗的具体方案。第二, SEER数据库仅提供患者确诊时的婚姻状况,病程中患者的婚姻状态可能会随时间发生变化,任何变化都可能对生存形成影响。第三,Wei等[20]经研究证实ER+/PR-表型的MBC患者比ER+/PR+的患者更具侵略性,但我们的研究并未集中在这一方面,这也是此研究存在的一个局限性,这些局限性有待于今后的研究进一步完善。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

