高浓度二价铁胁迫对甜菜幼苗生长及光合特性的影响
董寅壮, 王 堽, 何敏敏, 耿 贵,2
(1.黑龙江大学 生命科学学院, 哈尔滨 150080; 2.黑龙江大学 现代农业与生态环境学院, 哈尔滨 150080)
0 引 言
水分、温度、盐度和营养元素等非生物胁迫会十分显著地影响植物的生长发育[1]。铁元素(Fe)对于植物的生长发育起着至关重要的作用,一定浓度范围内的铁元素对于植物的生长发育起促进作用。地壳中铁元素的丰度很高,其在全球土壤中也有广泛的分布,但主要都是以三价铁形式、氢氧化物、磷酸盐、氧化物或其他沉淀的化合物等难溶于水的形态存在[2],能被植物吸收利用的二价铁只占土壤总铁含量的一小部分[3]。在一些低洼地区或酸性土壤中,植物根际土壤环境会形成还原性较强的有机酸,导致土壤中以游离态形式存在的Fe2+浓度过高,从而影响植物的生长发育[4]。
大多数植物体内的铁含量为100~300 mg·kg-1[5],铁元素主要分布于细胞液泡、叶绿体以及许多铁蛋白中,它参与植物体内许多代谢过程,包括光合作用、叶绿素的生物合成、酶的活性和呼吸作用等[6]。高浓度的Fe2+会对植物的生长发育产生显著的抑制作用[7],植物干重中的铁超过一定数量就被认为是铁中毒[8]。研究发现,过量Fe2+胁迫不仅会导致豌豆幼苗的气孔抑制,而且会直接伤害其光合反应机构[9];水稻在过量Fe2+胁迫下,其细胞内的叶绿素含量显著下降,植株内的其他元素如P、N、K和Zn等的含量也会受到影响[10]。当前在植物应对低铁胁迫机制方面的研究较多,也较为透彻,但是在植物应对高铁胁迫机制方面的研究较少,尤其是高铁胁迫对于甜菜光合特性影响机制的研究十分有限。本研究以甜菜为研究材料,探究了高铁胁迫对于其生长及光合特性的影响。
甜菜是黎科,甜菜属,二年生草本植物,其块根中的蔗糖含量高达15%~20%[11],是目前我国甚至全世界都十分重要的糖料作物之一,其在我国是仅次于甘蔗的第二大糖料作物[12]。甜菜生长需要磷、钾、氮、钠、锰和铁等不同的营养元素,铁元素对于甜菜的生长、产量和糖分累积起着十分重要的作用[13]。目前,我国甜菜主产区尤其是东北一些地区土壤pH较低,易于二价铁的积累。另外,一些地区夏季涝害同样会造成二价铁浓度的升高,这些都会成为甜菜种植的障碍。本文通过研究高铁胁迫对甜菜幼苗生长指标、光合特性和脂膜通透性及渗透调节物质的影响,探究非生物胁迫对植物生理的损伤机制,为后续研究以及高二价铁条件下的甜菜种植提供参考。
1 材料与方法
1.1 材料与处理
本试验于2020年10月在黑龙江大学农作物研究院光照培养室进行,“KWS1176”甜菜种子购自德国KWS公司。将种子置于蛭石中加适量水,于光照培养室内使种子萌发,至子叶完全展开(7 d)后,将萌发一致的幼苗转移栽至2.5 L水培槽中,用1/2 Hoagland营养液培养,其中Fe2+以Fe(Ⅱ)-EDTA形态存在。光培室内温度保持在昼夜(28±2) ℃和(20±2) ℃,光照条件为450 μmol·(m2·s)-1,14 h/10 h(光照/黑暗),相对湿度保持60%~70%。6 d后将幼苗移至Fe2+浓度分别为0.12、0.24、0.48、0.96、1.92和3.84 mmol·L-1的营养液中培养,对照组为1/2 Hoagland营养液(Fe2+浓度0.06 mmol·L-1)培养的幼苗。每个处理设置6个重复,培养期间水培槽内24 h通气,每7 d更换一次培养液,幼苗处理14 d后收获,测定甜菜幼苗生物量、叶片光合色素含量、光合特性、膜脂通透性和渗透调节物质浓度等幼苗生理指标。
1.2 生理指标的测定
收获当天测定植株株高,之后立即测量植株各部位鲜重和干重;采用乙醇比色法[14]测定叶片光合色素的含量;使用CI-340手持式光合作用测量系统(美国CID公司)测定幼苗第二片真叶气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和净光合速率(Pn);采用硫代巴比妥酸(TBA)法[15]测定丙二醛(MDA);采用茚三酮比色法[16]测定游离氨基酸。
1.3 数据分析方法
采用Microsoft Office Excel 2019收集整理数据;用IBM SPSS Statistics 20.0专业软件对数据进行方差和Duncan法显著性检验(P<0.05);用Sigma Plot 14.0进行绘图。
2 结果与分析
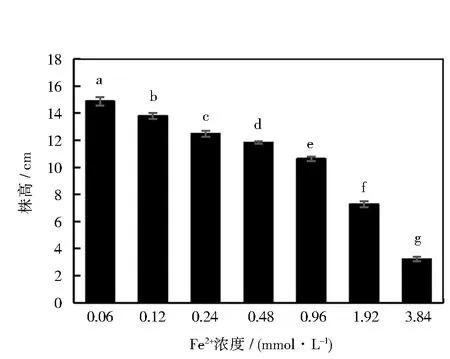
图1 不同浓度Fe2+对甜菜幼苗株高的影响Fig.1 Effects of different concentrations of Fe2+ on plant height of sugar beet seedlings注: 图中误差线表示标准差大小,不同字母代表处理间差异显著(P<0.05),下同
2.1 高铁胁迫处理对甜菜幼苗生长的影响
2.1.1 高铁胁迫处理对甜菜幼苗株高的影响
不同浓度的Fe2+对甜菜的株高会产生影响,由图1可以看出,随着营养液中Fe2+浓度的不断提高(0.06~3.84 mmol·L-1),甜菜幼苗的生长会受到十分明显的抑制,并达到显著水平(P<0.05)。Fe2+浓度为0.12、0.24、0.48、0.96、1.92和3.84 mmol·L-1的营养液中生长的甜菜幼苗株高分别为13.8、12.5、11.8、10.6、7.3和3.2 cm。与对照组相比,各Fe2+处理组株高分别下降了约7%、16%、20%、28%、51%和78%。
2.1.2高铁胁迫处理对甜菜幼苗形态学与生物量的影响
不同浓度Fe2+对甜菜幼苗形态学的影响如图2所示,对照组(Fe2+浓度为0.06 mmol·L-1)甜菜幼苗的生长状况最好,随着Fe2+浓度的不断增大,株高不断降低,叶面积下降;幼苗主根长度和须根数量呈现先升高后降低的趋势,在Fe2+浓度为0.24 mmol·L-1时达到最大值。Fe2+浓度为1.92和3.84 mmol·L-1时,甜菜幼苗表现出明显的铁中毒现象,此时幼苗发育迟缓,植株矮小,叶片发黄枯萎。
不同浓度的高铁胁迫抑制了甜菜幼苗的生长,最终表现在植株的鲜物质量和干物质量上,如图3所示。根据单因素方差分析,除叶柄之外,0.12和0.24 mmol·L-1的Fe2+对幼苗其他部位和整株的鲜重和干重,与对照组相比没有显著差异。随着Fe2+浓度的增加,幼苗的各部位鲜重和干重都有不同程度的下降。3.84 mmol·L-1的Fe2+处理下幼苗整株的鲜重和干重分别下降了89%和92%。可见,高浓度的Fe2+会极大抑制甜菜幼苗的生长。

图2 不同浓度Fe2+对甜菜幼苗形态学的影响: (a)地上部; (b)根系; (c)第二对真叶
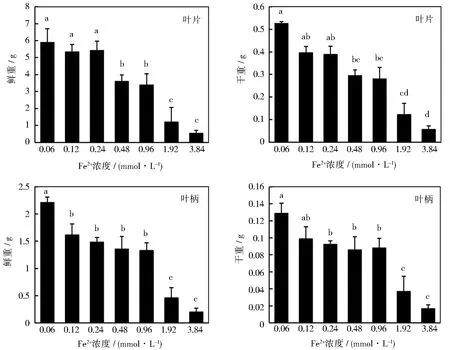
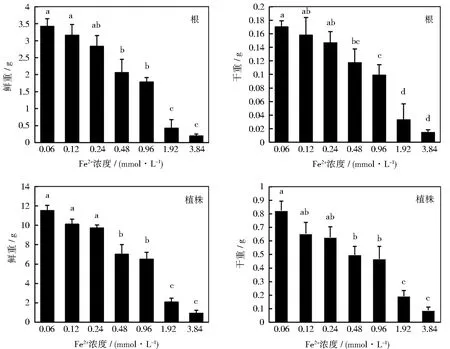
图3 不同浓度Fe2+下甜菜幼苗各部位干重和鲜重的变化
2.2 高铁胁迫对甜菜幼苗叶片光合色素含量的影响
不同浓度Fe2+对甜菜幼苗叶片光合色素含量的影响如图4所示。单因素方差分析表明,不同铁浓度下生长的幼苗叶片中光合色素的含量差异显著。从低浓度到高浓度,叶片叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chla+b)和类胡萝卜素(Caro)均呈现出不同程度的下降趋势。Chla含量在0.12 mmol·L-1Fe2+时最高,对照组较之略低;Chlb含量在Fe2+浓度0.24、0.48 mmol·L-1两个处理组和0.96~3.84 mmol·L-1三个处理组之间差异不显著; Chla+b含量除0.24和0.48 mmol·L-1处理时差异不显著,其他处理均显著下降;Caro含量除0.12和0.24 mmol·L-1处理组,其他无显著差异。
由图4可知,随着Fe2+浓度的不断增大,叶片叶绿素a与叶绿素b的比值(Chla/Chlb)呈现先升高后降低的趋势。单因素方差分析表明,不同处理组之间的Chla/Chlb值存在显著差异。Fe2+浓度为1.92 mmol·L-1时,Chla/Chlb达到最大值2.33,较对照组提高约105%, 3.84 mmol·L-1处理组的Chla/Chlb值与对照组相比没有显著差异,其他处理组较对照组均有显著提高;类胡萝卜素与总叶绿素的比值(Caro/Chla+b)同样呈先升后降的趋势,Fe2+浓度为0.24 mmol·L-1时数值最大,0.48、0.96、1.92和3.84 mmol·L-1处理组均显著低于对照组。
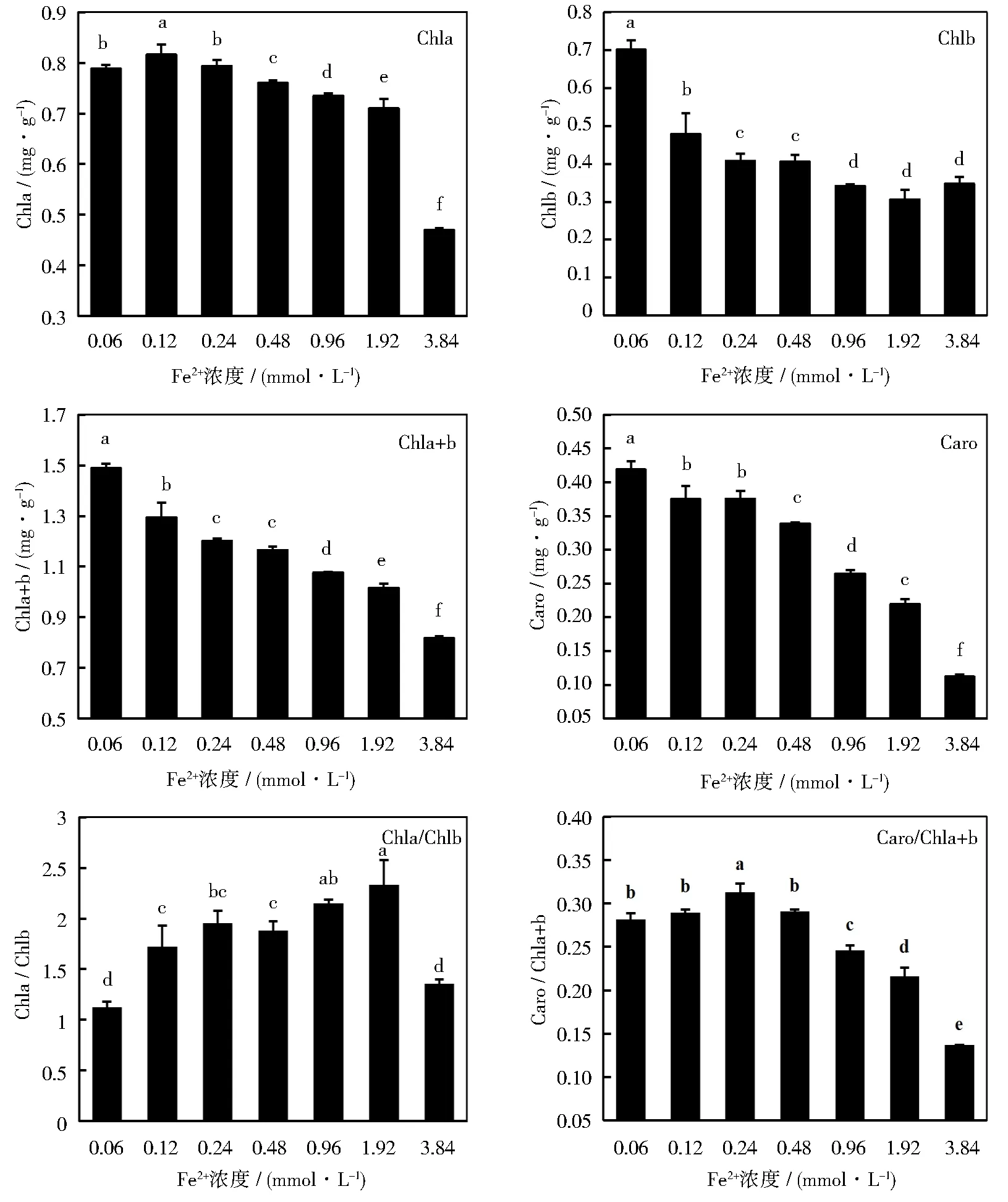
图4 不同浓度Fe2+对甜菜幼苗光合色素的影响
2.3 高铁胁迫对甜菜幼苗光合特性的影响
不同浓度Fe2+对甜菜幼苗光合特性的影响如图5所示。叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)对植物的光合作用有不同程度的影响。由单因素方差分析可知,0.12 mmol·L-1的Fe2+对甜菜幼苗叶片的Pn、Tr、Gs和Ci与对照组相比没有显著差异。随着Fe2+浓度的不断升高(0.24~3.84 mmol·L-1),上述光合特性参数显著下降,并在3.84 mmol·L-1达到最低,与对照组相比Pn、Tr、Gs和Ci在3.8 mmol·L-1时分别下降了约89%、86%、90%和82%。
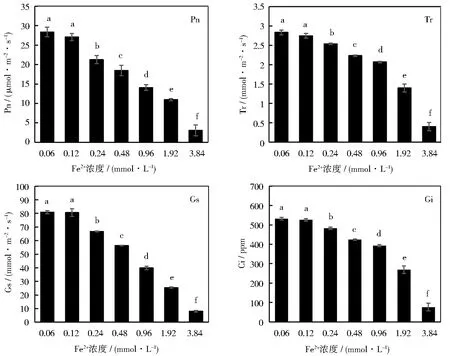
图5 不同浓度Fe2+对甜菜幼苗光合特性的影响
2.4 高铁胁迫对甜菜幼苗细胞脂膜透性和渗透调节物质的影响
不同浓度Fe2+对甜菜幼苗叶片和根系丙二醛(MDA)含量的影响如图6所示。由图可知,不同处理下,甜菜幼苗根部的MDA含量普遍高于其在叶片中的含量。根据单因素方差分析,MDA在幼苗叶片和根中的含量均呈现出先增加后降低的趋势。幼苗叶片和根的MDA含量在Fe2+浓度0.96 mmol·L-1时达到最大,并显著高于其他处理组。该浓度下叶片和根的MDA含量较对照组分别上升了31%和49%。
游离氨基酸是植物体内几种渗透调节物质之一,对于非生物胁迫下植物的自我保护有着极其重要的意义。不同浓度Fe2+对甜菜幼苗不同组织游离氨基酸含量的影响如图7所示。由图可知,不同处理下,幼苗叶片的游离氨基酸含量高于根部积累的游离氨基酸。与MDA类似,游离氨基酸在幼苗体内的含量也呈先升高后降低的趋势,在Fe2+浓度0.96 mmol·L-1时达到最大值,此时叶片与根内的游离氨基酸含量达到5.88 和2.94 mg·g-1。 随着Fe2+浓度继续增大,游离氨基酸的含量逐渐降低,但均显著高于对照组。
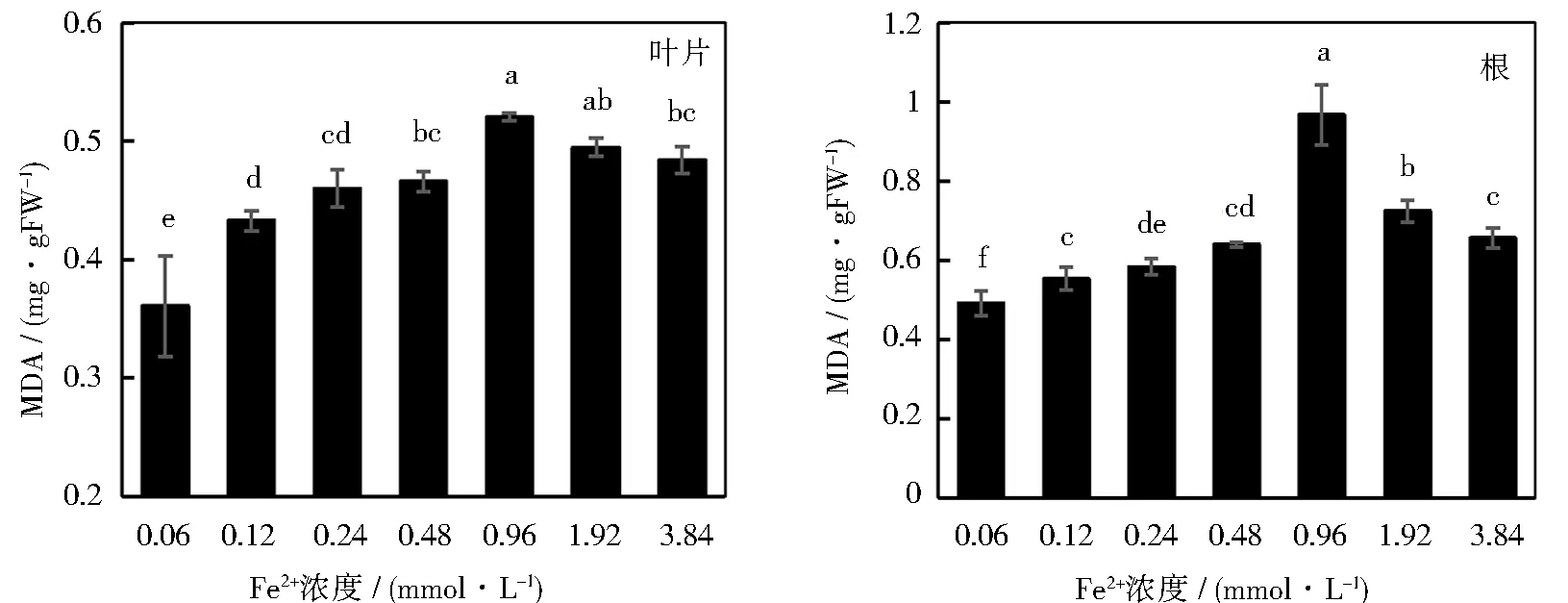
图6 不同浓度Fe2+对甜菜幼苗不同组织MDA含量的影响
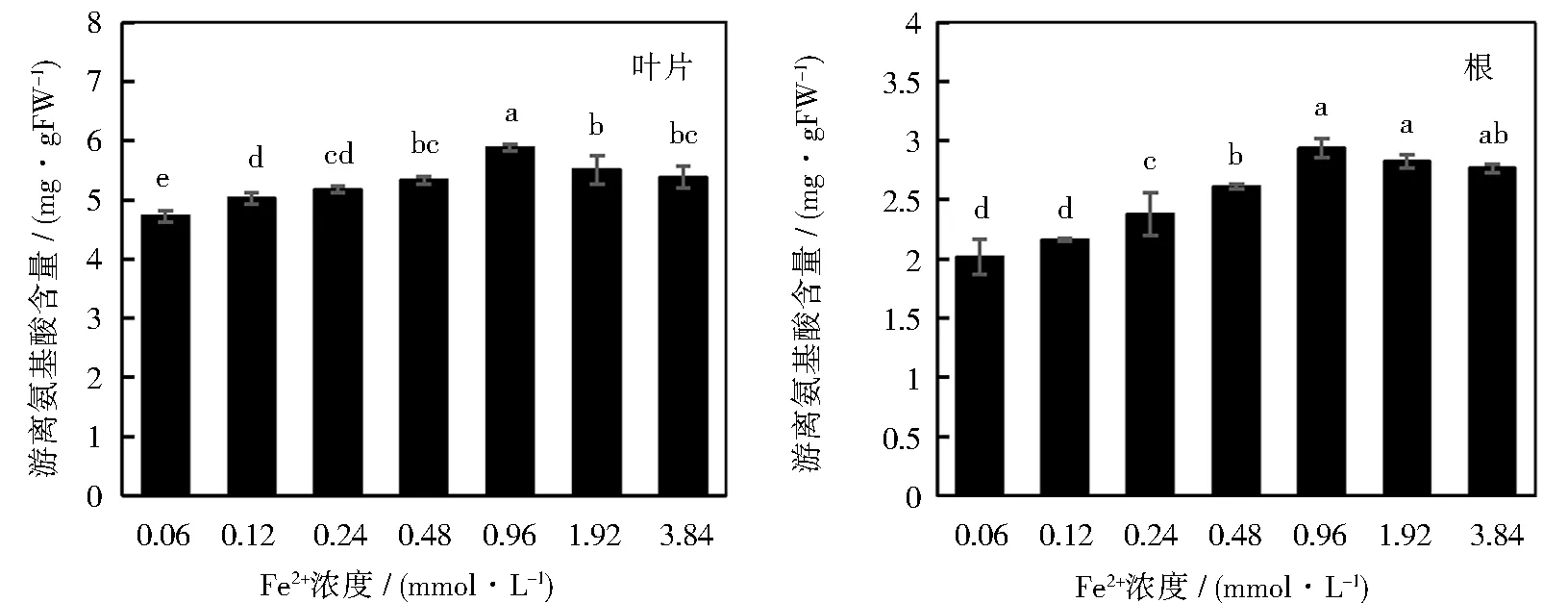
图7 不同浓度Fe2+对甜菜幼苗不同组织游离氨基酸含量的影响
3 讨 论
3.1 不同浓度Fe2+处理影响甜菜幼苗生长指标的变化
铁作为植物生长必须的元素,适宜浓度的铁可以促进植物的生长发育,但是少量或过量铁元素都会对植物产生负面影响[4]。蔺冬梅等研究发现,高浓度Fe2+胁迫下,豌豆幼苗的根和叶面积急剧下降,胁迫达到一定程度时,叶片出现坏死斑点[9]。在本研究中,随着Fe2+浓度的提高,幼苗的株高和生物量指标呈现显著下降趋势,并且高浓度下的幼苗表现出明显的铁中毒特征。幼苗根长和须根数量随Fe2+浓度的升高先上升后下降。甜菜通过增大根系面积可以提升对营养物质的吸收能力以补偿高Fe2+对植株生长的抑制,1.92和3.84 mmol·L-1下的幼苗叶面积和根面积急剧下降,表明过高浓度的铁对植物根系造成了损伤,这与岳丽娟对豌豆的研究结果一致[17]。
3.2 不同浓度Fe2+处理影响甜菜幼苗光合色素含量的变化
叶绿素对于植物的光合作用起着至关重要的作用,已经证明叶绿素在植株叶片内的含量不仅能够代表该植物的光合作用能力,并且众多环境因子的改变也会对其含量造成影响[18]。铁元素不是叶绿素的组成部分,但对叶绿素的合成十分重要。本研究发现,Fe2+处理使甜菜幼苗叶片Chla、Chlb、 Chla+b和Caro含量不同程度降低,这表明高浓度的铁可能会抑制甜菜叶绿素合成酶的活性或增加叶绿素水解酶的活性,从而使其叶绿素含量下降。叶绿素在植物体内是由叶绿素合成前体ALA(δ-氨基酮戊二酸)转化而来的,已有研究表明,ALA的合成与其转化为叶绿素的过程均有铁元素的参与[19]。由此推断,可能是高铁胁迫影响了叶绿素的合成路径,造成其含量降低。过量金属元素会与类囊体膜结合,阻碍Hill反应,从而抑制叶绿素的合成[20];金属元素取代叶绿素中心镁离子阻止光的获取,进而造成叶绿素的降解[21],这也可能是一种高铁浓度下叶绿素含量降低的机制。类胡萝卜素能够保护被光激发的叶绿素免受光氧化胁迫的损伤,可以作为保护叶绿素的辅助色素,缓解因叶绿素减少而造成的光合作用能力减弱[22]。本研究中,甜菜叶片Caro含量降低可能会进一步加剧叶绿素的被破坏程度,进而降低幼苗的光合作用能力。
叶绿素a与叶绿素b的比值能够反映叶绿体中类囊体堆叠的程度,数值越大说明植物对于光能的利用效率越高[23]。许多研究发现,Chla/Chlb值会随着胁迫程度的提高而升高[24-25],本研究结果与上述发现一致。高铁胁迫下,甜菜叶片Chla/Chlb值会随着铁浓度的增加而先升高后降低。可能在甜菜的耐受范围内,随着胁迫程度的上升,植株会通过提高光能利用率来缓解高铁对叶绿素的伤害;但是当胁迫程度超出甜菜对铁的耐受阈值之后,其光合机构被大量破坏,光合能力丧失,所以其Chla/Chlb值急剧下降,甜菜幼苗的净光合速率Pn也降至最低。此外,类胡萝卜素与总叶绿素的比值反映胁迫条件下植物的一种保护机制,这与植物忍受逆境的能力相关[26]。本研究中,Caro/Chla+b值随着Fe2+浓度提高先上升后降低,于0.24 mmol·L-1时达到最大值。出现此现象的原因可能是,一定程度的铁胁迫下甜菜会启动保护机制,但对于较高程度的铁胁迫,保护机制能力会变弱或丧失,从而加剧铁对甜菜幼苗光合作用的抑制。
3.3 不同浓度Fe2+处理影响甜菜幼苗光合特性的变化
植物叶片的净光合速率(Pn)反映其光合作用的强弱。徐玉玲研究发现,高浓度的Fe2+会导致小麦叶片Pn、Tr、Gs和Ci下降[20],这与本研究结果一致。本研究表明,除了0.12 mmol·L-1处理组之外,其他处理组甜菜幼苗叶片的光合特性指标均与Fe2+浓度成显著负相关。非生物胁迫下植物Pn的下降可分为非气孔限制和气孔限制。气孔限制方面表现在,随着幼苗叶片Gs的下降,其光合作用所需的CO2供应受到限制,从而导致叶片Pn降低。对于甜菜幼苗Pn的非气孔抑制,杨颖丽对高铁胁迫下小麦光合特性的研究发现[26],高铁胁迫下小麦幼苗会发生光抑制,使PSⅡ活性中心遭受损伤,进而导致其激发能传递效率及光合电子传递效率降低。蔺冬梅的研究也发现,过量铁胁迫严重破坏了豌豆幼苗光合电子传递途径,使得光合电子传递活性不断下降,用于光化学反应的能量逐渐减少,而以热能形式散失掉的光能部分逐渐上升[27]。因此可以推断,高浓度的Fe2+会降低甜菜叶片细胞光合PSⅡ活性中心活性与其能量传递效率,并且影响其光合电子传递效率。正常的蒸腾作用对于维持植株正常形态、保持细胞含水量具有重要意义[28]。高铁胁迫下叶片气孔关闭,Gs下降会直接降低其Tr。本研究中,Tr在Fe2+浓度1.92和3.84 mmol·L-1时最小,植株相应地在形态学上表现出最明显的铁中毒特征,这是由于该浓度下植株蒸腾作用受阻,细胞内温度和水分等失衡,导致植株光合系统受损,不能正常进行物质合成,最终表现在甜菜幼苗的形态学特征上。
3.4 不同浓度Fe2+处理影响甜菜幼苗细胞脂膜透性和渗透调节物质的变化
非生物胁迫下,植物体内会产生大量的H2O2等活性氧,从而造成细胞膜系统的损伤。丙二醛(MDA)是脂质过氧化的主要产物之一,其在细胞内的含量能够反映膜脂的过氧化水平和细胞膜结构的受损害程度。研究表明,不同非生物胁迫都会导致甜菜体内的MDA含量上升[29-30]。本研究发现,甜菜幼苗叶片和根系中的MDA含量均随Fe2+浓度的上升而增加,在0.96 mmol·L-1时达到最大值,并且根系内的MDA含量大于叶片内的含量。推测这种现象出现的原因是,随着胁迫程度的提升,细胞内的ROS含量不断升高,幼苗体内的MDA含量也相应提高;水培条件下,根部所处环境特殊,所受胁迫程度高于地上部。另外,甜菜幼苗通过根部吸收养分,根部细胞与外界物质交换频繁,这也会在一定程度上增强Fe2+对其胁迫程度,所以根部的MDA含量较叶片高。岳丽娟研究发现,随着铁胁迫程度的提高,豌豆根系部位的铁含量逐渐升高[17],这与本研究的结果一致。Fe2+浓度继续增大,幼苗体内的MDA含量逐渐下降,可能是因为随着细胞质膜进一步被破坏,植物逐步丧失对胁迫因子的抵御能力,产生的MDA逐渐减少。
逆境胁迫下,植物产生的游离氨基酸对于其维持胞内水势、解除物质毒害和贮存氮素有着重要的意义[31]。赵慧杰研究发现,高盐胁迫会增加甜菜幼苗体内游离氨基酸的释放量[32]。氨基酸一方面可以作为细胞渗透调节物质,另一方面可以保护酶和膜的结构,并参与植物代谢。本研究证明,随着铁胁迫程度的提升,幼苗体内的游离氨基酸含量不断上升。这可能是由于高铁胁迫引起细胞内蛋白质分解,从而造成游离氨基酸含量上升。与MDA相似,游离氨基酸的含量在较高浓度处理组呈下降趋势,其原因可能也是由于铁中毒作用,甜菜幼苗细胞活性大幅下降,造成游离氨基酸含量显著下降。
4 结 论
高浓度的Fe2+会显著降低甜菜的幼苗生物量和株高;随着Fe2+浓度的提高,甜菜幼苗的光合色素含量和叶片净光合速率、气孔导度、蒸腾速率和胞间CO2浓度均不断下降;另外,甜菜幼苗对高铁胁迫的响应还包括细胞脂膜(细胞膜和叶绿体膜系统)的损伤,增加体内渗透调节物质的浓度以缓解脂膜损伤对其造成的伤害。

