Tube通道微创手术治疗股骨干骨不连的疗效观察
石 斌,杜海龙,罗 杨,张 巍,张立海
股骨干骨折好发于年轻患者,往往由高能量损伤引起。主要治疗方法包括闭合复位髓内钉内固定和切开复位钢板螺钉内固定。由于髓内钉内固定技术具有创伤小、愈合率高且疗效满意等特点,采用髓内钉治疗股骨干骨折已成为首选方式[1]。近年来,随着髓内钉应用范围的扩大,成人股骨干骨折髓内钉固定术后并发骨不连的比例呈上升趋势[2],其中以非感染性骨不连最为常见。股骨干非感染性骨不连治疗的总体原则为:(1)彻底清理断端;(2)坚强固定(方式包括更换粗髓内钉,更换钢板固定或在原固定物基础上附加侧方钢板等);(3)充分植骨(自体骨移植为“金标准”)。遵循上述治疗原则均可获得良好疗效[3-9],然而由于骨不连手术为翻修手术,有的患者已经历了多次手术,其软组织及骨质条件差,往往面临手术时间长、术中出血量大、手术操作复杂等弊端。临床治疗骨不连在总体原则不变基础上针对固定方式和植骨的报道较多,但针对如何改进手术方式、提高手术效率却鲜有报道。笔者将脊柱外科的Tube通道技术应用于股骨干骨不连治疗中,在保持原固定物不变基础上应用附加锁定加压钢板(locking compression plating,LCP)联合自体骨植骨术(autologous bone grafting,ABG)治疗股骨干骨不连。本研究旨在比较Tube通道微创技术与传统开放手术技术的临床疗效。
1 资料与方法
1.1 一般资料 选择2016-03至2018-06我院收治的29例股骨干骨折术后非感染性骨不连患者。其中Tube通道组 13例,开放组16例。两组患者在年龄、性别、骨不连类型、骨不连时间、随访时间等基础信息方面比较,差异均无统计学意义(P>0.05,表1)。纳入标准:(1)年龄≥18岁;(2)明确诊断骨不连。排除标准 :(1)感染性骨不连 ;(2)病理性骨折。
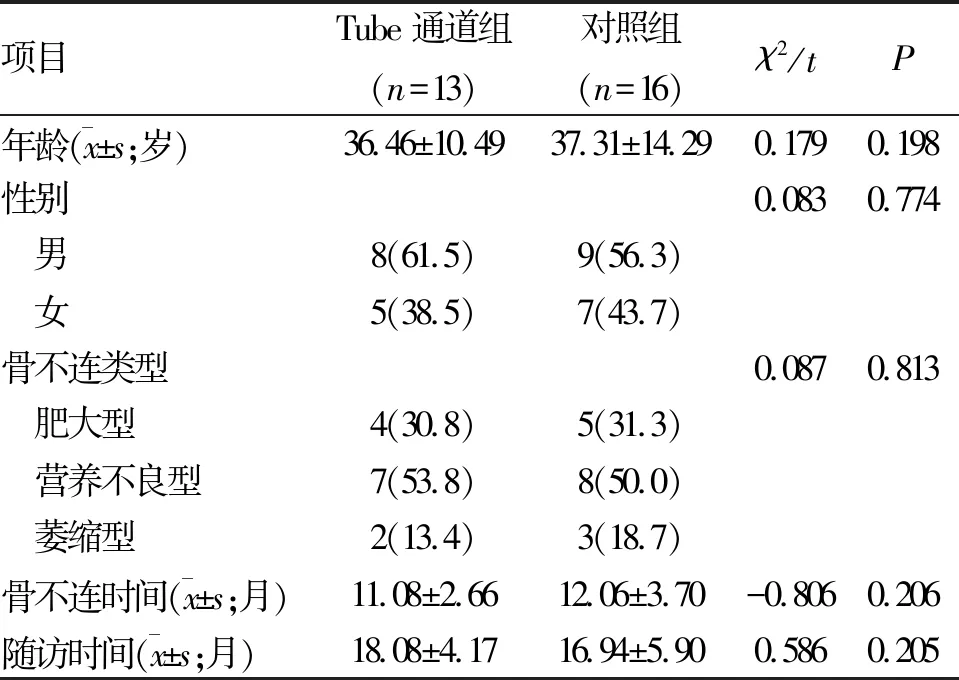
表1 两组患者基本资料比较 (n;%)
1.2 手术方法
1.2.1 Tube通道微创手术方法 以骨不连为中心,术中透视精准定位(图1A),向两侧延伸,长6~8 cm。依次切开皮肤、皮下及阔筋膜,沿股直肌与股外侧肌间隙进入,置入Tube套管钝性分离股中间肌至骨不连断端,然后撑开Tube套管扩大显露范围(图1B、C),采用去皮质技术逐步显露骨不连断端,清除骨断端的死骨和瘢痕组织,用较细的钻头在两端皮质密集打孔。两侧皮质开槽,开槽范围1 cm×1 cm×断端缺损长度,断端置入大量松质骨。选择合适长度的钢板预置(充分考虑原固定物的位置),分别于钢板两端的近骨折端各置入1枚螺钉单皮质临时固定,透视观察钢板位置良好。附加钢板采用经皮置入螺钉技术:沿钢板钉孔的大致位置,用小刀切开0.5 cm,用弯钳自外向内分离皮下组织及肌肉直达钉孔,沿通道置入导向器,连接导向器与锁定钢板,钻孔后拆除导向器,拧入螺钉,于骨折断端两侧分别置入2~3枚螺钉固定。
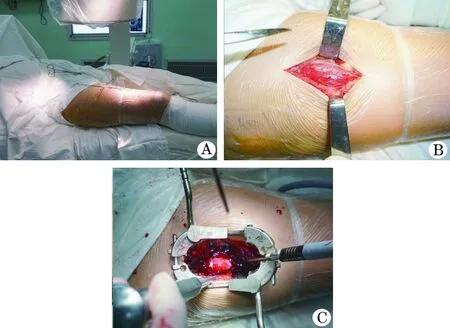
图1 Tube通道手术的大体外观像
1.2.2 传统开放手术方法 选择股外侧入路,切口长度15~40 cm。手术入路:依次切开皮肤、皮下,剪开阔筋膜,于股外侧肌后方间隙分离,将股外侧肌向前掀起,切开股中间肌到达股骨干,采用相同的方法处理断端和植骨后置入附加钢板。
1.3 观察指标
1.3.1 基本资料 记录每组患者的年龄、性别、骨不连类型、骨不连时间、住院时间、随访时间等基础资料。
1.3.2 入路比较 Tube通道入路如图1所示。
1.3.3 手术相关指标 手术切口大小(cm)、手术时间(min)、术中出血量(ml)。
1.3.4 临床指标 (1)Tohner-Wrnch标准疗效评价骨愈合情况。末次随访时采用Tohner-Wrnch标准对患者进行疗效评定[10]:如果患者完全负重后局部及骨折间隙均无疼痛或压痛,影像学检查示连续性骨痂存在于股骨正侧位3侧及以上皮质上,内固定均有效等,则评定为骨折愈合。(2)SF-36评分评价术后恢复情况。分别进行SF-36生理功能评分和躯体疼痛评分,满分为100分,分数越高,健康状况越好。

2 结 果
2.1 手术相关指标 Tube通道组切口大小明显小于开放组,差异有统计学意义(P=0.003);Tube通道组手术时间、手术出血量均少于开放组,差异均有统计学意义(表2)。
2.2 疗效 两组患者均获得随访,随访时间9~30个月,平均随访时间分别为(18.08±4.17)个月和(16.94±5.90)个月,末次随访时采用Tohner-Wrnch标准评估术后骨不连愈合情况,两组患者评价均为愈合,两组优良率均为100%。Tube通道组SF-36生理功能评分、躯体疼痛评分与开放组比较,差异均无统计学意义(P=0.941,P=0.407,表2)。

表2 两组患者手术情况和SF-36评分比较
2.3 典型病例 病例1:男,31岁,因交通事故伤致右侧股骨颈骨折、股骨干骨折,于当地医院行右股骨颈、股骨干骨折切开复位、髓内钉内固定术,术后9个月骨折未愈合诊断骨不连,在我院行微创Tube通道下断端清理、附加钢板、植骨内固定术(图2)。病例2:男,22岁,因骑摩托车摔伤致左侧股骨干骨折,于当地医院行股骨干骨折断端有限切开复位、髓内钉内固定术,术后2年骨折未愈合诊断骨不连,在我院行传统开放下断端清理、附加钢板、植骨内固定术 (图3)。
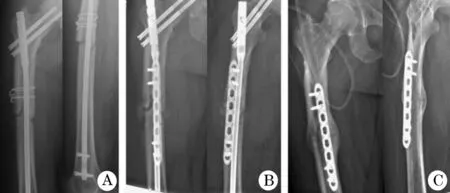
图2 股骨干营养不良型骨不连Tube通道手术前后的
3 讨 论
骨不连的治疗仍然是创伤骨科医师面临的重大挑战[11,12]。骨不连的定义(美国AAOS的诊断标准)为:骨折后至少9个月,或连续3个月动态观察,未见到骨折有明显的愈合征象(即X线片显示骨折间隙和骨痂生长情况没有变化)。无菌性骨不连是股骨干骨折术后的并发症之一,随着高能量损伤、多发伤的增多,加之髓内钉技术在临床上的广泛应用和适应证的扩大,股骨干骨折术后无菌性骨不连的发生率也随之增高,文献[13,14]报道其发生率可达6.3%~12.5%。无菌性骨不连可分为肥大型、营养不良型和萎缩型[15]。无菌性骨不连原因包括:(1)骨折端活动过度,固定不稳;(2)骨折块间接触不良,软组织嵌插、过度牵引或骨块过度分离;(3)供血障碍,营养血管损伤、骨膜剥离及周围软组织损伤、严重的粉碎性骨折伴游离骨块或内置物压迫影响血供。总之力学不稳定与生物学环境的破坏是导致无菌性骨不连发生的主要原因,而两者常常同时伴随存在[2]。
无菌性骨不连的治疗决策,核心在于分辨造成骨不连的原因是机械稳定性欠缺,还是局部生物学环境破坏严重[16-18]。采用何种方式治疗受多种因素影响,包括先前的固定方式、内固定物是否失效、骨折部位的生物力学特性、骨质缺损程度等。理论上讲,对于肥大性骨不连本无需行植骨术,但在行骨不连手术时,由于涉及骨折端的暴露、纤维软组织及硬化骨痂的清除,即使对于肥大型骨不连而言,仍可能造成局部骨痂及血运的破坏。因此,不论何种类型的非感染性骨不连,同期联合行ABG术可能均有利于骨愈合[19,20],因而在本研究中不考虑骨不连类型,为降低骨不连术后不愈合率均同期行ABG术处理。
术中两组均采用附加钢板获得稳定固定[21,22],消除骨不连断端的异常活动。所有患者终极固定方式均为在原有髓内钉或钢板固定的基础上附加钢板。采取附加钢板的手术干预,不仅可以保留原内固定物,而且可以消除骨折端的过度活动,二者的合力足以获得骨折端稳定的力学环境,促使骨折愈合。因添加钢板只起到辅助作用,要求的强度并不高,因此,选择窄LCP钢板固定即可。钢板也不宜过长,骨折端的两侧各固定2~3枚螺钉即可[23,24]。
传统开放手术方式则需大切口,股中间肌切开范围较大,一方面出血量多、血运破坏大,为了保证术野显露充分往往需要多名助手持续牵拉周围强大的肌肉软组织,由于易于疲劳,往往需要术中反复调整以保证术野显露充分;另一方面在获得充分显露的同时,往往导致术后发生股中间肌与股骨之间的粘连,影响膝关节的屈伸活动,进而影响术后功能恢复。
为了克服开放手术方式存在的弊端,我们采用Tube通道微创手术方式,具有以下优势:(1)手术切口小,对周围组织干扰小,显露全程沿着肌间隙或钝性分离肌肉直达骨质,血运破坏少,出血量小,而且借助Tube器械扩张功能通过有限的切口获得相对充分的显露。(2)通过器械扩张可保持长时间稳定的显露,无需助手反复牵拉,术野显露充分,利于减少手术时间。(3)通过Tube器械撑开可清晰暴露骨不连断端,方便去除死骨,并可保留股骨后、内侧骨膜,破坏血运少,通过Tube通道可完成充分植骨[25,26]。(4)借助Tube器械扩张撑开可对周围软组织压迫止血,减少渗血,保证术野清晰。
综上所述,两种手术方法治疗股骨干骨折术后骨不连均可获得满意的疗效。应用Tube通道微创手术这一新技术,可以克服传统手术的出血量大、手术时间长及骨折断端血运破坏大等弊端。与传统开放手术相比,应用Tube通道微创手术,其操作相对简便、手术时间短、术中出血少、创伤轻,且可获得与传统开放手术一样的临床疗效,是一种比较理想的治疗方法。并且患者术后不需制动,可早期进行功能锻炼,减少膝关节粘连、下肢静脉血栓形成等并发症的发生。但本研究为回顾性研究,可能存在患者选择性偏倚。我们将在今后的研究中进一步改进方法,获得更为科学、合理的结果。

