吸烟相关COPD肺微生态菌群、Treg/Th17、炎症在发病中的作用机制
王辉 叶彩虹 马焕丽 孙俊生 陈斯亮 张韶斌★
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)是一种以持续性气流受限为特征的慢性气道炎症[1],香烟烟雾是其原发病因之一[2],但其在COPD 发病中的具体作用机制仍需进一步研究。关于香烟烟雾暴露对下呼吸道菌群分布影响的小鼠实验表明[3],香烟烟雾暴露可能通过加快致病菌生长速度,诱导下呼吸道菌群组成改变,引起宿主下呼吸道免疫反应,增加肺部疾病发生风险。另有学者指出[4],吸烟可刺激支气管上皮细胞,募集中性粒细胞、巨噬细胞等天然免疫细胞,异常增殖辅助性T 细胞Th17(T helper cells-17,Th17),破坏调节性T 淋巴细胞(Regulatory T cells,Treg)/Th17平衡,降低免疫抑制功能,加重肺部炎症反应。本研究尝试探讨吸烟相关COPD 肺微生态菌群、Treg/Th17、炎症之间关系及在发病中的作用机制。
1 资料和方法
1.1 研究对象
选取2019年4月至2020年3月本院COPD 稳定期患者68 例,另选取同期肺功能正常者68 例。根据是否吸烟将COPD 稳定期患者分为吸烟COPD 组(n=20)、戒烟COPD 组(n=29)、不吸烟COPD 组(n=19);肺功能正常者分为吸烟肺功能正常组(n=22)、戒烟肺功能正常组(n=26)、不吸烟肺功能正常组(n=20)。纳入标准:①COPD 患者均符合COPD 诊断标准[5];②肺功能正常患者经肺功能仪检查未发现肺功能受限,且未合并其他器质性疾病;③吸烟状态定义[6]:吸烟者为截至目前使用≥100 支香烟,且≥1 次/月,目前并未戒断;戒烟者即从前吸烟者截至目前使用≥100 支香烟,但目前已戒断≥12 个月;不吸烟者为截至目前从不使用或者使用<100 支,且目前不吸烟≥12 个月。排除标准:①近6 个月内有急性COPD 发作史者;②合并支气管哮喘、支气管扩张及其他肺部疾病者;③被动吸烟者;④精神行为异常者。本院伦理委员会经审核评议同意本研究,研究对象均知情同意。
1.2 仪器与方法
①所有研究对象均戒烟12 h,清晨空腹抽取静脉血5 mL,乙二胺四乙酸抗凝,4℃保存备用;采集肺泡灌洗液(Bronchoalveolar lavage,BAL)50 mL,4℃保存备用。②BAL 离心处理(500 g,4℃离心,10 min),qPCR 法提取DNA,采用454 焦磷酸法对细菌16sRNA 进行测序,后采用Quantitative Insights into Microbial Ecology 法分析16sRNA 数据,获取肺微生态菌群多样性(Chao 指数、Simpson 指数)。③采用美国贝克曼库尔特公司DxFLEX 型流式细胞仪检测外周血、BAL 中Treg 细胞与Th17细胞含量;室温条件下,2 800 r/min 离心10 min,采用瑞士帝肯公司SPARK 10M 酶标仪以上海江莱生物科技有限公司酶联免疫吸附试验试剂盒(规格:96T)测定血清和BAL 上清白细胞介素(Interleukin,IL)-17、IL-10、IL-35、IL-6 及IL-8。
1.3 统计学方法
采用统计学软件SPSS 22.0 进行数据处理;计量资料以()描述,多组间比较采用单因素方差分析;计数资料用n(%)表示,行χ2检验;采用Spearman 相关系数模型分析吸烟与肺微生态菌群、Treg/Th17、炎症因子的关系;采用Pearson 相关系数模型分析肺微生态菌群、Treg/Th17、炎症因子之间相关性。以P<0.05 为差异有统计学意义。
2 结果
2.1 6 组基线资料比较
6 组第1 s 用力呼气容积(forcedexpiratory volume in one second,FEV1)占预计值百分比、FEV1与用力肺活量比值(forced vital capacity,FVC)比较,差异有统计学意义(P<0.05)。见表1。
表1 6 组基线资料比较[n(%),(±s)]Table 1 Comparison of baseline data of 6 groups[n(%),(±s)]
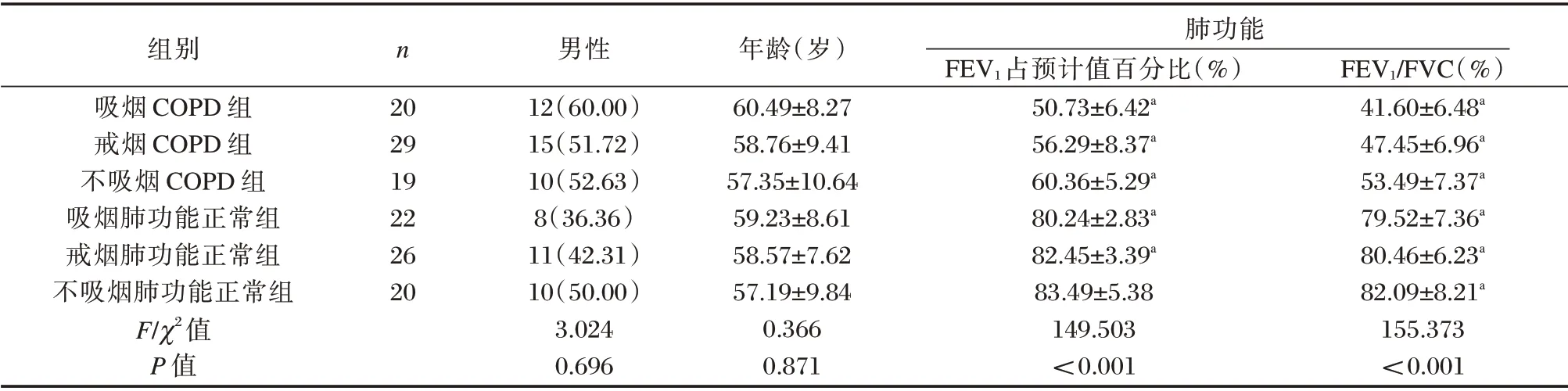
表1 6 组基线资料比较[n(%),(±s)]Table 1 Comparison of baseline data of 6 groups[n(%),(±s)]
注:与不吸烟肺功能正常组比较,aP<0.05。
组别吸烟COPD 组戒烟COPD 组不吸烟COPD 组吸烟肺功能正常组戒烟肺功能正常组不吸烟肺功能正常组F/χ2值P 值n 20 29 19 22 26 20男性12(60.00)15(51.72)10(52.63)8(36.36)11(42.31)10(50.00)3.024 0.696年龄(岁)60.49±8.27 58.76±9.41 57.35±10.64 59.23±8.61 58.57±7.62 57.19±9.84 0.366 0.871肺功能FEV1占预计值百分比(%)50.73±6.42a 56.29±8.37a 60.36±5.29a 80.24±2.83a 82.45±3.39a 83.49±5.38 149.503<0.001 FEV1/FVC(%)41.60±6.48a 47.45±6.96a 53.49±7.37a 79.52±7.36a 80.46±6.23a 82.09±8.21a 155.373<0.001
2.2 6 组肺微生态菌群多样性、外周血、BAL 中Treg/Th17、炎性因子比较
Chao 指数、外周血和BAL 中Treg/Th17、IL-10、IL-35 指标在各组间比较,吸烟COPD 组<戒烟COPD组<非吸烟COPD 组<吸烟肺功能正常组<戒烟肺功能正常组<非吸烟肺功能正常组,Simpson指数在各组间比较,吸烟COPD组>戒烟COPD组>非吸烟COPD组>吸烟肺功能正常组>戒烟肺功能正常组>非吸烟肺功能正常组,差异有统计学意义(P<0.05)。见表2、表3。
表2 6 组肺微生态菌群多样性比较(±s)Table 2 Comparison of the diversity of the microflora in the lung of 6 group(±s)

表2 6 组肺微生态菌群多样性比较(±s)Table 2 Comparison of the diversity of the microflora in the lung of 6 group(±s)
注:与不吸烟肺功能正常组比较,aP<0.05。
组别吸烟COPD 组戒烟COPD 组不吸烟COPD 组吸烟肺功能正常组戒烟肺功能正常组不吸烟肺功能正常组F 值P 值n 20 29 19 22 26 20 Simpson 指数3.86±0.83a 2.62±0.55a 1.85±0.40a 1.15±0.36a 0.73±0.19a 0.35±0.10 170.553<0.001 Chao 指数94.49±30.89a 142.69±32.61a 185.81±49.50a 231.65±53.42a 288.44±63.69a 357.49±92.58 63.135<0.001
表3 6 组外周血、BAL 中Treg/Th17、炎性因子比较(±s)Table 3 Comparison of treg/th17 and inflammatory factors in peripheral blood and BAL of 6 groups(±s)

表3 6 组外周血、BAL 中Treg/Th17、炎性因子比较(±s)Table 3 Comparison of treg/th17 and inflammatory factors in peripheral blood and BAL of 6 groups(±s)
注:与不吸烟肺功能正常组比较,aP<0.05。
?
2.3 吸烟与肺微生态菌群、Treg/Th17、炎症因子的关系
吸烟与Chao 指数、外周血和BAL 中Treg/Th17、IL-10、IL-35 呈负相关,与Simpson 指数、外周血和BAL中IL-17、IL-6、IL-8呈正相关(P<0.05)。见表4。

表4 吸烟与肺微生态菌群、Treg/Th17、炎症因子的关系Table 4 Relationship between smoking and pulmonary microecological flora,Treg/Th17 and inflammatory factors
2.4 肺微生态菌群、Treg/Th17、炎症因子之间相关性
Pearson 相关性分析显示,肺微生态菌群多样性、Treg/Th17、炎性之间存在良好线性相关性(P<0.05)。见表5、6。
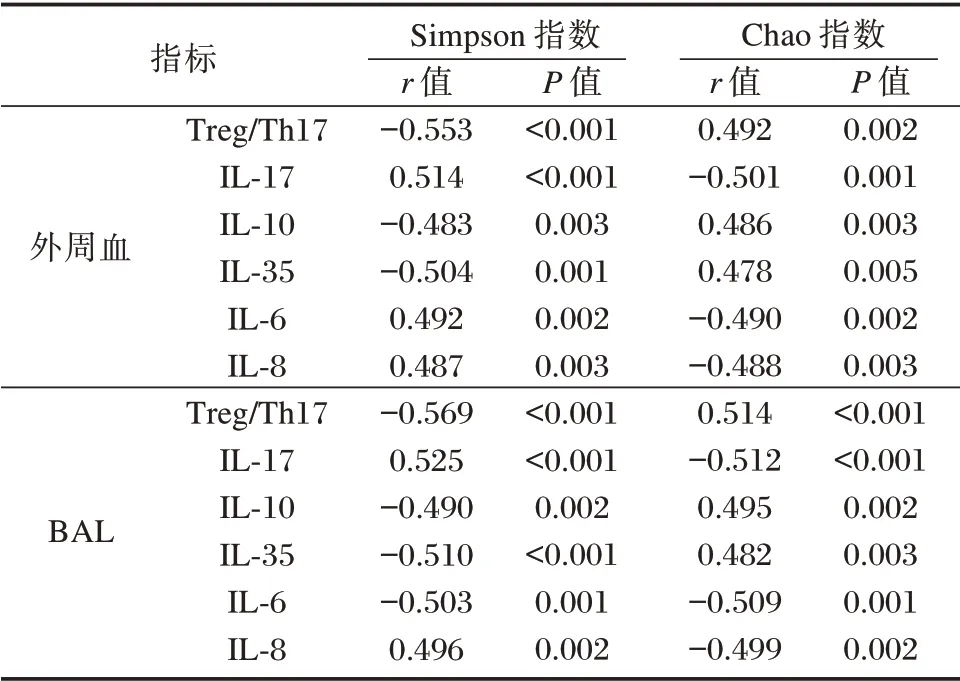
表5 肺微生态菌群与Treg/Th17、炎症因子之间相关性Table 5 Correlation between lung microbiota and Treg/Th17,inflammatory factors
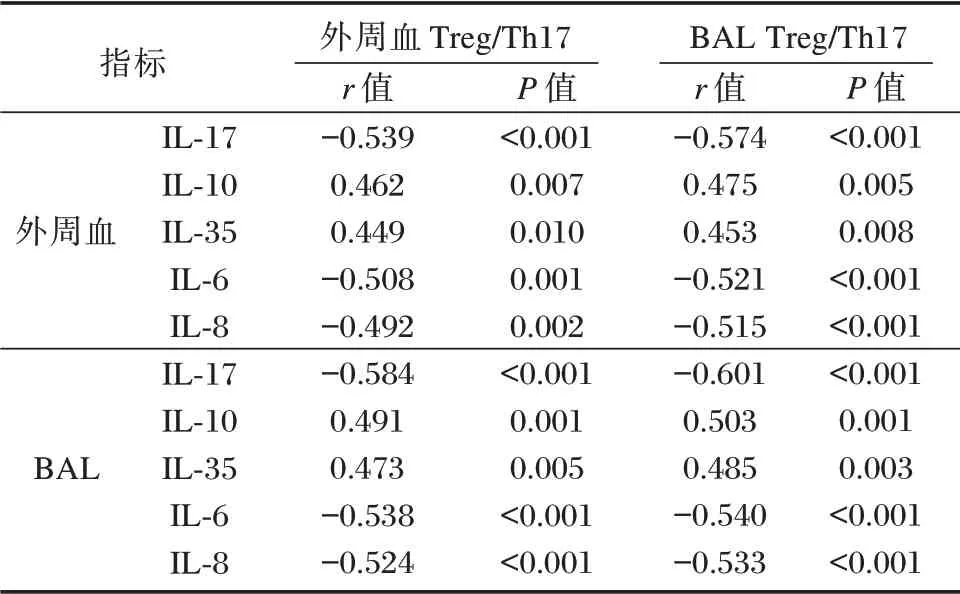
表6 Treg/Th17 与炎症因子之间相关性Table 6 Correlation between Treg/Th17 and inflammatory factors
3 讨论
学者报道指出[7],肺部菌群定植与COPD 肺部炎症反应、局部免疫应答等均存在一定联系。但吸烟对肺微生态菌群的影响及其在COPD 发病机制中的作用鲜有报道。本研究结果显示,吸烟COPD患者Simpson 指数升高,Chao 指数下降。Zhang等[8]研究亦发现,吸烟是影响肺微生物组变异的因素,可改变下呼吸道微生态多样性及群落结构,亦是炎症性肺疾病的重要病因。结合陈琳等[9]观点认为上述结果可能是吸烟降低气道黏膜清除能力,微生物进入下呼吸道后定植于肺部,进一步损害黏膜纤毛清除功能,增加黏液生成量,引起肺部菌群紊乱,破坏肺部防御功能,加重气道上皮损伤,识别受体,引起宿主炎症免疫反应,最终形成恶性循环。
既往研究已证实[10],Th17/Terg 紊乱在COPD发生、发展中扮演着重要角色。在COPD 中,Th17细胞可上调IL-17、IL-浓度,诱导单核巨噬细胞、中性粒细胞大量聚集于肺部,提高弹性蛋白酶、金属蛋白酶等多种酶含量,加重肺组织损伤,诱发气道炎症,释放大量趋化因子与炎性介质,激发炎症级联反应,进一步加快COPD 病情进展;Treg 可通过释放大量IL-10、IL-35 等抗炎因子,抑制Th17 细胞免疫活性的作用,避免过度免疫炎症反应所致组织损伤加重,发挥免疫调节作用[11]。另有研究发现[12],尼古丁作为香烟烟雾主要成分之一,可影响免疫监视功能,引起T 细胞介导的免疫应答反应。同时有学者指出[13],吸烟影响COPD 患者肺功能康复原因可能与吸烟诱导炎性因子分泌、拮抗细胞免疫功能等因素有关。本研究结果与叶彩虹等[14]研究结果相似,考虑机制可能在于香烟烟雾会释放尼古丁类、胺类等有害物质,导致Th17细胞异常增殖与活化,促使IL-17、IL-6 水平升高,而气道炎性因子水平持续性增加,会引起气道过激炎症状态,加重气道上皮损伤,形成内源性抗原持续暴露,进而导致气道、肺组织靶向性慢性炎性反应,增加COPD 发生风险。由此推测,肺微生态失调-肺免疫紊乱-炎症浸润可能是吸烟相关COPD的发病机制。
综上所述,肺微生态菌群失衡、Treg/Th17 紊乱、炎症之间相互影响可能在吸烟相关COPD 发病机制中起着重要作用。但本研究存在一定局限性,如纳入样本量少、单中心研究,今后需扩大样本量,开展多中心研究,以进一步证实研究所得结果。

