NKCC1抑制剂布美他尼对大鼠脊髓原代少突胶质前体细胞增殖的影响*
付佩彩, 叶 盛, 李志军, 骆 翔, 喻志源
华中科技大学同济医学院附属同济医院神经内科,武汉 430030
少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)为神经胶质前体细胞,约占成年人中枢神经系统(CNS)中所有胶质细胞的5%~8%。OPCs持续存在于成年人CNS中,其形态为双极、三级或多级,是处于早期分化的未成熟细胞。少突胶质细胞(OLs)分布于灰质及白质内,是CNS的成髓鞘细胞。缺血缺氧等导致的CNS脱髓鞘损伤后,OPCs可活化增殖,迁移至损伤处,分化形成OLs,进而形成髓鞘,完成髓鞘再生过程[1]。CNS中钠-钾-氯共转运体1(NKCC1)主要表达在内皮细胞、神经胶质细胞和神经元中,主要调节神经元、神经胶质细胞、内皮细胞、脉络丛上皮细胞中Na+-K+-2Cl-离子进出细胞,在维持细胞的离子平衡,细胞体积、细胞凋亡以及细胞分泌等方面具有重要作用[2]。布美他尼(Bumetanide)为NKCC1特异性抑制剂,既往研究显示布美他尼可促进CNS白质损伤修复,但其具体机制尚不明确。该研究探讨NKCC1抑制剂布美他尼对大鼠脊髓原代OPCs增殖的影响及可能机制,以进一步了解NKCC1对脊髓损伤的影响及其机制。
1 实验材料与方法
1.1 实验动物与试剂
实验用SD大鼠乳鼠购自华中科技大学同济医学院实验动物中心。胎牛血清、DMEM高糖培养液、N2添加剂(100×)、胰蛋白酶、B27添加剂(50×)、DMEM/F12购自美国Gibco公司;T3购自Invitrogen公司;多聚赖氨酸(Polylysine,PLL)、DAPI、布美他尼试剂购自美国Sigma公司;大鼠睫状神经营养因子(Rat CNTF)、重组大鼠碱性成纤维细胞生长因子(Rat FGF Basic)、重组人血小板衍生生长因子-AA(Human PDGF-AA)购自Pepro Tech公司。兔抗NG2、兔抗髓鞘碱性蛋白抗体(MBP)购自美国Neuromarker公司;鼠抗A2B5、兔抗NKCC1购自美国Millipore公司;兔抗p-ERK、鼠抗p-p38、鼠抗p-JNK、兔抗GAPDH购自美国Cell Signaling公司;EdU细胞增殖检测试剂盒购自上海锐博公司;CY3标记羊抗兔IgG、FITC标记羊抗小鼠IgG购自美国Jackson公司;IRDye 800-羊抗兔IgG、Alexa Fluro 700-羊抗小鼠IgG购自美国LI-COR Biosciences公司。
1.2 OPCs培养、鉴定及干预
出生2 d内SD大鼠乳鼠经消毒、分离脊髓、去脊膜后剪碎,置于37℃的0.125%胰酶中消化10 min;终止消化并吹打使脊髓组织分散成细胞悬液,过滤、离心去上清。重悬细胞沉淀,接种于用PLL预包被的细胞培养瓶(T75)中;置于普通细胞培养箱(37℃、5%CO2)中培养,培养第3天将培养液更换为含20%胎牛血清的DMEM高糖培养液,每3~4天换液;待混合胶质细胞长满培养瓶瓶底后(约10 d),以封口胶封闭瓶口,将培养瓶置于37℃恒温摇床振摇,设参数为180 r/min,先预振摇2 h,弃上清,更换新的培养液,继续振摇15~18 h;将振摇后的细胞上清种于未包被的100 mm培养皿中,使其静置贴壁1 h,吸取上清(此步骤可进一步去除小胶质细胞和星形胶质细胞),收集上清后离心去上清,用OPCs培养液(含10 ng/mL PDGF-AA、10 ng/mL FGF Basic、1×N2、1 × B27的DMEM/F12培养液)重悬后,接种于培养板中。OPCs隔天换液,培养3 d后进行OPCs细胞鉴定(加入NG2+A2B5)及诱导分化为OLs(含10 ng/mL CNTF、50 ng/mL T3、1 × N2、1 × B27的DMEM/F12培养液)的鉴定(加入MBP抗体孵育)。后续相关实验(MTT、EdU、流式细胞术、Western blot)干预采用NKCC1抑制剂布美他尼,浓度为10 μmol/L,分组为对照组及布美他尼干预组,干预时间分别为6 h、12 h和24 h。
1.3 免疫荧光染色
固定于载玻片上的OPCs经PBS漂洗3次,用含0.2%Triton-X100的PBS室温破膜15 min,吸除破膜液后PBS漂洗3次,BSA封闭1 h后,加入预先用抗体稀释液稀释的对应一抗(NG2、A2B5、MBP及NKCC1)4℃封闭过夜。PBS清洗,加入对应二抗(FITC羊抗鼠IgG、CY3羊抗兔IgG)避光条件下室温孵育1 h。弃二抗,漂洗后DAPI染核8 min,PBS漂洗3次,用50%甘油封片,在荧光显微镜下观察并拍照。
1.4 EdU检测细胞增殖
调整OPCs密度至1×106/mL,接种于含有PLL预包被盖玻片的24孔板,每孔500 μL,培养3 d后按照实验分组分别换成相应培养液。在各设定时间点前2 h加入50 μL EdU培养液,分别在各设定时间点漂洗细胞后加入细胞固定液。按EdU试剂盒说明书进行染色,染色成功后照相。
1.5 流式细胞术检测细胞周期
将细胞种于6孔板中,按照实验分组分别换成相应培养液,在各设定时间点固定细胞。经PI染色后(细胞浓度1×106/mL)上机检测。
1.6 Western blot检测MAPKs相关蛋白表达
将细胞种于6孔板中,按照实验分组分别换成相应培养液,在各设定时间点收取细胞制备蛋白样品。各组取蛋白样品20 μg经电泳、转膜后经一抗孵育(兔抗p-ERK、鼠抗p-p38、鼠抗p-JNK、兔抗GAPDH),经相应IRDye 800及Alexa Fluro 700孵育后,使用奥德赛红外成像系统(Odyssey IR imaging system)定量分析蛋白条带。蛋白相对表达量用目标蛋白的吸光度值与GAPDH吸光度值的比值来表示。
1.7 统计学分析
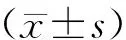
2 结果
2.1 OPCs的鉴定、分化及NKCC1表达
免疫荧光鉴定显示,贴壁OPCs多呈双极,少数为三极或多极,表达OPCs抗原NG2和A2B5,经DAPI染色显示OPCs纯度达到95%以上(图1A)。诱导分化后细胞表达OLs特异性抗原MBP,结果显示OPCs具有分化形成少突胶质细胞的能力(图1B)。OPCs表达NKCC1,经DAPI染色显示OPCs 100%表达NKCC1(图1C)。
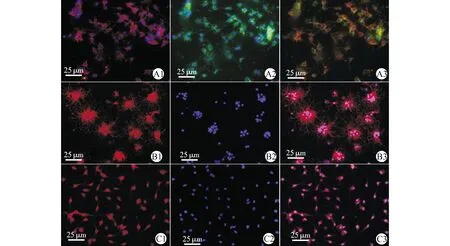
A1:NG2+DAPI染色;A2:A2B5+DAPI染色;A3:A1与A2合成图;B1:MBP染色;B2:细胞核DAPI染色;B3:B1与B2的合成图;C1:NKCC1染色;C2:细胞核DAPI染色;C3:C1与C2的合成图
2.2 EdU检测OPC增殖
图2为对照组和布美他尼干预后12 h EdU阳性细胞表达。分析结果显示,与对照组相比,布美他尼(10 μmol/L)干预后6、12和24 h时,EdU阳性细胞率明显增高[6 h:(9.00±0.39)%vs.(20.50±0.47)%,12 h:(10.33±0.33)%vs.(20.66±0.48)%,24 h:(11.30±0.34)%vs.(20.87±0.46)%,n=4,均P<0.01]。
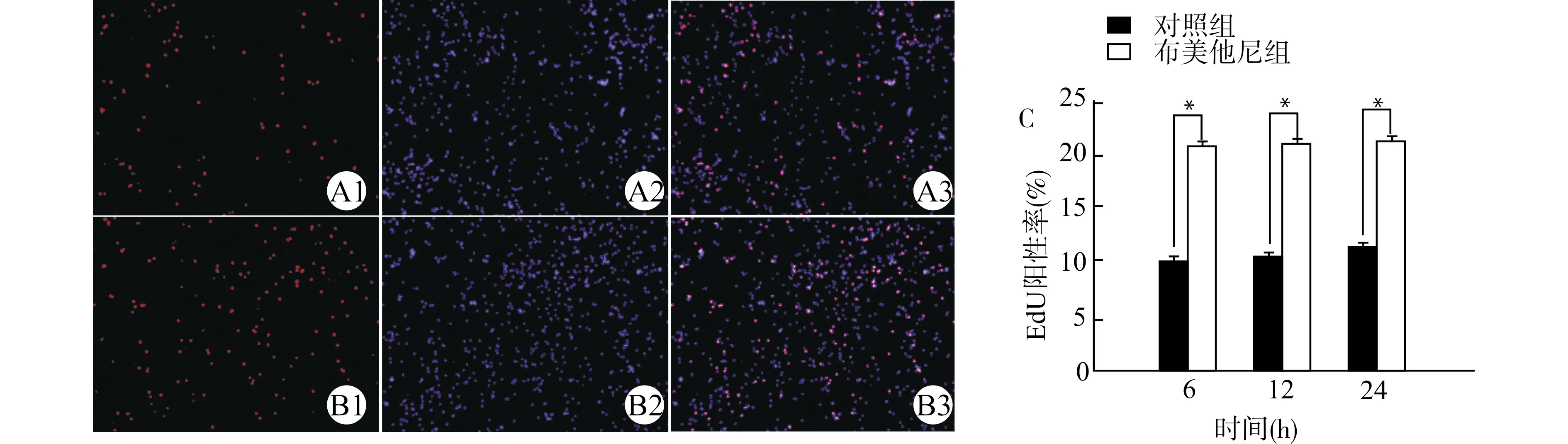
A:对照组12 h代表图片;A1:EdU染色;A2:DAPI染色;A3:A1与A2的合成图;B:布美他尼组12 h代表图片;B1:EdU染色;B2:DAPI染色;B3:B1与B2的合成图;C:各组EdU阳性细胞率统计图,*P<0.01
2.3 流式细胞术检测细胞周期
图3为流式细胞检测对照组和布美他尼干预后12 h代表图片。分析结果显示,与对照组相比,布美他尼(10 μmol/L)干预后6、12和24 h时,处于S期OPCs比例明显增加[6 h:(10.57±0.48)%vs.(19.75±0.32)%,12 h:(10.38±0.54)%vs.(20.12±0.58)%,24 h:(10.53±0.55)%vs.(20.35±0.43)%,n=4,均P<0.01]。
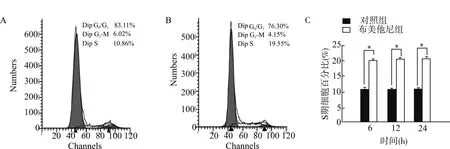
A:对照组12 h代表图片;B:布美他尼组12 h代表图片;C:各组S期细胞百分比统计图,*P<0.01
2.4 Western blot检测MAPKs信号通路相关蛋白表达
图4为对照组和布美他尼组干预后6、12和24 h时p-p38、p-ERK及p-JNK表达。分析结果显示,与对照组相比,布美他尼(10 μmol/L)干预后6、12和24 h时,p-p38表达增加,p-ERK表达降低(n=4,均P<0.01),p-JKN表达无明显改变。
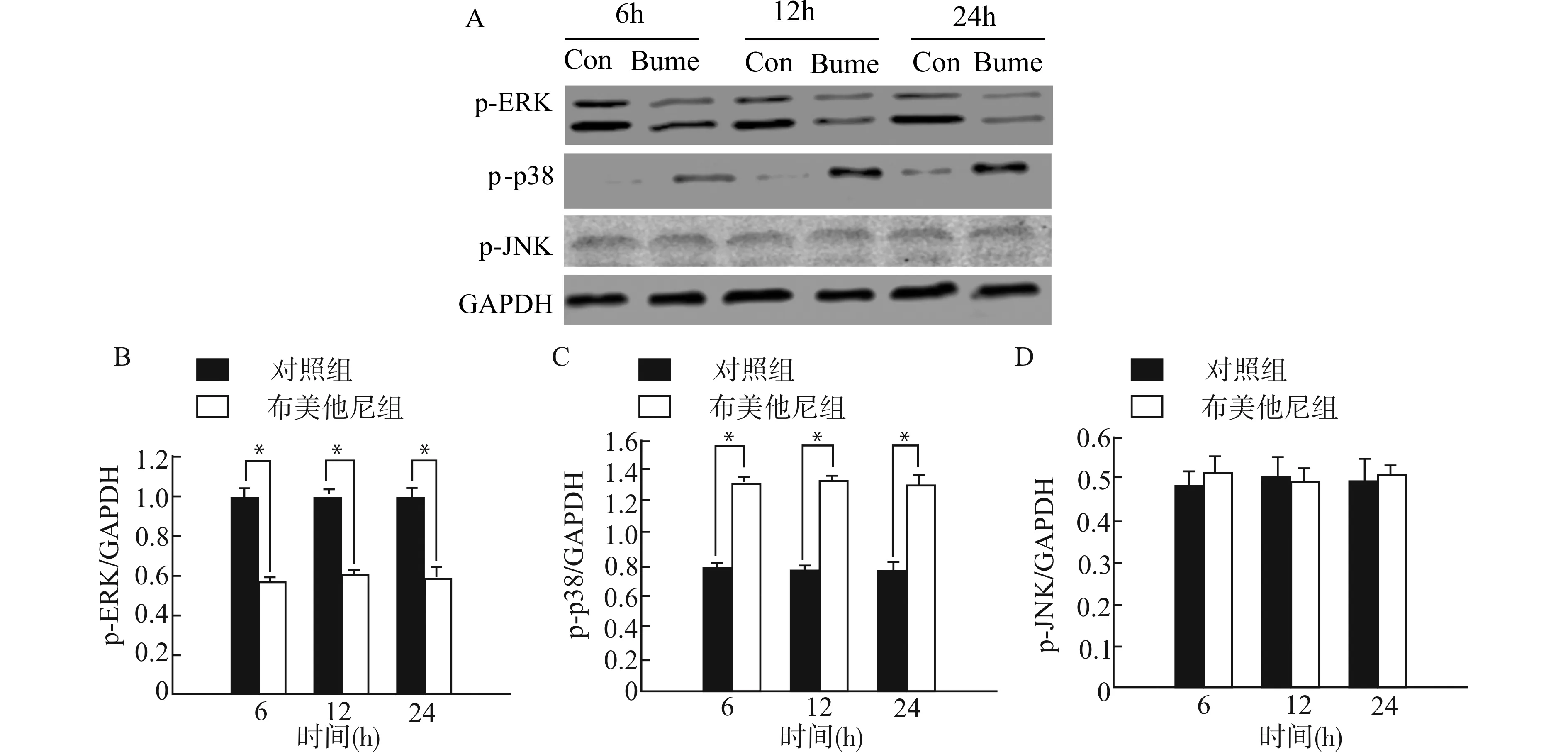
A:对照组和布美他尼组Western blot检测代表图片,Con:对照组,Bume:布美他尼组;B:p-ERK蛋白表达统计图;C:p-p38蛋白表达统计图;D:p-JNK蛋白表达统计图;*P<0.01
3 讨论
脊髓损伤(spinal cord injury,SCI)是一种严重的致残性疾病,损伤导致患者病损节段以下感觉、运动及自主神经功能缺失,造成严重的社会负担。SCI每年的发病率约30/10万~40/10万,并有逐年增高的趋势[3]。SCI的病理生理过程包括损伤导致的机械性轴突破坏以及神经元和胶质细胞受损,以及继发的脊髓屏障破坏、胶质细胞功能障碍、氧化应激、炎症及自由基形成导致的胶质细胞进一步破坏和凋亡。目前对SCI研究多关注于神经元及炎性因子等方面,而关于脊髓白质损伤的修复研究较少。SCI后,OLs在损伤中心被巨噬细胞损伤,并在数周内持续发生慢性、进行性的脱髓鞘病变,髓鞘的脱失导致上行和下行侧轴突失去动作电位传导,从而丧失功能。而OPCs可活化增殖,迁移至损伤处,分化形成OLs,进而形成髓鞘,完成髓鞘再生过程,促进脊髓损伤修复。因此,促进OPCs增殖有利于脊髓损伤修复。
钠-钾-氯共转运体(Na+-K+-2Cl-cotransporter,NKCC)调节Na+-K+-2Cl-离子进出细胞,具有NKCC1和NKCC2两种亚型。NKCC1及NKCC2具有50%~60%的氨基酸序列同源性及不同的组织分布。NKCC2的表达局限于肾脏亨氏环(TAL)后上升支粗段管腔膜和致密斑处,而NKCC1在多种组织中表达,包括上皮细胞和非上皮细胞。CNS中NKCC1主要表达在内皮细胞、神经胶质细胞和神经元中。生理情况下,NKCC1主要调节神经元、神经胶质细胞、内皮细胞、脉络丛上皮细胞中Na+-K+-2Cl-离子进出细胞,在维持细胞的离子平衡、细胞体积、细胞凋亡以及细胞分泌方面具有重要作用;病理情况下,NKCC1可导致过多的Na+转运入细胞,并最终通过多种机制导致细胞死亡。布美他尼为NKCC1特异性抑制剂,目前研究显示,布美他尼可通过血脑屏障,低浓度布美他尼抑制NKCC1的同时,不抑制肾脏NKCC2,因此不引起多尿[2]。
既往研究显示NKCC1参与多种CNS疾病,在调控细胞体积、凋亡、迁移以及离子毒性中起重要作用。有研究证实NKCC1抑制剂布美他尼促进大鼠实验性脑卒中后神经发生和运动功能恢复[4];布美他尼抑制Nogo-A表达,从而改善脑缺血微环境,促进脑缺血大鼠轴突生长和运动恢复[5];NKCC1上调可诱导早期创伤后的癫痫发作,增加创伤后癫痫易感性[6];NKCC1抑制剂通过抑制炎症及改善血脑屏障(BBB)通透性改善新生儿癫痫[7];抑制NKCC1可通过抑制MMPs表达减轻创伤性脑损伤模型中BBB通透性及脑脊液渗出[8];布美他尼可以减轻大鼠室周白质软化(PVL)模型中MBP表达和神经变性[9];CNS外,亦有研究证实NKCC1抑制剂可抑制巨噬细胞炎症作用,减轻急性肺损伤[10]。但目前关于NKCC1对细胞周期影响的研究较少,其对脊髓损伤的影响及其机制尚不明确。本研究显示布美他尼可促进大鼠脊髓原代OPCs增殖和细胞周期进程加快,提示NKCC1可能通过促进OPCs增殖从而促进脊髓损伤修复。
既往研究显示细胞增殖与MAPKs信号通路相关。p-38 MAPK和p-ERK在细胞增殖和细胞周期进程中起重要作用,尤其是在细胞周期G0/G1-S期转变。我们的研究显示,布美他尼干预后,OPCs磷酸化的p-38表达增高,磷酸化的ERK表达下降。综上,我们研究结果证实NKCC1抑制剂布美他尼可能通过调节p-38/MAPKs和p-ERK/MAPKs信号通路促进大鼠脊髓原代OPCs增殖。下一步研究我们将通过调控p38/MAPKs及ERK/MAPKs信号通路,来进一步探讨布美他尼促进OPCs增殖的具体机制。

