槐果碱对肺癌A549细胞增殖凋亡的作用机制
符丹丹,段丽娜,柏玉举,刘凤娇
肺癌是全球范围内发病率和病死率最高的一种恶性肿瘤,据报道全球每年约有160万人死于肺癌,占所有癌症死亡人数的20%,严重威胁人类的生命健康。槐果碱(sophocarpine)即13,14-脱二氢苦参碱,是分离自苦参中的一种苦参类生物碱,槐果碱作为一类广谱抗肿瘤药物已被发现在胃癌、肝癌、多种妇科肿瘤、直肠癌等多种肿瘤中发挥抗肿瘤作用。然而槐果碱在肺癌中发挥抗肿瘤作用的报道较少,且其作用机制尚未被完全揭示。因此,该研究选取肺癌细胞A549细胞,应用槐果碱作用细胞后分析细胞增殖、凋亡以及相关蛋白表达情况的改变,并探究其可能的作用机制,以期为研发新的抗肺癌药物提供理论依据。
1 材料与方法
1.1 主要试剂
A549细胞购自南京科佰细胞库;槐果碱购自南京普怡生物科技有限公司,批号190221,纯度98%;RPIM-1640培养基、10%胎牛血清(FBS)、双抗、胰酶均购自美国Gibco公司;MTT试剂盒购自天津奥淇洛谱生物科技有限公司;细胞培养耗材购自美国Corning公司;DMSO、Triton X-100、鼠源BrdU单抗、Annexin V-FITC试剂盒均购自美国Sigma公司;基质胶购自美国BD公司;TUNEL检测细胞凋亡试剂盒购自上海远慕生物科技有限公司;5-溴脱氧尿嘧啶核苷(BrdU)购自上海翊圣生物科技有限公司;RIPA裂解液、上样缓冲液均购自上海碧云天生物科技有限公司;鼠源增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、MYC、Bax、Bcl-2、L-PTGDS和PTGDR2单抗、鼠源GAPDH一抗及荧光标记的羊抗鼠二抗均购自北京博奥森生物技术有限公司;DAPI购自德国Thermo公司。1.2 MTT实验
分组及处理:收集生长至对数期的A549细胞,制备密度为2×10/ml的细胞悬液,将细胞悬液随机分为8组接种于96孔板中,1~7组分别给予100 μl浓度为1、2、4、8、16、32、64 mmol/L的槐果碱处理,8组给予100 μl PBS缓冲液处理,每组设置3个重复,给予相应浓度槐果碱处理后,置于培养箱中培养48 h,再进行后续实验。每孔加入10 μl MTT工作液于培养箱孵育3 h,每孔加入150 μl DMSO后置于摇床上低速振荡15 min,选择490 nm波长,在酶联免疫监测仪上测定各孔吸光度(OD)值,按照抑制率=(1-给药组OD值/对照组OD值)×100%计算抑制率。通过软件分析结果并计算槐果碱对A549细胞的IC值。1.3 克隆形成实验
分组及处理根据1.2实验结果选取5 mmol/L槐果碱处理细胞进行克隆形成实验。制备细胞悬液方法同1.2,将细胞悬液随机分为4组,分别为5 mmol/L槐果碱处理组(槐果碱组)及其对照组,5 ng/ml PGD2处理组(PGD2组)及其对照组,对照组给予等量PBS缓冲液处理。以5 mmol/L槐果碱处理组及其对照组为例,分别取生长至对数期的槐果碱组和对照组A549细胞,胰酶消化吹打成单个细胞,用含有10% FBS的RPMI-1640培养液悬浮细胞,调整细胞密度约为50个/ml,以每孔2 ml的量接种于6孔板中,轻轻晃动6孔板使细胞均匀分散开。置于37 ℃、5% CO培养箱中静置培养10~14 d,期间每隔3 d更换1次细胞培养液。待培养皿中出现肉眼可见的克隆时,终止培养,弃掉上清液,用PBS缓冲液轻轻洗涤3次,甲醇固定15 min,Gimesa染色液染色15~30 min,洗去染色液后室温静置干燥,观察并记录克隆形成数量。5 ng/ml PGD2处理组及其对照组克隆形成实验方法同上。
1.4 BrdU实验
分组及处理:根据1.2实验结果选取5 mmol/L槐果碱处理细胞进行BrdU实验。制备细胞悬液方法同1.3,将细胞悬液随机分为2组,分别为5 mmol/L槐果碱处理组及其对照组,对照组给予等量PBS缓冲液处理。将2组细胞分别用胰酶消化离心重悬后,按1~2×10个/孔将细胞加入到24孔板中,孔中提前放置细胞爬片,待细胞密度生长至50%~60%时,加入1 mg/ml BrdU于培养细胞中进行标记,加入BrdU量以铺满24孔板孔面为宜,标记48 h。PBS缓冲液晃动清洗细胞爬片3次,每次5 min,4%多聚甲醛固定30 min。固定后用PBS洗涤3次,每次5 min,置于2 mol/L盐酸中37 ℃变性5 min,再用0.1 mol/L硼酸钠中和10 min,PBS洗涤3次,每次5 min。加入0.2% Triton X-100通透10 min,通透后弃掉Triton X-100,PBS洗涤3次,每次5 min。加入1 ml 3% BSA,室温封闭1 h,PBS洗涤3次,每次5 min。加入按1∶200稀释的鼠源BrdU单抗,4 ℃孵育过夜。PBS洗涤3次,每次10 min。加入按1∶100 稀释的HRP标记的羊抗鼠IgG,室温避光孵育1 h。PBS洗涤3次,每次10 min。加入1 mg/ml的DAPI染液染细胞核,按1∶1 000稀释,室温避光孵育10 min。PBS洗涤3次,每次10 min。中性树胶封片,置于荧光显微镜下观察。
1.5 Western blot实验
Western blot检测PCNA、MYC、Bax、Bcl-2、L-PTGDS和PTGDR2蛋白:细胞分组方法同1.4,将细胞分为5 mmol/L槐果碱处理组及其对照组,培养48 h后分别收取2组细胞样品后进行后续实验。弃掉细胞培养液,用PBS缓冲液轻轻冲洗2次,加入现配的细胞裂解液,将细胞收集至1.5 ml离心管中,冰浴30 min,超声仪破碎细胞样品,4 000 r/min离心10 min,取上清液测定蛋白浓度,加入上样缓冲液,95 ℃金属浴煮沸。于SDS-PAGE胶上电泳,65 V恒压电泳30 min,待溴酚蓝标记进入分离胶后,更换为120 V电压至电泳结束。再将蛋白转印至PVDF膜上,封闭2 h,分别加入1∶1 000 稀释的PCNA、MYC、Bax、Bcl-2蛋白的鼠源单抗,室温孵育4~6 h,TBST洗膜3次,每次10 min。加入1∶2 000稀释的对应二抗室温孵育2 h,TBST洗膜3次,每次10 min。显色液显色后上机曝光分析各目的蛋白的相对含量,以GAPDH作为内参对照。Western blot检测L-PTGDS和PTGDR2蛋白:将A549细胞随机分为2组,分别为5 ng/ml PGD2处理组和对照组,对照组给予等量PBS缓冲液处理,培养48 h后分别收取2组细胞样品进行Western blot实验,具体实验方法同上,孵育一抗时替换为L-PTGDS和PTGDR2蛋白鼠源单抗。
1.6 TUNEL实验
分组及处理:将细胞随机分为4组,分别为5 mmol/L槐果碱组及其对照组,5 ng/ml PGD2处理组及其对照组,对照组给予等量PBS缓冲液处理,根据分组分别进行后续实验。按照TUNEL法检测细胞凋亡试剂盒说明书进行实验。将处理后细胞分别接种于24孔板中,板中提前放入细胞爬片,待细胞长满70%~80%时取出细胞爬片,自然晾干,室温固定15~30 min,PBS洗涤3次,每次5 min。浸入封闭液中,室温封闭10 min,PBS洗涤3次,每次5 min。浸入细胞膜通透液中,室温静置0.5~2 min,再进行后续标记反应,标记反应需在湿盒中进行操作。
将处理好的细胞爬片用PBS缓冲液漂洗后,滤纸吸去周围液体,每个样本滴加100 μl TdT酶反应液,37 ℃避光孵育60 min。用1∶10稀释的20×SSC溶液终止反应,室温静置15 min,PBS洗涤3次,每次5 min。进入0.3% HO/PBS中室温封闭5 min,PBS洗涤3次,每次5 min;滴加100 μl Streptavidin-HRP工作液,37 ℃孵育60 min,PBS洗涤3次,每次5 min。滴加DAB显色液,去离子水冲洗数次后用中型树胶封片,置于荧光显微镜下观察。
1.7 流式细胞术检测细胞凋亡率
槐果碱处理A549细胞48 h后,取槐果碱处理组细胞及对照组细胞,收集细胞培养液于离心管中,PBS缓冲液洗涤细胞,加入适量胰酶消化细胞,收集消化后细胞于离心管中并加入之前收集的细胞培养液。离心后弃上清液,收集细胞,用PBS缓冲液重悬并计数。每组分别取5×10个重悬细胞,1 000 r/min离心5 min后弃上清液,加入流式细胞术缓冲液重悬各组细胞后,室温避光孵育10 min,1 000 r/min离心5 min,再加入Annexin-FITC结合液及PI凋亡染色液试剂,轻轻混匀后冰浴避光孵育15 min,置于流式细胞仪上检测细胞凋亡效率。
2 结果
2.1 槐果碱对肺癌A549细胞作用48 h后IC
不同浓度(1、2、4、8、16、32、64 mmol/L)槐果碱处理肺癌细胞A549,MTT检测细胞增殖抑制率,计算IC,结果显示,槐果碱对A549的IC为5.196 mmol/L(图1),后续实验槐果碱给药浓度为5 mmol/L。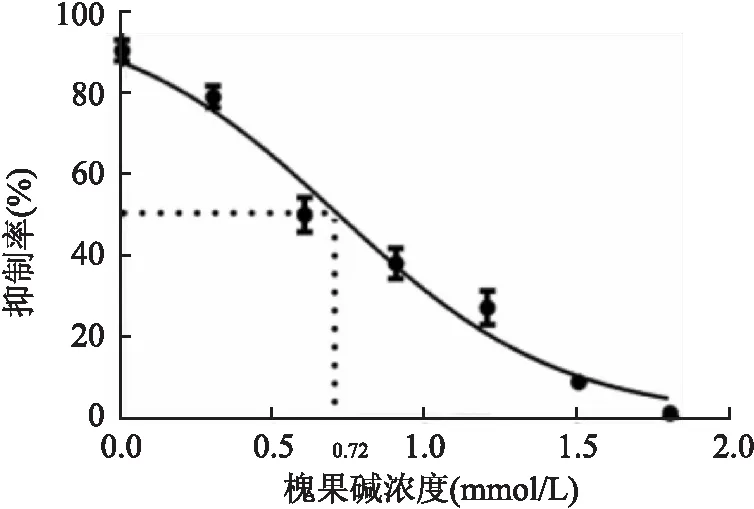
图1 MTT检测槐果碱对A549的IC50
2.2 槐果碱对肺癌A549细胞的增殖作用的影响
克隆形成和BrdU实验结果显示,5 mmol/L槐果碱处理的槐果碱组肺癌细胞A549细胞增殖低于对照组(图2A,t
=9.333;图2B,t
=10.530,P
<0.05),Western blot结果显示,槐果碱组PCNA和MYC蛋白表达低于对照组,差异均有统计学意义(图2C,P
<0.05)。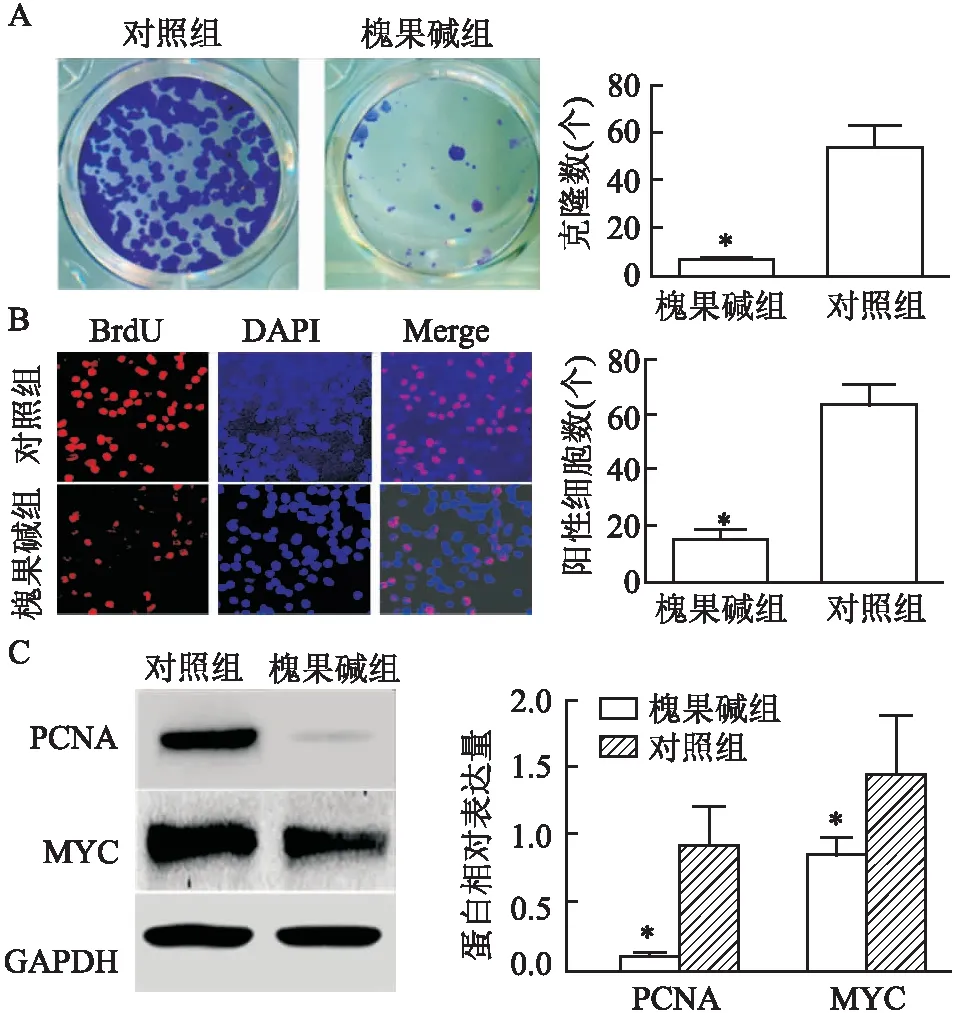
图2 槐果碱对肺癌增殖的影响
2.3 槐果碱对肺癌A549细胞的凋亡作用的影响
TUNEL和流式实验结果显示,5 mmol/L槐果碱处理的槐果碱组肺癌细胞A549细胞凋亡率高于对照组(图3A,t
=6.884;图3B,t
=5.676,P
<0.05),Western blot结果显示,槐果碱组Bax蛋白表达高于对照组,Bcl-2蛋白表达低于对照组,差异均有统计学意义(图3C,P
<0.05)。
图3 槐果碱促进肺癌凋亡
2.4 槐果碱对肺癌A549细胞PGD2/PTGDR2通路的影响
Western blot结果显示,5 mmol/L槐果碱处理的槐果碱组肺癌细胞A549细胞L-PTGDS和PTGDR2蛋白表达高于对照组,差异均有统计学意义(图4,P
<0.05)。
图4 槐果碱激活PGD2/PTGDR2通路
2.5 激活PGD2/PTGDR2通路对肺癌A549细胞的影响情况
PGD2组给与5 ng/ml PGD2激活剂处理,与对照组比较,PGD2组L-PTGDS和PTGDR2蛋白表达显著升高(图5A),细胞增殖受到抑制(图5B),凋亡增加(图5C),差异均有统计学意义(P
<0.05)。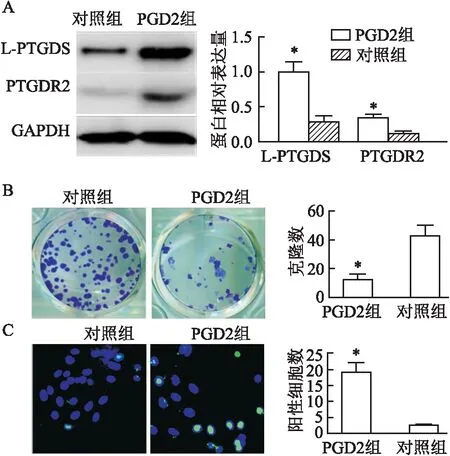
图5 激活PGD2/PTGDR2通路抑制肺癌发生
3 讨论
槐果碱作为传统中药苦参的活性成分,近期研究显示其具有抑制肿瘤增殖、抗肿瘤浸润及远处转移和诱导肿瘤细胞凋亡等重要作用,在一定的浓度范围内槐果碱可激活细胞凋亡通路,诱导细胞发生凋亡。因此,该研究重点研究A549肺癌细胞在给予槐果碱处理后其细胞增殖和凋亡情况的变化,通过克隆形成实验、BrdU实验、TUNEL实验以及流式细胞术实验表明槐果碱能有效抑制A549细胞增殖并促进A549细胞凋亡。
PCNA只存在于正常的增殖细胞和肿瘤细胞中,是研究肿瘤细胞增殖活性的一种重要标志物,PCNA是DNA聚合酶的一种辅助因子,主要在S期和G期合成,其表达和细胞的增殖程度紧密相关,相关研究表明PCNA表达与肿瘤的病理分型和远端转移存在正相关关系。MYC是一种重要的原癌基因,在大多数人类癌症中表达量升高,与肿瘤的发生密切相关。MYC在正常细胞中可参与调控维持细胞稳态、阻止细胞分化等多个过程,但在肿瘤细胞中MYC被异常激活,调控机制发生异常,从而导致肿瘤细胞凋亡及增殖异常,据报道MYC可通过影响肿瘤干细胞的分化和促进血管生成来干扰肿瘤细胞的凋亡。该研究表明槐果碱作用于A549细胞后PCNA和MYC蛋白表达量显著降低,表明槐果碱可抑制肺癌细胞增殖和促进肺癌细胞凋亡。
Bcl-2家族蛋白分为细胞凋亡抑制剂和凋亡促进剂2类,在调控细胞凋亡过程中发挥关键作用。Bax蛋白和Bcl-2蛋白是Bcl-2家族的主要成员。Bcl-2蛋白一般位于线粒体外膜、内质网和核膜的胞质侧,可通过抑制谷胱甘肽(GSH)外泄,降低细胞内氧化还原电位,从而发挥抑制细胞凋亡作用。Bax蛋白生物学功能与Bcl-2蛋白相反,其可通过与Bcl-2结合从而抑制Bcl-2蛋白的抗凋亡作用。该研究表明槐果碱作用于A549细胞后,Bax表达水平明显升高而Bcl-2表达水平则受到明显抑制,研究表明槐果碱可参与调控Bcl-2家族蛋白从而促进肺癌细胞凋亡。
Zhang et al研究表明前列腺素D2(PGD2)与其受体(PTGDR2)之间的信号通路对胃癌具有抗肿瘤作用,在体外可抑制肿瘤细胞的自我更新,在体内能够抑制肿瘤的增长和转移。研究表明,肿瘤组织中PTGDR2和PGD2合成酶(L-PTGDS)的表达水平显著低于邻近正常组织,且肿瘤组织中PTGDR2和L-PTGDS的表达水平与肿瘤干细胞(CSC)标志物Sall和Lgr5呈负相关。在CSC中敲低PTGDR2和L-PTGDS的表达可导致CSC标志物表达量增加,自我更新能力增强,过表达L-PTGDS或直接刺激PGD2可导致相反的效应。此外,Zhang et al研究表明PGD2/PTGDR2信号通路是通过抑制STAT3基因的激活来抑制JAK/STAT3信号通路进而发挥抑制肿瘤细胞的作用。该研究中Western blot实验表明对照组A549细胞中L-PTGDS和PTGDR2表达量显著降低,槐果碱组细胞中L-PTGDS和PTGDR2表达量显著增加,表明槐果碱能够激活PGD2/PTGDR2信号通路。且给予PGD2激活剂处理后,与对照组细胞相比,PGD2组细胞的增殖受到抑制,细胞凋亡则显著增加,表明槐果碱可通过激活PGD2/PTGDR2信号通路来抑制A549肺癌细胞增殖和诱导其凋亡,进而抑制肺癌的发生。

