MitoQ通过NIX介导的线粒体自噬对肺腺癌A549细胞迁移及凋亡的影响
刘鹏程,张 晔,陈晓宇,赵大海
肺癌的高发病率和低生存期仍然是目前的难题。寻找抑制癌细胞增殖、迁移,促进癌细胞凋亡的新方法至关重要。MitoQ 是由具有抗氧化作用的辅酶Q 和具有靶向作用的三苯基膦组成。与一般的辅酶Q相比,MitoQ可以在线粒体中大量积累,从而保护线粒体免受氧化应激损伤。研究表明,MitoQ在多种疾病的治疗过程中发挥重要作用,如帕金森病、缺血再灌注损伤等,同时随着研究的深入,越来越多的证据表明MitoQ参与了肿瘤的发生发展及诱导肿瘤细胞凋亡。线粒体自噬包括PINK1(PTEN induced putative kinase 1)/Parkin、BNIP3L(protein 3-like protein)/Nix和FUNDC1(FUN14 domain containing 1)等多条途径,研究表明在多种疾病中都存在线粒体自噬功能的失调。然而,截止目前,MitoQ作用癌细胞的机制仍不清晰,因此,寻找其中的分子机制对改善患者的预后具有重要意义,该研究拟采用不同浓度的MitoQ体外作用A549细胞,探讨MitoQ在肺腺癌细胞中所发挥的功能机制,期望为肺癌的治疗提供思路。
1 材料与方法
1.1 细胞
人肺腺癌A549细胞购自广东吉尼欧生物技术有限公司。1.2 主要试剂
MitoQ购自美国ABMole公司, DMEM高糖培养基、胎牛血清均购自美国HyClone公司,DAPI溶液、RIPA强裂解液均购自北京索莱宝科技有限公司,NIX抗体购自英国abcam公司,p62抗体、Bax抗体均购自北京博奥森生物技术有限公司,BCA蛋白定量试剂盒、CCK-8试剂盒均购自上海碧云天生物技术有限公司,ECL超敏发光液购自美国PIERCE公司。1.3 主要仪器
二氧化碳培养箱购自日本Sanyo公司;酶联免疫分析、电泳仪器均购自美国Bio-Rad公司;倒置显微镜购自日本Olympus公司。1.4 细胞培养
A549细胞用含10%胎牛血清和100 U/ml的青霉素-链霉素的DMEM培养基,37 ℃、5% CO下培养。当细胞生长到对数生长期时用PBS清洗细胞,使用胰酶消化细胞1 min,以1 000 r/min离心5 min后收集细胞,弃去上清液,加入新鲜培养基重悬。将细胞分到新的培养皿中,培养过夜。1.5 CCK-8法检测细胞增殖能力
用胰酶消化收集对数期细胞,调整细胞密度,96孔板每孔加入100 μl细胞悬液,使细胞密度为4×10/孔左右。同时设置无细胞的对照组,放入CO培养箱中培养,待细胞完全贴壁后加入不同浓度的MitoQ(0、0.125、0.25、0.5、1、2、5、10、20 μmol/L)处理12 h,更换新鲜培养基后每孔加入10 μl CCK-8溶液,培养箱中孵育1 h后使用酶标仪测定450 nm处的吸光度值。实验重复3次。细胞存活率=[(实验孔-空白孔)/(对照孔-空白孔)]× 100%。1.6 细胞划痕实验测定A549细胞的迁移能力
将A549细胞接种于6孔板中培养24 h,待细胞铺满培养皿时,沿中心轴方向,用200 μl微量吸管在培养基表面划线,用PBS清洗3次,加入含有不同浓度MitoQ(0、10 μmol/L)的无血清DMEM培养基,放入培养箱中培养12 h,于固定位置用显微镜拍照并计算细胞迁移率(伤口愈合百分比)。细胞迁移率=(0 h划痕面积-12 h划痕面积)/0 h划痕面积×100%。1.7 Western blot检测NIX、p62、Bax的表达
将A549细胞接种于6孔板中培养。加入含有不同浓度MitoQ(0、0.5、1、2、5、10 μmol/L)的培养基处理细胞12 h后。用4 ℃ PBS洗涤细胞3次,然后用细胞刮铲均匀收集培养皿中的细胞,加入蛋白裂解液RIPA和蛋白酶抑制剂PMSF裂解细胞,并使用4 ℃离心机离心,收集蛋白上清液分装,用BCA试剂盒测定蛋白浓度。用SDS-PAGE电泳分离蛋白质并转移到PVDF膜上。膜用5%脱脂牛奶封闭1 h后,与抗Bax(1∶500)、抗p62(1∶500)、抗NIX(1∶1 000)4 ℃孵育过夜,室温下孵育辣根过氧化物酶标记羊抗兔IgG(1∶2 500)1 h,最后用ECL试剂曝光条带,ImageJ测定目的条带和内参蛋白GAPDH灰度值,实验重复3次。
2 结果
2.1 MitoQ抑制A549细胞增殖能力
不同浓度的MitoQ处理A549细胞12 h后,采用CCK-8检测试剂盒测定A549细胞在相应药物浓度下的细胞活性。如图1所示,与对照组比较,MitoQ抑制了A549细胞的增殖。数据采用单因素方差分析,细胞活力差异有统计学意义(F
=97.366,P
<0.001)。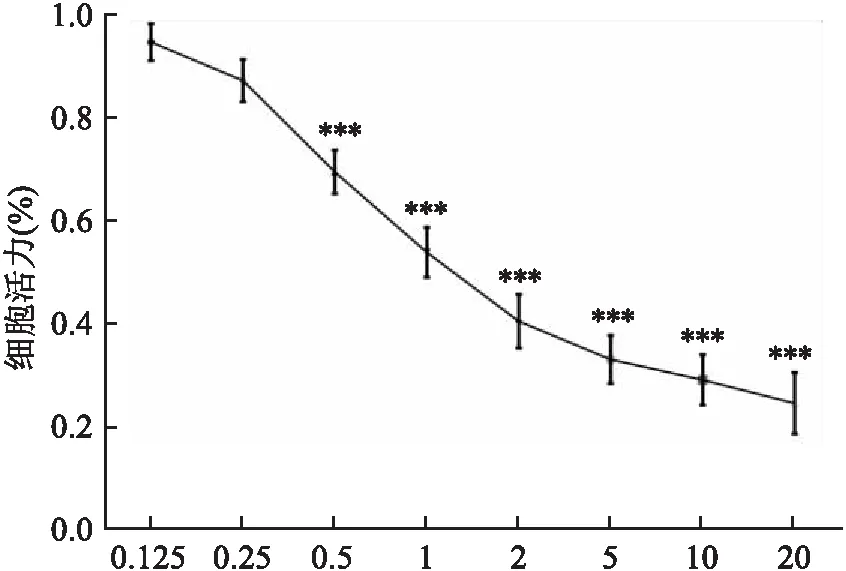
图1 不同浓度MitoQ对A549细胞增殖的影响
2.2 MitoQ抑制A549细胞迁移能力
如图2、3所示,使用不同浓度的MitoQ(0、10 μmol/L)作用A549细胞12 h,与对照组(0 μmol/L)比较,MitoQ组(10 μmol/L)显著抑制了A549细胞的迁移能力(P
<0.05)。对照组细胞迁移能力为(41.4±5.8)%,MitoQ组(10 μmol/L)细胞迁移能力降至(20.7±2.7)%,数据采用独立样本t
检验,t
=-5.628,P
=0.005,细胞迁移能力差异有统计学意义(P
<0.01)。
图2 不同浓度MitoQ对A549细胞迁移能力的影响 ×200
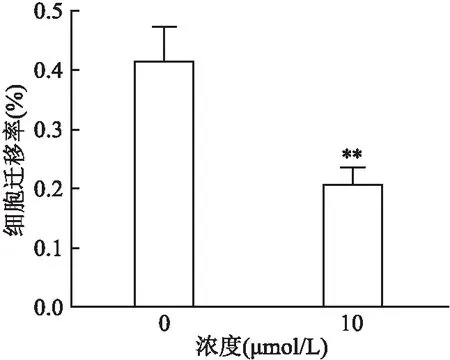
图3 不同浓度MitoQ对A549细胞迁移能力的影响
2.3 MitoQ可以上调A549细胞自噬从而诱导A549的凋亡
如图4所示,该课题组研究了MitoQ(0.0、0.5、1.0、2.0、5.0、10.0 μmol/L)处理A549细胞12 h后NIX、p62、Bax等自噬及凋亡相关蛋白的变化,Western blot结果显示,自噬相关蛋白NIX及凋亡相关蛋白Bax在MitoQ组中的表达呈剂量依赖性增加,自噬蛋白p62表达下降。MitoQ以剂量依赖的方式上调细胞自噬诱导细胞凋亡。数据采用单因素方差分析,蛋白表达量差异有统计学意义,其中NIX蛋白组F
=31.098,P
<0.001;Bax蛋白组F
=38.923,P
<0.001;p62蛋白组F
=34.600,P
<0.001。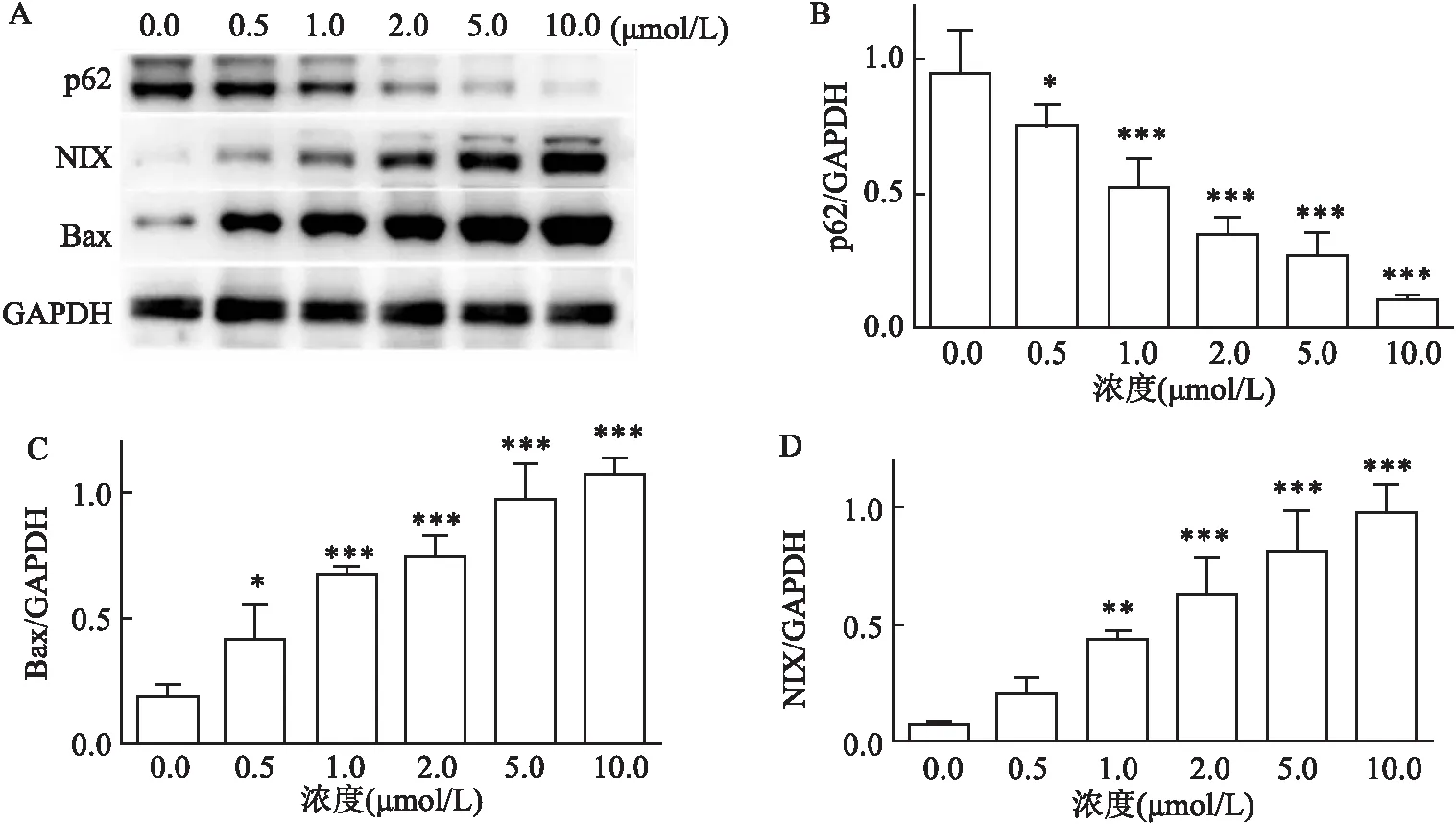
图4 不同浓度MitoQ对A549细胞自噬和凋亡相关蛋白表达的影响
3 讨论
根据世界卫生组织国际癌症研究署(international agency for research on cancer, IARC)2018年发布的癌症报告,肺癌的发病率和病死率均高居恶性肿瘤首位。因此,明确肺癌发生、发展的分子机制和途径,寻找能够抑制癌细胞增殖,减少其侵袭和转移并最终促进癌细胞凋亡的方法是治疗肺癌的重要突破口。作为一种特殊的自噬形式,线粒体自噬利用自噬溶酶体特异性的清除异常的线粒体,参与细胞的能量及物质代谢。线粒体在正常新陈代谢中产生大量活性氧。对于正常组织和细胞而言,线粒体ROS由于受到抗氧化体系的调控而处于较低水平。然而在肿瘤细胞中,由于线粒体的功能障碍,癌细胞比正常细胞具有更高的ROS水平,这在很大程度上促进了癌症的发展。癌细胞的线粒体结构和功能发生改变使其对特定的分子更敏感,因此,针对线粒体的靶向药物是一类比较有应用潜力的抗癌药。
目前MitoQ诱导的线粒体自噬可以诱导超氧化物的产生进而导致细胞凋亡,并且在癌症的治疗上也具有明显的效果。课题组前期预实验的研究结果也表明MitoQ可以明显抑制A549细胞的生长,差异有统计学意义。然而,大型随机临床试验和一些生物学研究提出了相互矛盾的结果。自噬作为一把“双刃剑”,它既可以通过破坏细胞的营养和能量代谢来抑制肿瘤的发展,也可以通过赋予肿瘤细胞抵抗氧化应激的优势来促进肿瘤的进展,目前已有研究表明抗氧化剂本身会产生不良影响,如促进黑色素瘤的发生。通过大量使用抗氧化剂来地毯式的清除细胞内的ROS是有害的,因为它们不能在特定的生成部位特异性的清除ROS。因此,线粒体靶向抗氧化剂MitoQ在抗癌方面可能具有一定的的优势。
该研究利用不同浓度的MitoQ作用人肺腺癌细胞12 h后,在倒置显微镜中观察到MitoQ组较对照组细胞形态偏圆,细胞密度降低,提示肺癌细胞可能发生了凋亡,CCK-8实验显示MitoQ可显著抑制A549细胞的增殖,通过无血清DMEM培养基在抑制A549细胞增殖的背景下进行了细胞划痕实验,结果显示其可显著抑制肺癌细胞的迁移,体外实验表明MitoQ具有良好的抗癌活性,随后通过Western blot半定量检测自噬及凋亡蛋白的表达情况,结果显示自噬相关蛋白NIX表达上调,p62表达下调,凋亡相关蛋白Bax表达上调,差异均有统计学意义(P
<0.05),BNIP3L位于线粒体外膜,不仅可以通过Parkin-p62通路调节Parkin中的位移,然后激活细胞自噬,而且还可作为自噬受体与Atg8家族蛋白直接结合,将自噬体的前体招募到线粒体上。Bax是线粒体自噬过程中的一个重要分子,属于Bcl-2家族,同时也被认为是促凋亡蛋白。p62 蛋白能通过电压依赖性阴离子通道蛋白1(volt age-dependent anion channel 1 protein,VDAC1)经p62-LC3进入自噬-溶酶体系统降解。自噬增强时p62蛋白被降解增多,自噬减弱时,p62 蛋白降解减少,在胞质中蓄积。同时p62蛋白还作为一个重要的caspase-8细胞凋亡的调节器。该研究表明,MitoQ组NIX、Bax蛋白表达增强,提示相对于对照组,MitoQ组细胞的自噬及自噬流增强,Bax蛋白表达上调,caspase家族活化,细胞凋亡增加。与此同时,目前主流科学界认为NiX介导的线粒体自噬机制主要包括以下几个方面,通过与 Parkin相互作用介导线粒体自噬;Nix作为自噬受体招募Atg8蛋白家族启动线粒体自噬;Nix增加细胞质中游离的 Beclin-1诱导自噬。在肺癌中,NIX蛋白介导的线粒体自噬增强的具体通路及线粒体自噬与凋亡间的具体联系仍不清晰,且鲜有文献报道。在后续研究中,该课题组将进一步在其他细胞系中体外验证实验结果,动物荷瘤实验也将同步展开,联合内质网应激、非编码RNA等进一步探讨MitoQ影响线粒体自噬及凋亡的具体分子通路。
