基于CB2受体活化探讨CD4+T细胞分化缓解中性粒细胞大鼠哮喘模型的作用机制
莫濡冰,黄琳惠,蒙 冲,蔡兴俊
CD4T淋巴细胞(CD4T)在哮喘发病中起重要作用。许多研究表明,Th2介导的免疫反应增强是哮喘临床症状的主要原因,尤其是嗜酸性粒细胞浸润。然而,最近几项研究表明,中性粒细胞(而非嗜酸性粒细胞)是持续或急性加重哮喘患者的主要炎性细胞类型。此外,越来越多的研究表明哮喘是一种高度异质性疾病;需要研究中性粒细胞在哮喘中的作用,以确定治疗哮喘期间中性粒细胞气道炎症的其他选择。CB2受体是G蛋白偶联受体家族的成员,主要在免疫系统的细胞中表达,并且其表达水平在T细胞活化过程中增加。此外,CB2受体是T细胞亚群形成所必需的。由于CB2与免疫调节作用有关,因此,其被认为是炎症性疾病的可能治疗靶点。目前,CB2激动剂可作为治疗炎性疾病的潜在药理学工具,如类风湿关节炎、动脉粥样硬化、结肠炎等。有研究表明,CB2的保护活性取决于滑膜组织,T淋巴细胞以及肠神经元中表达的CB2受体。然而,关于CB2受体活化在缓解中性粒细胞型哮喘中作用的报告较少。该研究通过构建中性粒细胞大鼠哮喘模型,分析了JTE-907(大麻素类CB2受体反向激动剂)对疾病的治疗效果,并通过观察其对CD4幼稚T细胞分化影响来确定CB2受体活化的潜在治疗机制。
1 材料与方法
1.1 材料
1
.1
.1
实验动物 SD大鼠(无特定病原体等级,4周龄)购自北京斯贝福生物技术有限公司,许可证号:SCXK-(京)2016-0002,雄性。大鼠在SPF条件下[温度:(25±0.5)℃,湿度:(55±5)%,12 h/12 h明暗循环]饲养,并提供无菌食物和水。从SD大鼠的脾脏中分离出CD4T细胞。通过使用DynabeadsMouse Pan B清除B细胞,随后用Naïve CD4T细胞大鼠分离试剂盒对B缺失的细胞部分进行阴性选择。加入抗CD3e(5 μg/ml)和抗CD28(1 μg/ml)抗体激活CD4细胞6 d,然后加入特定的细胞因子和抗体混合物用于诱导Th细胞亚型的极化:Th1分化加入白介素(interleukin,IL)-12(10 ng/ml)和Anti-IL-4(5 μg/ml),Th2分化加入IL-4(10 ng/ml)和Anti-IL-12(5 μg/ml),Th9分化加入IL-4(10 ng/ml)、转化生长因子(transforming growth factor,TGF)-β(10 ng/ml)和Anti-IL-12(5 μg/ml),Th17分化加入IL-6(10 ng/ml)、TGF-β(10 ng/ml)、Anti-IL-4(5 μg/ml)和Anti-IL-12(5 μg/ml),Treg分化加入TGF-β(10 ng/ml)、Anti-IL-4(5 μg/ml)和Anti-IL-12(5 μg/ml)。同时,加入或不加入JTE907[溶解在二甲亚砜(DMSO)中至终浓度10mol/L,并在细胞培养基中稀释至实验浓度10、10或10mol/L]与细胞一起培养6 d,获得分化的T细胞亚型。1
.1
.2
试剂与仪器 DynabeadsMouse Pan B购自美国Invitrogen公司,Naïve CD4T细胞大鼠分离试剂盒购自美国Miltenyi公司,JTE907购自英国R&D Systems公司,RNeasy Plus Micro Kit、高容量cDNA反转录试剂盒均购自美国Qiagen公司,TaqMan基因表达预混液购自美国Applied Biosystem公司,RNA引物购自美国Thermo fisher公司,OVA(鸡卵清蛋白)、LPS购自美国Sigma-Aldrich公司,气道炎症评估ELISA试剂盒购自美国R&D Systems公司,大鼠OVA特异性IgE ELISA试剂盒购自厦门慧嘉生物科技有限公司,RIPA裂解缓冲液购自北京Solarbio公司。7300 qRT-PCR系统购自美国Applied Biosystem公司,FACS CantoTM II流式细胞仪购自美国BD Biosciences公司,FlowJo 7.6.1软件购自美国Tree Star公司。1.2 实时定量PCR
使用RNeasy Plus Micro Kit进行RNA分离。使用高容量cDNA反转录试剂盒将总RNA转换为cDNA。所有qRT-PCR反应均使用7300 qRT-PCR系统进行,扩增使用TaqMan基因表达预混液进行。使用以下引物检测RNA表达:Tbx21、Gata3、IL-9、ROR-C、FoxP3、CNR2和管家基因18S rRNA。使用2方法进行qRT-PCR分析。1.3 模型建立和实验分组
将40只动物随机分为4组(n
=10):对照组、模型(Model)组、JTE-907低剂量组(JTE-907-L,腹腔注射5 mg/kg)和JTE-907高剂量组(JTE-907-H,20 mg/kg)。除正常对照组外,其他组的大鼠在实验方案的第0和7天分别通过2次腹膜内注射10 mg OVA(鸡卵清蛋白)和鼻腔滴入0.1 μg LPS。从第15天起,将大鼠放入密闭室35×25×15(cm)中,连续3周(30 min/次和1次/2 d)暴露于2% OVA的气溶胶中。在用OVA雾化刺激前2 h,JTE-907组每天1次通过腹腔注射给药对大鼠进行不同浓度的JTE-907治疗。其余组腹腔注射生理盐水。1.4 标本采集
在最后一次OVA激发后24 h内,每只大鼠腹腔注射10%水合氯醛,剂量为4 mg/kg。用玻璃毛细管从眼后丛取血样并离心,血清在液氮中快速冷冻,并在-80 ℃下储存。将大鼠胸腔切开,切断气管上部并插管。常规收集的支气管肺泡灌洗液(BALF),并在400 r/min下离心10 min,并将上清液保存在-80 ℃下备用。将BALF沉淀物重悬于PBS中以进行细胞涂片,获得白细胞计数。收集BALF后,从右肺切下肺组织用于组织学分析。其余的肺组织样品用于蛋白质提取。1.5 血清OVA特异性IgE测定
使用大鼠OVA特异性IgE ELISA试剂盒进行OVA特异性IgE测量。1.6 气道炎症评估
使用血细胞仪测定细胞总数。BALF细胞涂片用Gimsa染色,以确定细胞计数差异。通过ELISA试剂盒分析BALF中干扰素(interferon,IFN)-γ、IL-5、IL-17、IL-10和肿瘤坏死因子(tumor necrosis factors,TNF)-α的水平。1.7 组织学分析
大鼠肺组织在4%多聚甲醛中固定3 d,石蜡包埋。切片(5 μm)用常规组织学技术进行HE染色,在观察病理和结构变化。1.8 流式细胞术
计算大鼠脾脏的T细胞悬液,制备成细胞10个/ml,用FITC-anti-CD4、APC-anti-CD25抗体染色30 min,然后固定和渗透,再用PE-抗Foxp3,PE-抗IL-17A抗体染色1 h。在FACS CantoTM Ⅱ流式细胞仪进行分析,并用FlowJo 7.6.1软件处理结果。1.9 Western blot分析
采用RIPA裂解缓冲液从肺组织中提取蛋白质。将含有20 μg蛋白质的样品在10%的SDS-PAGE凝胶上分离并转移到PVDF膜上。在室温下用5%脱脂牛奶封闭膜2 h,然后用相应的主要抗体:RORγt(1∶4 000稀释)、Foxp3(1∶2 000稀释)、STAT5(1∶2 000稀释)、p-STAT5(1∶1 000稀释)和GAPDH(1∶5 000稀释)在4 ℃下培养过夜。最后用HRP结合的二级抗体(1∶5 000稀释)孵育2 h,用ECL试剂显影。1.10 统计学处理
采用SPSS 17.0软件进行数据统计分析。单因素方差分析各组间Th特异性转录因子的表达、OVA-sIgE水平、BALF细胞、肺组织的炎症评分、BALF中细胞因子水平和肺组织中Th17和Treg转录因子表达的统计学意义,Tukey检验各组间的显著性。P
<0.05认为差异有统计学意义。2 结果
2.1 CB2受体参与CD4
T细胞分化
qRT-PCR分析显示,JTE907不能诱导Tbx21(图1A)、IL-9(图1B)、GATA3(图1C)和ROR-C(图1D)的转录。相反,JTE907在所有测试浓度下诱导FoxP3的转录(图1E)。在此背景下,该研究还通过qRT-PCR分析了CB2受体的表达,结果显示JTE907处理在所有测试浓度下上调了CNR2表达(图1F)。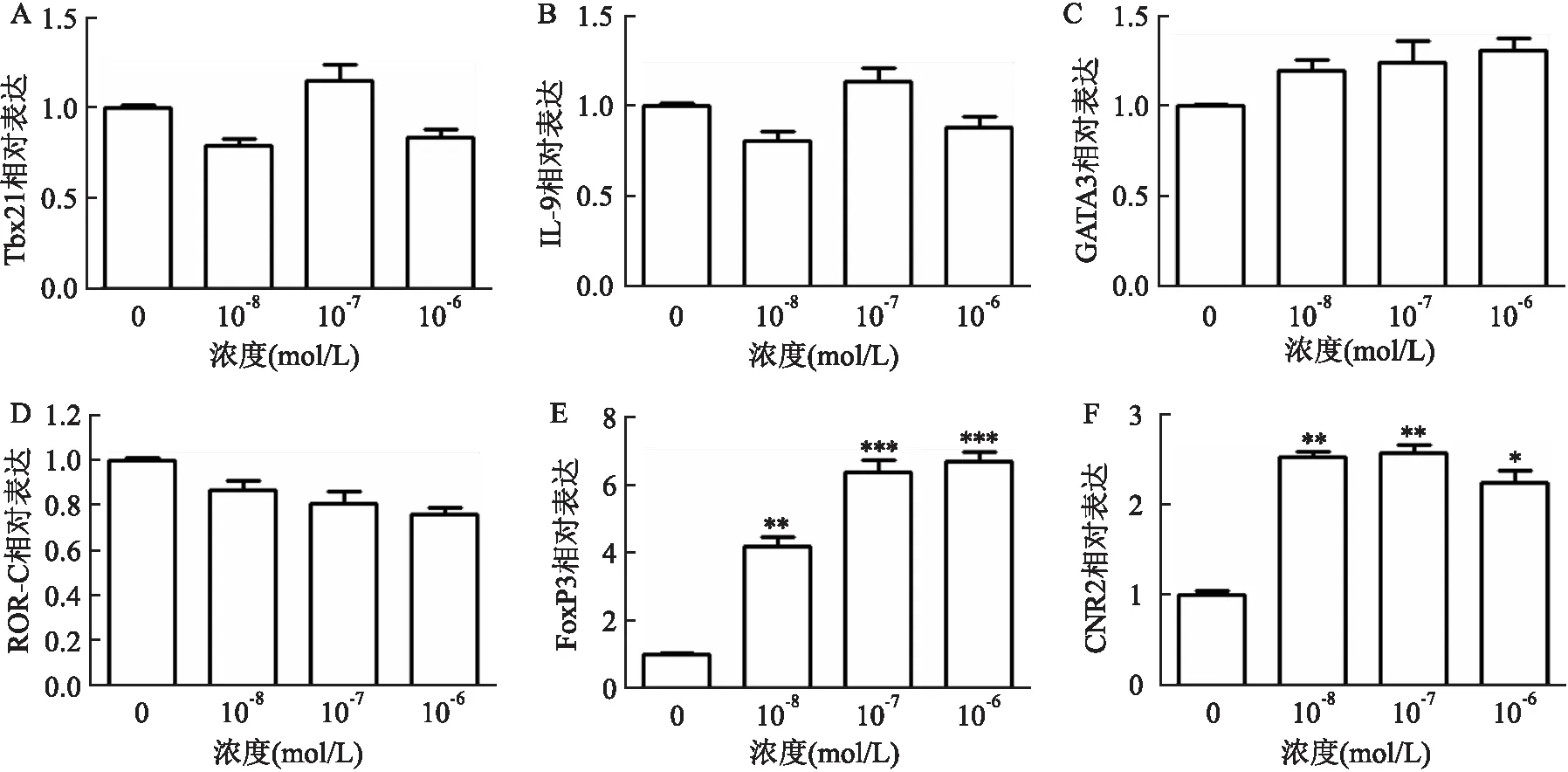
图1 qRT-PCR检测JTE907调节Th特异性转录因子的表达
2.2 JTE-907对血清OVA特异性IgE水平及BALF细胞变化的影响
OVA致敏和LPS刺激后,模型组大鼠血清中OVA-sIgE水平上调。相反,JTE-907治疗组降低了大鼠血清中OVA-sIgE水平(图2A)。对照组BALF细胞总数为14.27×10个,仅有少量嗜酸性粒细胞和少量中性粒细胞(2.39×10)。模型组BALF中肺细胞总数(36.2×10)、中性粒细胞(9.26×10)和嗜酸性粒细胞(6.57×10)增多。经JTE-907处理的小鼠的总细胞数减少(23.68×10),并且JTE-907还减少了中性粒细胞(5.3×10)、嗜酸性粒细胞(3.09×10)和巨噬细胞(9.49×10)的绝对数量(图2B)。
图2 JTE-907的体内治疗对中性粒细胞哮喘的发展的影响
2.3 JTE-907对气道炎症的抑制作用
为了获得炎症细胞浸润到组织中的证据,在最后一次OVA刺激后通过HE染色对大鼠肺切片进行分析。与对照组相比,模型组的大鼠支气管周围和血管周围结缔组织的炎性细胞数量增加,表明炎症细胞渗入肺组织(t
=6.712,P
<0.001)。相反,在以5和20 mg/kg 的浓度给药时,JTE-907处理降低了炎症细胞的浸润(t
=4.829、5.547,P
=0.006)(图3)。为探讨JTE-907对细胞因子产生的影响,用ELISA法检测了BALF中细胞因子水平。与正常对照组的大鼠相比,模型组大鼠BALF中的炎性细胞水平要高得多。与模型组相比,JTE-907治疗组大鼠BALF中IFN-γ、TNF-α、IL-17和IL-5水平降低(P
<0.05),并且IL-10水平升高(P
<0.05)(图4)。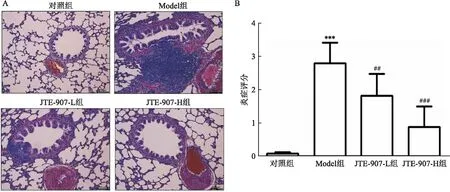
图3 JTE-907抑制了肺组织中炎症细胞的募集
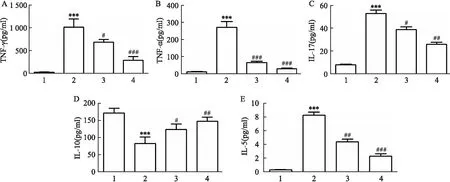
图4 ELISA试剂盒检测JTE907对BALF中细胞因子水平影响
2.4 JTE907对中性粒细胞哮喘模型大鼠脾脏的Th17/Treg平衡的影响
为了解JTE-907是如何通过调节中性粒细胞哮喘模型大鼠的T细胞反应来发挥治疗效果,该研究探讨了JTE-907治疗对大鼠脾脏中Th17和Treg细胞失衡的影响。与正常对照组相比,模型组大鼠脾脏中Th17/Treg比例要高得多(t
=4.915,P
=0.005)。与模型组相比,JTE-907治疗组大鼠脾脏中Th17/Treg比例降低(t
=3.071、2.659,P
=0.028、0.035)(图5)。这些结果表明,JTE-907治疗可以通过恢复Th17/Treg细胞的平衡来减轻大鼠的哮喘。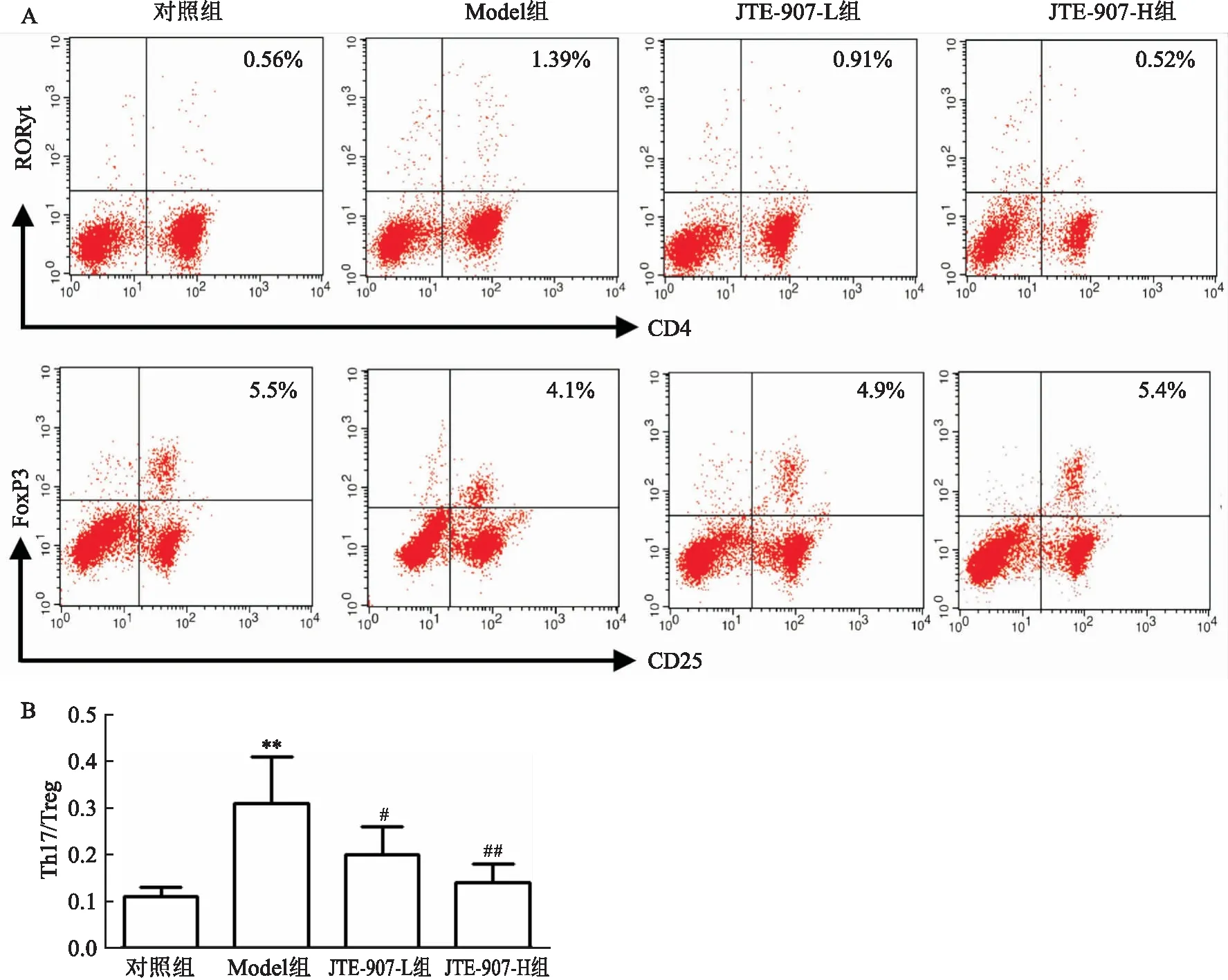
图5 JTE907对中性粒细胞哮喘模型大鼠脾脏的Th17/Treg平衡的影响
2.5 JTE907调节中性粒细胞哮喘模型大鼠肺组织中Th17和Treg转录因子表达
转录因子RORγt和Foxp3分别在Th17和Treg细胞的分化和功能中起关键作用。为了确定JTE907对RORγt和Foxp3表达的影响,该研究评估了大鼠肺组织中RORγt和Foxp3的蛋白水平。如图6所示,与正常对照组相比,模型组大鼠中RORγt蛋白水平增加(P
<0.05)和Foxp3蛋白水平降低(P
<0.05)。JTE-907处理抑制了RORγt蛋白水平(P
<0.05),并增加了Foxp3蛋白水平(P
<0.05)。这些结果表明JTE-907处理可恢复中性粒细胞哮喘模型大鼠肺组织中Th17/Treg细胞的平衡。STAT5激活对于Treg细胞的分化和维持以及抑制Th17细胞的分化至关重要。因此,研究分析了大鼠肺组织中STAT5和p-STAT5的蛋白水平。结果显示,模型组大鼠肺组织中STAT5的磷酸化水平降低(P
<0.05),而JTE-907处理增加了STAT5的磷酸化水平(P
<0.05)(图6)。结果表明JTE907可以增强STAT5的磷酸化,这可能有助于其对Th17/Treg平衡的调节作用。
图6 JTE907对肺组织中Th17和Treg转录因子表达的影响
3 讨论
已知在中性粒细胞性哮喘中,Th17细胞介导的免疫反应在该疾病中起重要作用。Wilson et al研究表明Th17反应可促进气道中性粒细胞增多和急性气道高反应性。低剂量LPS可增强Th17介导的反应,导致IL-17等细胞因子的释放和中性粒细胞的浸润。最近一项研究表明,与对照哮喘患者相比,哮喘患者痰中IL-5和IL-17A mRNA过度表达,并且Th17极化异常与哮喘患者的激素敏感性和严重程度密切相关。因此,更好地了解中性粒细胞哮喘的发病机制和Th17极化的发展将有助于目前类固醇不敏感或严重哮喘的治疗。在目前的研究中,采用OVA致敏和LPS刺激后,大鼠出现典型的Th17免疫反应过度激活和IL-5上调的病理改变,表明中性粒细胞哮喘动物模型建立成功。
在几种炎症模型中,CB2信号传导抑制促炎细胞因子的产生以及白细胞募集到炎症部位,从而降低疾病进展,例如在EAE、脊髓损伤和应激诱导的神经炎症中。目前,已有研究表明通过CB2受体导致免疫抑制的机制包括诱导凋亡、抑制增殖、抑制促炎性细胞因子和诱导Treg细胞。由于其在治疗炎症和自身免疫疾病中的潜在应用价值,因此,选择特异性激活CB2受体化合物治疗可能对中性粒细胞性哮喘有用。JTE907作为CB2的反向激动剂,具有较高的特异性;JTE907在啮齿动物模型中具有抗炎、抗过敏特性。该研究表明通过腹腔注射JTE907治疗对大鼠的哮喘具有保护作用,表现在BALF中的炎症细胞总数和中性粒细胞百分比降低,并且T细胞因子(IFN-γ、IL-5、IL-17)以及中性粒细胞相关的炎症介质TNF-α降低,而抗炎细胞因子IL-10水平升高。因此,该研究推测JTE907通过调节CD4幼稚T细胞向效应T细胞的分化来减弱炎症细胞的浸润。
研究进一步探讨了CB2受体活化对CD4T细胞分化影响。在体外实验中,JTE907能够诱导CD4幼稚T细胞向Treg细胞分化。但是,它不会诱导其他亚型的T细胞分化,例如Th1、Th2、Th9和Th17细胞。众所周知,Treg细胞功能紊乱在多种炎症和自身免疫性疾病中起着重要作用;因此,JTE907可能在治疗以Treg细胞失调为特征的疾病方面具有巨大的潜力。此外,在体内试验中模型组大鼠脾脏和肺组织中Th17/Treg比例比正常组高得多。近年来,研究表明Th17/Treg失衡在中性粒细胞性哮喘的炎症诱导和维持中具有重要作用。与JTE907对细胞因子谱的调节作用一致,它降低Th17细胞比例,增加Treg细胞百分率,从而恢复了Th17/Treg的平衡。此外,该研究还表明了JTE907可以增强STAT5的磷酸化。据报道,STAT5可以直接结合Foxp3基因诱导Treg细胞的发育和维持,也可以直接结合RORγt基因抑制Th17相关基因的转录。因此,JTE907对Th17/Treg平衡的调节作用可能与增强STAT5的磷酸化有关。
综上所述,CB2受体的激活对Th-17介导的中性粒细胞哮喘大鼠有一定的保护作用,其作用机制包括改善Th17/Treg平衡以及调节其各自的细胞因子水平。此外,STAT5的激活可能是JTE907对Th17/Treg失衡调节作用的潜在机制。

