兔伸直型膝关节挛缩模型中肌源性挛缩的病理特征及其机制研究
杨 帆,黄鹏鹏,周 云,张全兵,王 锋,刘阿英,陈 爽,徐齐宇
临床上膝关节损伤治疗中,常常需要辅以膝关节功能位或伸直位固定,而不恰当或长时间固定制动是关节挛缩的一个重要因素,如不早期进行干预,一旦膝关节挛缩发展至后期,即使手术也难以恢复正常关节活动度(range of motion,ROM)。因此,制动引起的膝关节挛缩已成为临床工作中常见难题。
研究表明,在制动早期,限制关节活动的主要原因为肌源性因素(肌肉、肌膜、肌腱等),之后随着固定时间延长关节源性因素(关节囊、关节软骨、韧带等)逐渐占据主导,且ROM恢复愈加困难。所以,阐明早期肌源性挛缩和其病理变化规律,并探讨其中分子机制,对于早期预防和治疗关节挛缩具有重要意义。
1 材料与方法
1.1 实验动物
该实验方案经安徽医科大学动物伦理委员会批准(批准号:LLSC20190761)。该研究使用的30只雄性骨骼发育成熟的新西兰白兔(安徽医科大学实验动物中心,合肥,中国;3~4月龄,体质量2~2.5 kg),单笼饲养在室温、自然光照的环境中,并且被允许在笼内自由地活动和获取水、食物。所有兔按照每组6只随机分为以下5组:对照组(I-0组)不进行石膏固定、石膏固定1周组(I-1组)、固定2周组(I-2组)、固定4周组(I-4组)、固定8周组(I-8组)。在各个固定时间点结束后兔被安乐死,并进行取材以及相关指标的检测。1.2 仪器与试剂
光学显微镜购自厦门麦克奥迪公司;电泳仪和转膜仪购自美国Bio-Rad公司;病理组织包埋机购自常州中微电子有限公司;Masson染色试剂购自福州迈新生物技术开发公司;TRIs购自上海生物工程有限公司;蛋白上样buffer、标准BSA购自于美国Thermo公司;二甲苯Ⅰ溶液、二甲苯Ⅱ溶液、PVDF膜以及兔抗TGF-β1、HIF-1α和过氧化物酶缀合的亲和性山羊抗兔IgG-HRP抗体购自沈阳万类生物公司。1.3 方法
1
.3
.1
动物造模 采用该课题组之前使用的石膏固定模型。简单地说,实验人员用耳静脉注射30 mg/kg戊巴比妥钠麻醉兔后,用管型石膏从兔左侧腹股沟到近端脚趾进行单侧膝关节伸直固定。1
.3
.2
ROM测量 在每个固定的时间点,通过耳静脉注射过量戊巴比妥钠对兔进行安乐死后,实验员从兔左后肢的髋关节脱臼并完全切除,使用团队研制的关节动度测量仪进行兔固定侧后肢的ROM测量。简单地说,实验员通过固定夹与金属圆盘的平台固定兔左后肢的股骨、胫骨和其肌肉附着点的近端和远端。在测量膝ROM时,实验员使用标准扭矩为0.077 N·m转动驱动转盘并间接地转动胫骨,可通过数字测力计控制所施加的力,并且可根据转盘的刻度确定股骨和胫骨之间的ROM变化(图1)。2名实验员进行ROM测量,并对每个膝关节重复测量3次。在该研究中,屈曲角越大代表挛缩程度或运动损失越小。膝关节屈曲的ROM丢失值被称为总挛缩,肌切开术后的屈曲ROM的丢失值称为关节源性挛缩。根据之前的研究,肌源性挛缩为总挛缩和关节源性挛缩的差值。1
.3
.3
组织准备和Masson染色 测量ROM后立刻切取兔左侧股直肌。肌肉标本使用梯度乙醇脱水,然后石蜡包埋。在切片机上取5.0 μm进行切片,脱蜡,进行Masson染色,观察肌纤维萎缩和胶原沉积情况。使用倒置显微镜在400倍放大的条件下观察染色的切片,对5个随机选择的区域进行分析比对,并使用Image-Pro Plus 6.0软件计算肌横截面积(cross sectional area,CSA)和胶原沉积面积百分比。其他样品在液氮中快速冷冻,然后在-70 ℃下储存,用作后续的分子检测。1
.3
.4
蛋白提取和Western blot检测 Western blot分析TGF-β1和HIF-1α蛋白水平。采用RIPA裂解缓冲液在冰上提取股直肌标本中的总蛋白。采用BCA蛋白检测试剂盒检测蛋白浓度。随后,在10%的聚丙烯酰胺凝胶上用SDS-PAG凝胶电泳分离每对样品的等量蛋白质,并将其电沉积到聚偏二氟乙烯膜(微孔)中。用5%脱脂牛奶溶解于TBST中室温孵育90 min后,将膜与兔抗TGF-β1(1∶2 000),兔抗HIF-1α(1∶1 000)和兔抗GAPDH多克隆抗体(1∶5 000)在4 ℃孵育过夜。第2天,在TBST溶液洗10 min,洗涤3次后,在室温下用辣根过氧化物酶偶联的山羊抗兔IgG(1∶10 000)作为二次抗体,将膜孵育40 min。每10 min用TBST清洗3次后,根据制造商说明书,用化学发光剂系统检测膜。用Image J软件定量分析各谱带密度,用GAPDH对TGF-β1和HIF-1α谱带密度进行归一化。
2 结果
2.1 挛缩ROM
在总挛缩中,各组间比较F
值=822.552,固定8周内每个固定组与前1个固定组比较,其挛缩角度随着固定时间延长逐渐增加(P
<0.001);在肌源性挛缩中,各组间比较F
值=367.736,每个固定组在前4周内的挛缩角度随着固定时间延长逐渐增加(I-1组与I-0组相比:P
<0.001;I-2组与I-1组相比:P
<0.001;I-4组与I-2组相比:P
=0.031),但固定4周后I-4组和I-8组相比,挛缩角度增加差异无统计学意义(P
=0.192)(图1和表1)。
图1 总挛缩、肌挛缩和关节动度测量仪
表1 5组新西兰兔各测量指标比较
2.2 Masson染色及定量结果
各组CSA如图2和表1所示。定量结果中,各组间比较F
值=28.911,在4周内每个固定组的股直肌横截面积相较于前一个固定组不断降低(I-1组与I-0组相比:P
<0.001;I-2组与I-1组相比:P
=0.037;I-4组与I-2组相比:P
=0.016),但在固定4周后,I-8组相比I-4组的降低差异均无统计学意义(P
=0.430);类似地,胶原纤维沉积占比在固定4周内,每个固定组相较于前一个固定组不断升高(I-1组与I-0组相比:P
<0.001;I-2组与I-1组相比:P
=0.020;I-4组与I-2组相比:P
<0.001),但固定4周后I-8组相比I-4组增加差异无统计学意义(P
=0.076),各组间比较F
值=164.266。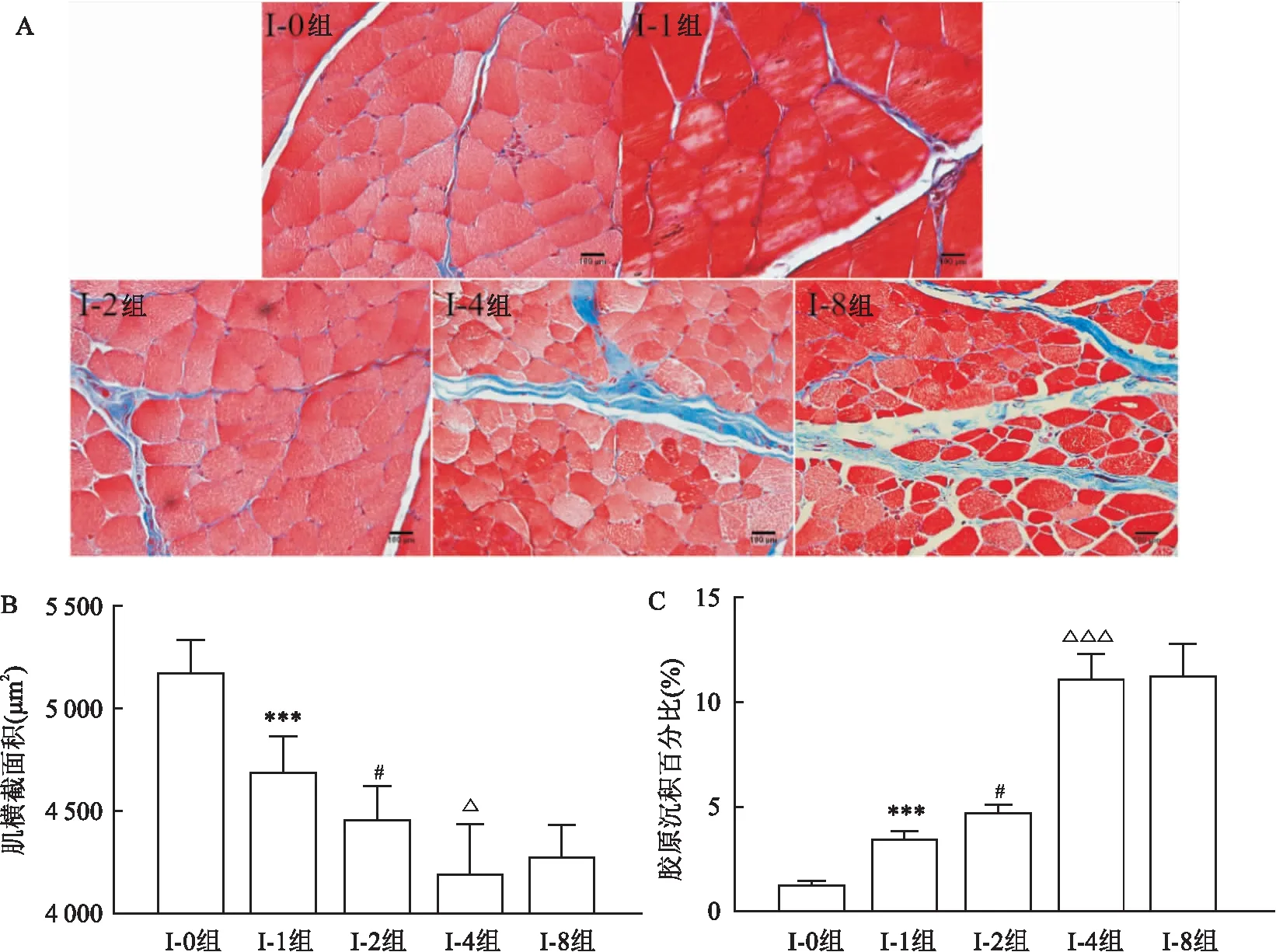
图2 Masson染色和定量结果
2.3 HIF-1α和TGF-β1的蛋白表达
在固定4周内,每个固定组的股直肌HIF-1α蛋白表达水平相较于前一个固定组不断升高(I-1组与I-0组相比:P
<0.001;I-2组与I-1组相比:P
=0.002;I-4组与I-2组相比:P
<0.001),但4周后I-4组和I-8组相比差异无统计学意义(P
=0.201),各组间比较F
值=132.491;在2周内,股直肌TGF-β1蛋白表达增加有统计学意义(I-1组与I-0组相比:P
<0.001;I-2组与I-1组相比:P
<0.001),2周后每个固定组相比差异均无统计学意义(I-4组与I-2组相比:P
=0.221;I-8组与I-4组相比:P
=0.112),各组间相比F
值=53.302(图3)。
图3 HIF-1α和TGF-β1相对于GAPDH蛋白表达结果
3 讨论
关节挛缩一旦发展至后期,目前临床措施都难以实现关节功能的较大恢复,严重限制患者的日常活动。因此,预防和治疗早期肌挛缩的发生和发展对延缓甚至逆转关节挛缩的进程极为重要。该研究通过兔膝关节伸直型挛缩模型,探讨在关节固定早期所致的肌挛缩过程中的病理特征变化及可能机制。
该研究的Masson染色显示,在固定4周之前,骨骼肌的胶原沉积随着固定时间延长不断增加,而骨骼肌的CSA随着固定时间延长不断降低,且改变差异均有统计学意义,但4周至8周的改变,差异均无统计学意义。这表明在早期肌源性挛缩的病理特征为骨骼肌纤维化和萎缩,并且这个病理特征在4周时达到稳定。有研究表明,骨骼肌的纤维化表现为肌内和肌肉结缔组织过度堆积,导致肌肉伸展性下降。在该实验中,固定所致的骨骼肌收缩减少,使得肌膜弹性降低变硬。同时,持续的关节固定导致骨骼肌细胞外基质胶原组织异常堆积,造成骨骼肌纤维化加剧,使得肌肉延展性进一步降低。此外,骨骼肌在固定后也会造成废用性肌萎缩,也会限制关节活动。因此,固定后引起的骨骼肌纤维化和废用性肌萎缩是肌源性挛缩的最主要病理特征,并且这种病理特征在早期进展迅速,后期进展缓慢。这个病理特征的变化规律对于以后选择早期干预肌挛缩的时间点提供了重要参考。
众所周知,低氧及HIF-1α的过表达是成纤维细胞向肌成纤维细胞分化和促纤维化因子TGF-β1激活的重要启动子,在众多临床纤维化疾病中都可以找到其作用机制。该实验中,兔肢体被石膏长时间固定后,血流逐渐减少,造成局部缺血,导致肌肉毛细血管数量减少,使固定侧肢体处于低氧状态。蛋白检测中固定组的HIF-1α蛋白相对于对照组都是高表达说明了制动后的骨骼肌处于低氧状态,也表明其可能是造成肌挛缩不断增加的潜在分子机制。此外,TGF-β是多功能的细胞因子,有3种亚型,其中TGF-β1与纤维化的关系最为密切。有研究表明,TGF-β1可激活成纤维细胞,使其分泌大量胶原,促进纤维化结缔组织异常堆积。并且持续的TGF-β1刺激可导致成纤维细胞合成及细胞外基质沉积的时间延长和增加,加剧挛缩的发展。该课题组在之前关节挛缩模型中表明,关节囊中的TGF-β1mRNA和蛋白表达随着固定时间延长表达增高,也表明了促纤维化因子TGF-β1在关节挛缩的发生发展中的重要作用。该研究中骨骼肌TGF-β1蛋白高表达在第2周以后进入稳定期,这和Kubo et al的研究在大鼠被固定后,骨骼肌中因子TGF-β1mRNA表达在第1周即高表达且进入稳定期的结果不完全一致,其可能是由于模型固定方法不同以及其检测的TGF-β1mRNA的表达和最终的蛋白表达并非一定相同原因所致。进一步结合HIF-1α的蛋白表达随着固定时间不断增高,并在固定4周后进入稳定期,可以推测低氧和促纤维化因子TGF-β1过表达是早期造成肌挛缩病理特征改变的潜在分子机制。
该研究通过挛缩角度变化表明,固定1周后关节活动即发生明显的受限,且总挛缩随着固定时间的发展逐渐增加;肌挛缩随着固定时间的延长也在增加,但其在4周后趋于平衡,这与一些固定诱导的关节挛缩研究结果类似。结合上述病理和蛋白分子结果显示,肌源性挛缩的发展与骨骼肌纤维化和萎缩的病理特征改变密切相关,均在固定4周后进入稳定期,而且其主要分子机制也有着类似的变化。相信这为未来干预肌源性挛缩的措施提供重要时间参考和靶点选择。

