腹泻型肠易激综合征小鼠模型的建立与评价
彭 颖,徐丽红,2
肠易激综合征(irritable bowel syndrome,IBS)是一种以腹部不适或疼痛为主要特征,并伴有大便性状及排便习惯改变的功能性胃肠道疾病。临床以腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,D-IBS)最为常见。D-IBS的病因复杂,其发病机制尚不明确,但目前有研究认为D-IBS患者存在肠道生理和内脏敏感性改变,这一改变可能与患者肠免疫功能紊乱相关。急性束缚实验诱导的束缚应激模型是经典且广泛应用于D-IBS研究中的动物模型,但既往研究多选用SD大鼠作为模型动物,朱华 等研究表明SD大鼠的免疫活性随着月龄的增加而逐渐降低,故可能在肠道免疫学研究中存在缺陷。C57BL/6J小鼠因其细胞免疫力较少随月龄增加而降低,因此,其常用于肠道免疫学研究,但目前利用C57BL/6J小鼠进行D-IBS研究的报道较少。
为开展D-IBS肠道免疫-炎症机制相关研究,该实验预利用急性束缚应激(wrap restrain stress,WRS)构建腹泻型肠易激C57BL/6J小鼠动物模型,旨在评价WRS实验诱导的C57BL/6J小鼠D-IBS模型的可行性并监测D-IBS小鼠模型中IBS症状相关指标和肠黏膜组织病理学的改变。
1 材料与方法
1.1 实验动物与分组
64只雌性健康C57BL/6J小鼠,6~8周龄,体质量16~18 g,购自北京维通利华实验动物技术有限公司,实验动物合格证号:SCXK(京),2016-0006。实验动物饲养于石河子大学医学院动物房。温度为18~25 ℃,湿度为40%,光照与黑暗时间各12 h。该实验通过石河子大学医学院第一附属医院动物实验伦理审查,批准号:A2020-165-01,将64只C57BL/6J小鼠常规饲养1周后按随机数字表法分成对照组与实验组,每组32只,共设定8个时间点,随机分组每个时间点4只小鼠。1.2 主要仪器及试剂
BX51光学显微镜(日本奥林巴斯公司)、直径3 mm钢球(江苏嘉耐特五金公司)、邻甲苯胺-冰醋酸溶液(天津市富宇精细化工有限公司)、10%中性福尔马林溶液(北京索莱宝生物科技有限公司)、苏木精染剂(上海蓝季科技发展有限公司)、伊红染剂(天津市天新精细化工开发中心)。1.3 D-IBS模型的制备
实验组参考文献采用WRS法建立D-IBS模型,用乙醚轻度麻醉小鼠,用纸胶带包裹束缚小鼠前肩、前上肢及胸背部以限制其梳理面部、上头和颈部,但不控制其活动。2~5 min内小鼠从乙醚麻醉中恢复,并可在笼子中自由走动,自由进食和饮水。每日束缚1次,每次束缚时间2 h,共持续14 d。1.4 测量指标和方法
1
.4
.1
一般情况 观察小鼠皮毛色泽、精神状态、活动度及大便性状。1
.4
.2
粪便含水量 将裁剪得当的小块滤纸放入提前预制小孔的EP管中,用千分位电子天平称量总质量,每天固定时间用滤纸刮取小鼠的新鲜粪便后装入EP管中,然后再次称量总质量,2次数值相减得到新鲜粪便质量。再将EP管置于60 ℃烘干箱中烘干24 h,称量烘干后的质量。每日测量2次,取均值作为当天粪便含水量。小鼠粪便含水量(质量%)=(新鲜粪便质量-烘干后粪便质量)/新鲜粪便质量×100%。1
.4
.3
体质量 使用千分位电子天平称量小鼠质量(g),精确到小数点后2位,每只连续称量3次,取均值作为当天质量。1
.4
.4
肠道传输功能 参照参考文献的方法,在实验前将小鼠禁食24 h,吸入七氟烷麻醉,取直径3 mm的小钢球放入小鼠距肛门1~2 cm直肠内,自小鼠苏醒后计时,记录小钢球排出时间。2组小鼠分别于实验开始前1 d,实验开始后的第2周和第4周进行肠道传输功能的测定。1
.4
.5
组织大体改变 在第2、3、4、5、6、7周末时,2组小鼠各取4只用浓度1%戊巴比妥50~60 mg/kg 腹腔注射麻醉,剖腹观察结肠外观,并测量小鼠结肠长度;再沿系膜侧剖开结肠,观察肠黏膜有无水肿、溃疡等现象。1
.4
.6
病理组织学观察 取整段剪开的结肠后冲洗干净,用10%中性福尔马林固定24 h,切片,HE染色,行组织病理学观察。
2 结果
2.1 一般情况
2组小鼠实验开始前精神活跃,毛色黑亮,饮食、饮水量正常,排便呈椭圆形。实验开始后,D-IBS组在接受束缚刺激后,易激惹,精神低下,毛色黯淡无光泽,饮食及饮水量与对照组比较均减少,粪便稀淌,整个实验过程中,未见小鼠出现肉眼血便。对照组小鼠精神和毛色较实验开始前无明显变化,饮食及饮水量随日龄增加而增长,排便正常。2.2 粪便含水量
计算2组小鼠每周粪便含水量的均值,在实验开始后第2周模型组粪便含水量达高峰,较同期对照组粪便含水量升高,差异有统计学意义(t
=-12.769,P
<0.001),实验开始后第7周模型组粪便含水量较同期对照组粪便含水量升高,差异有统计学意义(t
=-6.463,P
<0.001);实验开始后模型组小鼠粪便含水量均较实验开始前升高(F
=44.240,P
<0.001)。见图1A。2.3 体质量
计算2组小鼠每周体质量的均值,实验开始后第3周模型组小鼠体质量达最低,较同期对照组小鼠体质量降低,差异有统计学意义(t
=7.889,P
<0.001);而后模型组小鼠体质量缓慢上升,实验开始后第7周模型组小鼠体质量较同期对照组小鼠体质量降低,差异有统计学意义(t
=4.112,P
=0.006);实验开始后1、2、3、4、5、6周模型组小鼠体质量均较实验开始前减轻(F
=9.081,P
<0.001);见图1B。2.4 肠道传输功能测定
结果显示模型组小鼠在进行束缚刺激前,小钢珠排出的时间与对照组相比差异无统计学意义(t
=1.314 ,P
=0.213);在实验开始第2周(接受刺激后)排出小钢球的时间较对照组加快(t
=-11.193 ,P
<0.001);在接受束缚刺激4周后(实验开始第4周)排出小钢珠的时间与对照组相比差异无统计学意义(t
=-0.259,P
=0.800),见图1C。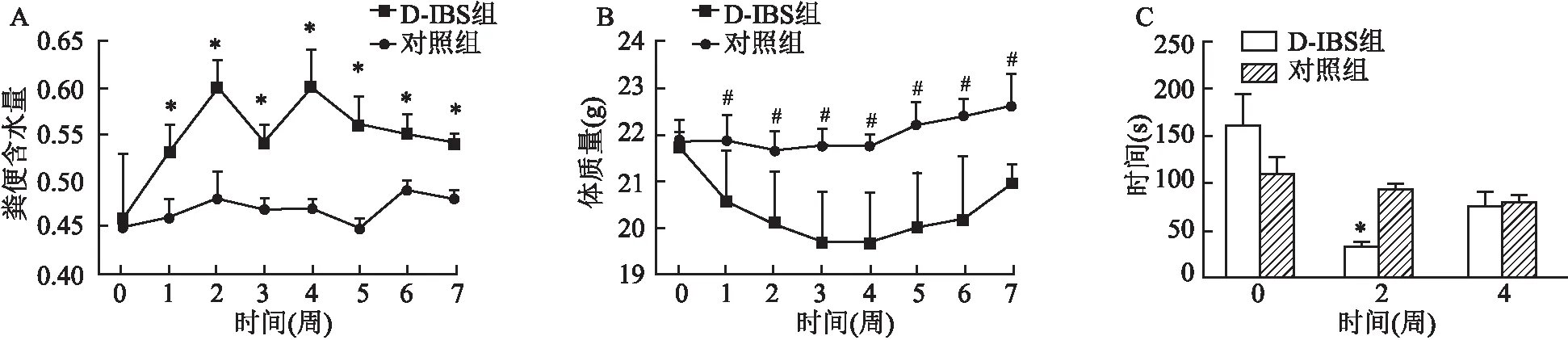
图1 D-IBS小鼠与正常小鼠粪便含水量、体质量、肠道传输功能随时间变化趋势的对比
2.5 组织学大体改变结果
模型组小鼠和对照组小鼠剖腹均可见结肠肠壁光滑,未见充血水肿,肠道组织与周围器官无粘连。取全段结肠,模型组小鼠的结肠长度[(8.23±0.6)cm]较对照组[(8.64±0.5)cm]缩短,差异有统计学意义(t
=2.707,P
=0.009)。2.6 组织病理学改变结果
光镜下观察模型组小鼠结肠表面上皮完整,腺体排列规则,未见溃疡;黏膜呈轻度慢性炎症反应,炎症主要累及黏膜固有层,炎性细胞以淋巴细胞为主;对照组小鼠结肠表面上皮完整,腺体排列规则,无溃疡;黏膜下无充血、水肿,无炎性细胞浸润。见图2。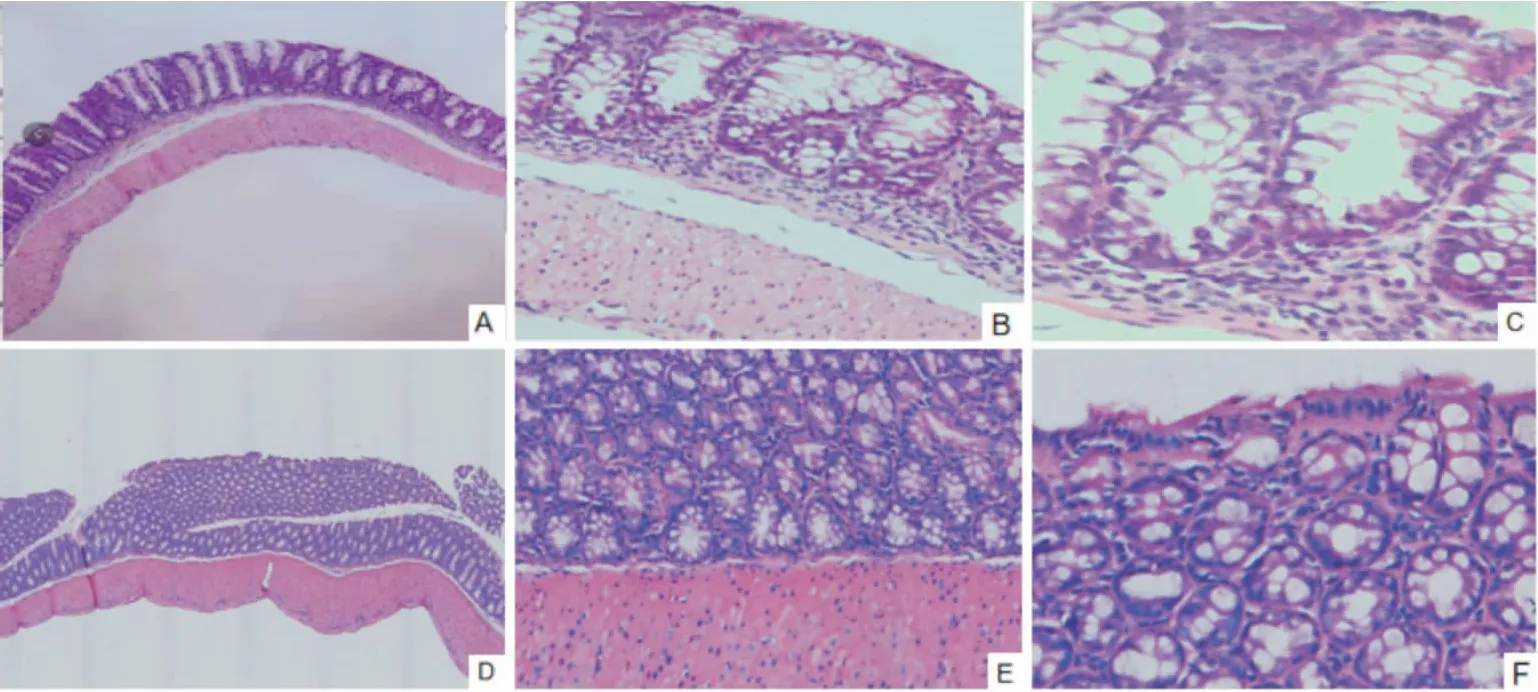
图2 模型组与对照组远端结肠组织病理学改变 HE染色
3 讨论
根据罗马Ⅳ诊断标准将IBS分为D-IBS、便秘型(constipation-predominant IBS,C-IBS)、混合型(mixed-type IBS,M-IBS)以及不定型(unsubtyped IBS,U-IBS)4种类型,其中D-IBS是IBS的主要亚型,占IBS病例的23.3%~65.0%,且患病率呈逐年上升趋势。但到目前为止,D-IBS的发病机制仍未阐明。现有研究认为,其发生发展可能与心理压力、中枢过度紧张、神经内分泌异常、胃肠道蠕动紊乱、黏膜免疫激活、肠屏障功能障碍、内脏超敏性、肠道菌群改变和遗传易感性等因素相关,近年来,越来越多的研究表明D-IBS肠道黏膜存在持续的低度炎症,推测其发生发展可能启动了免疫-炎症机制,但具体机制不详,需进一步探讨。
现有的D-IBS动物模型的制备方法主要包括应激、结直肠球囊扩张、化学药物诱导、基因敲除和寄生虫感染等,这些方法所制备的模型各有其特征和独特作用,其中应激导致的D-IBS模型因其较其他几种模型操作简便、时间短、重复性好、经济实用且最符合RomeIII标准提出的生物-社会-心理医学模式而广泛应用。应激模型包括急性应激模型、慢性应激模型、急-慢性应激模型和母婴分离模型等,其中慢性应激模型和急-慢性应激模型造模方法成本高且需要投入大量的精力;母婴分离模型虽然制作简单,但有文献指出造模结束后模型动物成年后并未出现肠道动力改变,也没有排便习惯改变及大便性状异常,故该模型具有一定局限性;WRS模型制作方法简单、模型稳定性高、模型制备时间短,能使模型小鼠产生胃肠功能亢进、内脏敏感性增高以及精神活动失调的病理表现,能较好的模拟人类D-IBS症状,且不造成模型动物肠道溃疡形成,因此,其在D-IBS的研究中被广泛应用。故该实验选用WRS实验作为动物模型制备方法。
目前,在关于D-IBS的相关研究中,大多研究选择的动物模型为SD大鼠,但有文献指出SD大鼠的免疫活性随着月龄的增加而逐渐降低,故可能不适用于肠道免疫学的研究,且有研究表明模型大鼠虽出现了粪便含水量增加,体质量减轻,肠道传输功能增加等类似人类D-IBS的症状,但其模型大鼠肠道黏膜出现了黏膜表面轻度糜烂,这与人类的D-IBS表现存在不同;而C57BL/6J小鼠因其免疫系统相对稳定,其免疫系统活性较少因月龄的增加而降低,故适宜用于肠道免疫学的相关研究。该研究预选择以C57BL/6J小鼠作为模型动物。
人类D-IBS的主要症状以腹痛、腹部不适、腹泻为主,D-IBS患者结肠黏膜上皮层及固有层淋巴细胞计数明显高于健康人群。该实验选用WRS实验诱导的C57BL/6J小鼠D-IBS模型,实验开始后模型组小鼠粪便含水量均较实验开始前升高(F
=44.240,P
<0.001),且均高于同期对照组小鼠粪便含水量(均P
<0.05);实验开始后1、2、3、4、5、6周模型组小鼠体质量均较实验开始前减轻(F
=9.081,P
<0.001),且均低于同期对照组小鼠体质量(均P
<0.05);模型组小鼠在实验开始第2周(接受束缚刺激后)排出小钢球的时间较对照组加快(t
=-11.193 ,P
<0.001);肠黏膜组织大体观察,模型小鼠结肠肠壁光滑,无充血水肿,肠道组织与周围器官无粘连,未见明显器质性病变;模型组小鼠结肠长度虽较对照组缩短,但与对照组小鼠相差不大,推测可能和小鼠体质量偏低、体型偏小有关;显微镜下病理组织学观察,表面上皮完整,腺体排列规则,无脓肿、溃疡,炎症主要累及黏膜固有层,炎性细胞以淋巴细胞为主。该实验结果提示,模型小鼠粪便含水量增加,肠道传输功能亢进,体质量减轻,肠黏膜无溃疡形成,且存在显微镜下慢性炎性改变,与人类D-IBS的临床症状和病理组织学改变极为相似,故可认为该实验模型制备成功。
