腹腔镜结肠癌根治术与开腹结肠癌根治术治疗结肠癌临床效果比较
邱福春,李 敏,魏雯鹏,王 璐
(北京世纪坛医院腹膜肿瘤外科,北京 100038)
结肠癌是一种常见的消化道恶性肿瘤,具有较高发病率,其发病率居中国恶性肿瘤第三位[1]。结肠癌发病与生活习惯、饮食、环境及遗传等多种因素存在相关[2]。治疗结肠癌常用方式为手术治疗,以往多采用传统开腹手术治疗,可对患者病变情况进行清晰观察,将病灶彻底清除,但因手术时间长、术中出血量大、术后创伤大、并发症多等原因,对患者机体伤害较大,患者治疗疗效和预后较差[3,4]。腹腔镜手术是指在全腹腔镜或腹腔镜辅助下进行病灶肠段切除和吻合口缝合等操作,具有手术创伤小、术后恢复快、并发症少等优点[5,6]。本研究探讨两种术式治疗结肠癌临床效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2015-05~2018-06我院收治的结肠癌患者98例,根据随机数表法分为腹腔镜组和开腹组,腹腔镜组49例,其中男27例,女22例,年龄28~79岁,平均年龄(56.49±6.53)岁;肿瘤部位:升结肠5例,回盲肠9例,横结肠10例,左半结肠及乙状结肠25例;病理分期:Ⅰ期14例,Ⅱ期19例,Ⅲ期16例。开腹组49例,男25例,女24例,年龄27~78岁,平均年龄(57.56±6.51)岁;肿瘤部位:升结肠4例,回盲肠11例,横结肠12例,左半结肠及乙状结肠23例;病理分期:Ⅰ期13例,Ⅱ期21例,Ⅲ期15例。两组患者年龄、性别、病情等一般资料无明显差异(P>0.05)。本研究经我院伦理委员会审核通过。
1.2 纳入排除标准
(1)纳入标准:①患者经肠镜及病理活检确诊为结肠癌恶性肿瘤;②患者术前未接受其他治疗;③患者术前接受腹部CT评估可切除病灶;④患者精神、听力、意识、沟通等方面无障碍;⑤患者及家属均知情同意且签署知情同意书;(2)排除标准:①患者既往有腹部手术史;②患者合并严重器官性疾病;③患者存在精神障碍;④患者免疫功能存在异常;⑤患者肿瘤转移或有血液系统疾病;⑥患者术前已接受放、化疗治疗;⑦患者为孕妇及哺乳期女性;⑧患者需行急诊手术治疗。
1.3 研究方法
开腹组采用传统开腹结肠癌根治术治疗,患者行全身麻醉,在腹部正中线做长约20cm切口,入腹腔后探查病灶位置、大小和腹水情况,使用纱布将患者近端肠管进行结扎,分离血管,同时清扫周围淋巴结。然后对结扎根部血管,切断肠管,将远端肠管切除。检查血运情况并冲洗腹腔,放置引流管,关腹。
腹腔镜组采用腹腔镜结肠癌根治术治疗,患者行全身麻醉,取仰卧位,呈头底脚高姿势,于肚脐部作切口,建立二氧化碳气腹,将二氧化碳输注,压力控制在12~14mmHg,于病灶处做3~4个穿刺孔,每个穿刺孔5cm左右,穿刺点位于患者左上腹与右上腹,并置入5mm的Trocar,分别将10mm的Trocor置入脐下部与下腹两侧,置入超声刀、操作钳、腹腔镜,探查腹腔内情况,观察肿瘤大小、部位及转移情况,确定肿瘤位置后于根部结扎血管,分析是否存在远处转移情况,用纱条扎紧肿瘤局部近端肠管与系膜,并用超声刀切开腹膜与肠系膜,对肠系膜血管至根部进行游离操作进行手术游离,剪开腹膜,使用超声刀自上而下将患者乙状结肠和直肠两侧系膜下淋巴结进行切除,并清除多余脂肪组织,切断结肠韧带以及半胃结肠韧带。在患者肛门处置入吻合器,对被切除肠管进行吻合。手术结束后使用生理盐水冲洗患者腹腔,并放置引流管。
1.4 疗效判定标准
显效:患者腹痛、黏液便症状消失,结肠癌症状维度问卷评分改善80%以上;有效:患者黏液便和腹痛症状减轻,结肠癌症状维度问卷评分改善50%~79%;无效:患者症状和体征无明显改善或加重。
1.5 观察指标
(1)手术相关指标:手术时间、术中出血量、淋巴结清扫数、胃肠功能恢复时间和住院时间;(2)血清肿瘤标志物水平:癌胚抗原(carcinoembryonic antigen,CEA)、糖链抗原199(Carbohydrate antigen199,CA199)和 糖链抗 原125(Carbohydrate antigen125,CA125)水平;(3)炎症因子指标:C反应蛋白(CRP)、白细胞介素-6(IL-6)和肿瘤坏死因子(TNF-α);(4)免疫功能:CD3+、CD4+、CD8+和CD4+/CD8+;(5)并发症:吻合口出血、切口感染、肠梗阻、切口疝、肺部感染。
1.6 统计学方法
使用SPSS 21.0进行统计分析。计量资料采用t检验。计数资料采用χ2检验。检验水准为α=0.05,P<0.05表示两组之间有统计学差异。
2 结果
2.1 腹腔镜组和开腹组临床疗效比较
腹腔镜组总有效率(95.91%)明显高于开腹组(77.55%)(χ2=7.244,P=0.028)(见表1)。
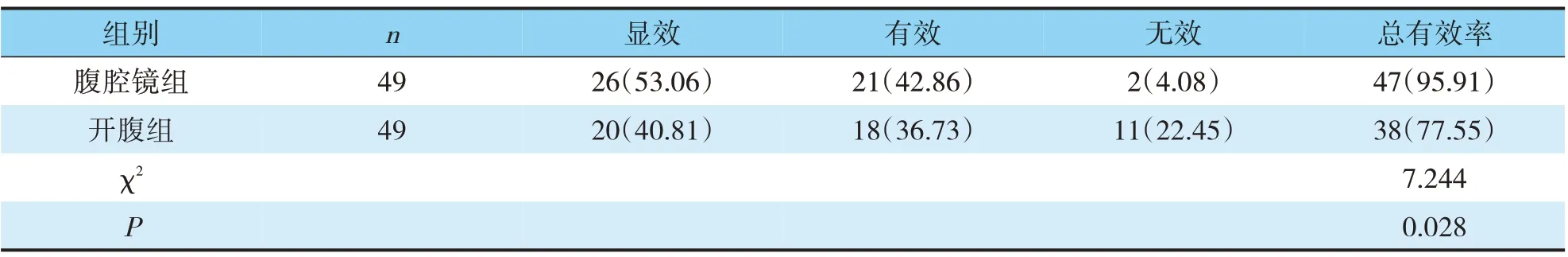
表1 两组临床疗效比较(n,%)
2.2 腹腔镜组和开腹组手术相关指标比较
腹腔镜组手术时间、术中出血量、胃肠功能恢复时间和住院时间均少于开腹组,淋巴结清扫个数多于开腹组(P<0.05)(见表2)。
表2 两组手术相关指标比较(±s)
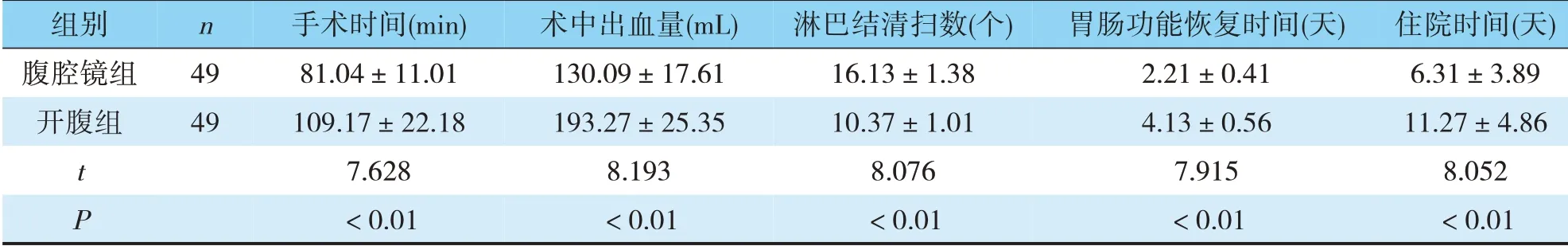
表2 两组手术相关指标比较(±s)
组别腹腔镜组开腹组n 49 49 t P手术时间(min)81.04±11.01 109.17±22.18 7.628<0.01术中出血量(mL)130.09±17.61 193.27±25.35 8.193<0.01淋巴结清扫数(个)16.13±1.38 10.37±1.01 8.076<0.01胃肠功能恢复时间(天)2.21±0.41 4.13±0.56 7.915<0.01住院时间(天)6.31±3.89 11.27±4.86 8.052<0.01
2.3 腹腔镜组和开腹组手术前后血清肿瘤标志物水平变化
手术前,腹腔镜组和开腹组患者血清肿瘤标志物水平无明显差异(P>0.05);手术后两组患者CEA、CA199和CA125水平均降低,且腹腔镜组降低程度较开腹组明显(P<0.05)(见表3)。
表3 两组手术前后血清肿瘤标志物水平比较(±s)
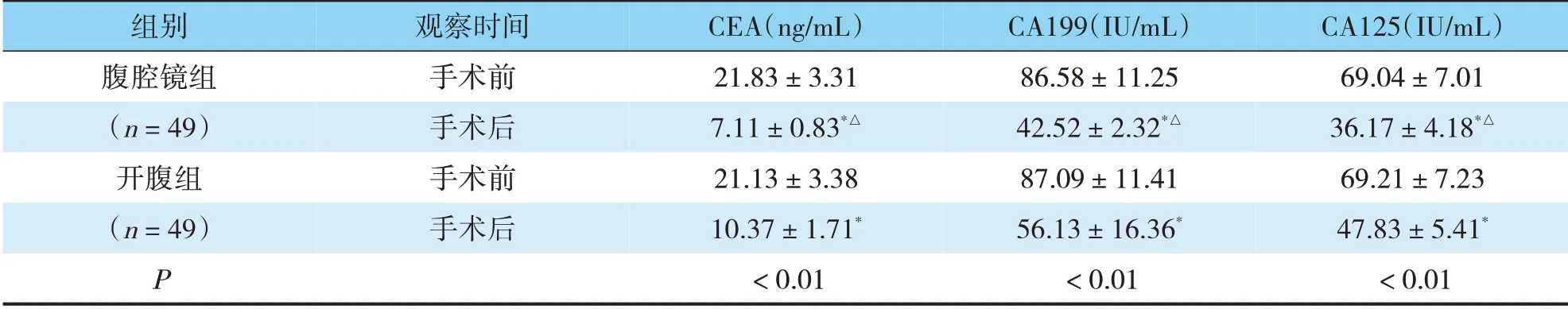
表3 两组手术前后血清肿瘤标志物水平比较(±s)
注:与手术前比较,*P<0.05;与开腹组比较,△P<0.05
组别腹腔镜组(n=49)开腹组(n=49)P观察时间手术前手术后手术前手术后CEA(ng/mL)21.83±3.31 7.11±0.83*△21.13±3.38 10.37±1.71*<0.01 CA199(IU/mL)86.58±11.25 42.52±2.32*△87.09±11.41 56.13±16.36*<0.01 CA125(IU/mL)69.04±7.01 36.17±4.18*△69.21±7.23 47.83±5.41*<0.01
2.4 腹腔镜组和开腹组手术前后炎症因子指标变化
手术前,腹腔镜组和开腹组患者炎症因子水平无明显差异(P>0.05);手术后两组患者CRP、IL-6和TNF-α水平均升高,但腹腔镜组CRP、IL-6水平低于开腹组,差异有统计学意义(P<0.05),两组术后TNF-α水平无明显差异(P>0.05)(见表4)。
表4 两组手术前后炎症因子指标比较(±s)
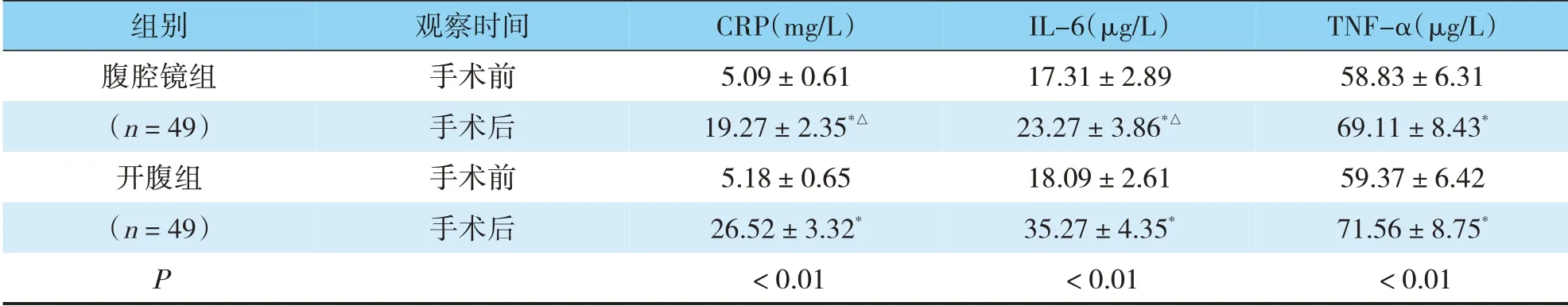
表4 两组手术前后炎症因子指标比较(±s)
注:与手术前比较,*P<0.05;与开腹组比较,△P<0.05
TNF-α(μg/L)58.83±6.31 69.11±8.43*59.37±6.42 71.56±8.75*<0.01组别腹腔镜组(n=49)开腹组(n=49)P观察时间手术前手术后手术前手术后CRP(mg/L)5.09±0.61 19.27±2.35*△5.18±0.65 26.52±3.32*<0.01 IL-6(μg/L)17.31±2.89 23.27±3.86*△18.09±2.61 35.27±4.35*<0.01
2.5 腹腔镜组和开腹组手术前后免疫功能变化
手术前,腹腔镜组和开腹组患者免疫功能指标水平无明显差异(P>0.05);手术后,两组患者CD3+、CD4+和CD4+/CD8+水平均下降,CD8+水平均升高,腹腔镜组CD3+、CD4+和CD4+/CD8+水平高于开腹组,CD8+水平低于开腹组(P<0.05)(见表5)。
表5 两组手术前后免疫功能指标比较(±s)
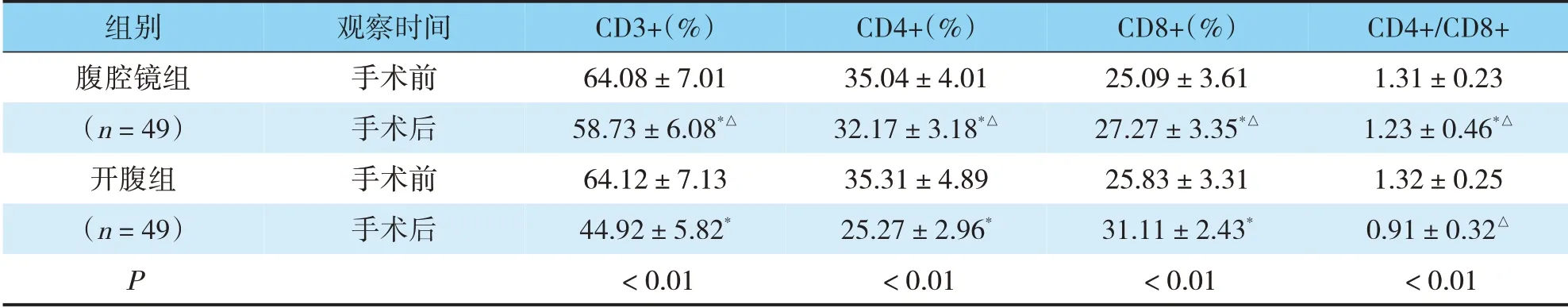
表5 两组手术前后免疫功能指标比较(±s)
注:与手术前比较,*P<0.05;与开腹组比较,△P<0.05
CD4+/CD8+1.31±0.23 1.23±0.46*△1.32±0.25 0.91±0.32△<0.01组别腹腔镜组(n=49)开腹组(n=49)P观察时间手术前手术后手术前手术后CD3+(%)64.08±7.01 58.73±6.08*△64.12±7.13 44.92±5.82*<0.01 CD4+(%)35.04±4.01 32.17±3.18*△35.31±4.89 25.27±2.96*<0.01 CD8+(%)25.09±3.61 27.27±3.35*△25.83±3.31 31.11±2.43*<0.01
2.6 腹腔镜组和开腹组术后并发症比较
腹腔镜组发生3例不良反应,开腹组发生14例不良反应,腹腔镜组并发症发生率(6.12%)明显少于开腹组(28.57%)(χ2=8.611,P=0.003)(见表6)。
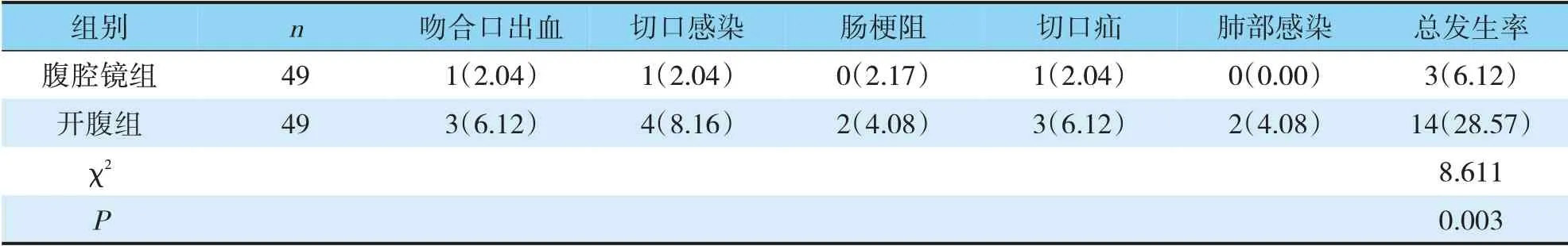
表6 两组术后并发症发生率比较(n,%)
3 讨论
结肠癌死亡率在我国恶性肿瘤中居第三位,仅次于肝癌和肺癌,早期治疗五年生存率高于90%,晚期生存率明显降低[7]。近年来人们生活水平不断提高,居住环境和生活方式等均出现明显变化,结肠癌发病率也随之增加[8]。结肠癌发病机制较为复杂,发病原因尚未明确,但结肠癌是一个多步骤、多基因参与的细胞遗传性疾病,多数学者认为其发病与饮食习惯、胃肠蠕动速度降低、摄入毒素、基因等因素有关,临床表现为贫血、便秘、便血、肠梗阻等,结肠癌患者早期往往无特异性表现,当发现时往往已发展至中晚期,伴随肿瘤转移现象,容易引发肝、肺等器官病变,严重威胁患者生命[9~11]。治疗结肠癌方法有手术治疗、放化疗治疗、免疫治疗等,目前临床上对中晚期结肠癌患者常采用手术治疗,结肠癌手术治疗的原则为尽量根治,保护盆腔植物神经,保存性功能、排尿功能和排尿功能,提高其生存质量。手术方式多采用传统开腹手术和腹腔镜手术[12]。
传统开腹手术是一种常用操作方法,对患者左下腹部行切口操作,使病变充分暴露,将病灶切除,其手术时间长、术中出血量大,术后恢复慢,并发症发生率高,导致患者住院时间延长[13]。且患者多为老年人,手术耐受性不如青壮年,严重影响患者生活质量,传统开腹手术所需切除范围广,对机体伤害大,可能会进一步增加对机体创伤,给患者带来巨大痛苦的同时,也影响患者预后恢复[14]。
Jacobs等[15]于1991年首次将腹腔镜技术应用于结肠手术,此后腹腔镜技术不断完善,腹腔镜结肠癌根治术逐渐应用于结肠癌中,在腹腔镜帮助下,有利于医师辨认目标区域解剖结构,对病灶状况、周边粘连表现等进行直观辨认,从而准确进行组织分离,有助于减小对周边组织、胃肠道紫铜的干扰。在行腹腔镜结肠癌根治术中,腹腔镜可通过电视放大系统,准确沿直肠周围间隙进行解剖,同时使用超声刀锐性解剖,遵循“整块切除原则”,对肿瘤深层进行分离,在采用超声刀对病灶切除过程中,通过对肠系膜、腹腔、韧带等组织有效止血,最大程度加您少了术中出血量,且术中操作精确度更高,借助腹腔镜放大作用可彻底清除淋巴结,减少了手术切口和病灶转移的风险,对病灶周围健康组织影响小,可更好地保护重要组织器官,避免术后各类并发症发生,提高治疗安全性。腹腔镜手术要求操作者准确把握手术切口的位置和长度,并熟练掌握结肠癌分期和大小,保证手术视野清晰,减少对其他器官损害。故在术中应根据肿瘤范围、浸润度、分化程度、生物学特征等进行综合判断。
腹腔镜下结直肠癌根治性切除术能够准确结扎肿瘤血管,其对肿瘤切除可达到和开腹手术相同的程度。在对患者行腹腔镜手术时,因为需要建立人工气腹,如二氧化碳气腹处理不善,可能导致其发生皮下气肿、深静脉血栓以及心血管系统并发症,若气腹针、套管针误伤其肠管组织,可能导致切口处或穿刺点出现肿瘤转移,故在手术时需尽量减少手术器械进出次数,避免手术器械接触和挤压肿瘤。当手术完成时,应加强处理二氧化碳气腹,以确保患者术后尽快康复,保证治疗有效性和安全性。此外,在行腹腔镜结肠癌根治术中,腹腔镜下游离尤为关键,必须准确明确游离范围,可将肠管切缘作为标志,便于游离操作显露和提拉,同时保证游离侧鞥磁性,对十二指肠、性腺血管和输尿管进行有效保护,并做好术后止血工作。手术所导致的应激反应会造成术后机体免疫功能抑制,其抑制程度与手术创伤、出血量等因素存在密切相关。腹腔镜手术虽然是微创手术,可在一定程度上维持机体内环境稳定,但仍会对机体免疫功能产生一定影响。
本次研究结果显示,腹腔镜组总有效率明显高于开腹组,腹腔镜组手术相关指标优于开腹组,表明腹腔镜结肠癌根治术临床疗效较常规开腹术好,且可有效缩短手术时间,减少患者创伤程度,手术后腹腔镜组患者CEA、CA199和CA125水平低于开腹组,提示腹腔镜结肠癌根治术可改善患者血清肿瘤标志物水平,腹腔镜组CD3+、CD4+和CD4+/CD8+水平高于开腹组,CD8+水平低于开腹组,提示两种手术应激均可造成外周血淋巴细胞总数下降,抑制免疫细胞的活性,腹腔镜结肠癌根治术可更好改善患者机体免疫功能,且术后并发症较少,可能与腹腔镜是微创手术,可扩大手术视野进行精细化操作,同时暴露面积和感染风险降低,对患者不良影响较轻,此结果与刘忠伟、李松伟等研究具有一致性。
综上所述,相比于传统开腹手术,腹腔镜结肠癌根治术疗效更加显著,可缩短手术时间和术中出血量,减轻患者炎症反应,改善患者免疫功能,且术后并发症较少,值得临床进一步推广。

