沙棘总酚酸对胃癌细胞MGC-803增殖、迁移和细胞周期的影响
赵 阳,王海生
(内蒙古医科大学,内蒙古 呼和浩特 010059)
沙棘是一种落叶性灌木,属胡颓子科,又名为黑刺、醋柳、酸棘。它是一种耐旱耐寒植物[1]。我国是世界上沙棘种植面积最大,品种最多的国家,在我国主要分布在华北,西北等地区[2]。沙棘不仅有水土保持的作用,而且具有很高的药用价值。沙棘是一种药食两用植物,它含有许多生物活性物质,包括维生素、不饱和脂肪酸、酚类化合物、类黄酮等[3]。其主要活性成分是酚酸类化合物,其中总酚酸在抗炎、抗肿瘤、抗氧化、抗衰老等方面效果显著[4]。
胃癌是世界上最常见的恶性肿瘤之一,其发病率在全球范围排第四[5]。胃癌是导致全球癌症相关死亡的主要原因,亦是我国癌症死亡的主要原因之一[6~8]。目前,胃癌的治疗方法主要包括手术和化疗[9,10],但效果往往不甚理想。因此寻找一种能够有效治疗或者控制胃癌并改善患者预后的药物,具有重要意义。经查阅文献发现,对于沙棘总酚酸治疗胃癌的研究目前尚未见报道。因此本研究通过观察沙棘总酚酸对胃癌细胞生物学行为的影响,尝试探索其对胃癌的作用及机制,从而为沙棘的实验研究提供线索和依据。
1 材料与方法
1.1 沙棘总酚酸的提取
准确称量沙棘果1g,捣碎后加入25mL70%乙醇,加热回流1h,冷却,过滤,之后再加入30mL70%的乙醇,重复以上步骤,最后收集在100 mL量瓶中,用相同体积分数的乙醇清洗残留后收集,再加一定量的70%的乙醇达到100mL,混合均匀,测定含量。
1.2 细胞
MGC-803细胞由内蒙古医科大学实验室提供
1.3 主要试剂
胎牛血清、RPMI-1640、青链霉素混合液、胰蛋白酶(含酚红和0.25%EDTA)购自美国Gibco公司,CCK-8试剂盒购自日本同仁化学研究所,4%多聚甲醛、结晶紫购自北京Solarbio公司,transwell小室购自美国corning公司,DNA含量检测试剂盒(细胞周期),总RNA提取试剂盒购自北京天根,反转录试剂盒购自大连宝生物,qPCR试剂盒购自日本toyobo。
1.4 主要仪器
超净工作台(美国Thermo),恒温水浴锅(金坛市杰瑞尔电器有限公司),CO2培养箱(美国Thermo),低速冷冻离心机(安徽中科中佳),倒置显微镜(德国Leica),流式细胞仪(美国beckman),酶标仪(美国perkin elmer),荧光定量PCR仪(美国ThermoPikoReal)。
2 方法
2.1 CCK-8方法
取对数生长期的MGC-803细胞消化重悬为3×104个/mL,分别在三个96孔板均匀加入100μL,设空白调零组,阴性对照组和沙棘酚酸给药组(1mg/mL、2mg/mL、3mg/mL、4mg/mL、5mg/mL、6mg/mL),培养24h,48h,72h后,弃掉旧培养基,各孔中加入含10μLCCK8的培养基,之后将96孔板放入培养箱内,3.5h后用酶标仪测定波长450nm处的吸光度值,计算IC50值。细胞抑制率=[(阴性对照组平均OD值-实验组平均OD值)/(阴性对照组平均OD值-空白调零组平均OD值)]×100%。
2.2 Transwell实验法
将对数生长期的MGC-803胃癌细胞调整密度为1X10^6个/mL,上室内200μL细胞悬液,10%血清培养基500μL加入下室,48h后吸去小室的培养基,棉签轻轻擦拭小室内部,4%的多聚甲醛固定,之后用0.1%结晶紫染色,洗去多余结晶紫,随机选取10个高倍视野(200倍镜)计数迁移细胞数。
2.3 流式细胞术
取对数生长期的MGC-803胃癌细胞设置阴性对照组,沙棘酚酸给药组(2mg/mL、3mg/mL、4mg/mL),培养48h后,用PBS洗两次,消化离心后弃上清液,用预冷PBS重悬细胞,调整细胞浓度为1X10^6个/mL,加500μL预冷的70%酒精,4℃冰箱固定过夜。次日离心5min,弃上清,加入100μLRNase A,放入37℃恒温培养箱,30min后加入400μL PI荧光染料混匀,在4℃冰箱避光放置30min,流式细胞仪检测。
2.4 qRT-PCR技术
TRIzol法提取总RNA,性质稳定的cDNA由RNA逆转录试剂盒逆转录。qRT-PCR检测目的基因相对GAPDH表达水平。反应条件设定如下:预变性95℃,30s;变性95℃,5s;退火55℃,10s;延伸72℃,15s;40个循环;融解曲线55℃~95℃。引物序列(见表1)。

表1 引物序列Tab.1 Primer sequence

2.5 统计学方法
应用SPSS 25.0统计软件分析数据,计量资料符合正态分布,以表示,两组间比较采用独立样本t检验,检验水准为α=0.05,以P<0.05为差异具有统计学意义。
3 结果
3.1 沙棘酚酸对胃癌细胞增殖能力的影响
CCK-8结果显示,不同浓度的沙棘酚酸分别处理胃癌MGC-803细胞24h、48h、72h后,与对照组相比,处理组的MGC-803细胞增殖受到明显抑制作用,并且抑制效果呈时间-剂量依赖性。不同浓度沙棘酚酸组作用于72h时,与对照组比较,5mg/mL和6mg/mL沙棘酚酸组差异具有统计学意义,细胞生长被显著抑制。经GraphPad Prism 6软件计算,沙棘酚酸作用细胞24h、48h、72h的IC50值分别为4.893mg/mL、4.311mg/mL、4.106mg/mL(见图1)。考虑到IC50值及细胞毒性作用,选用2mg/mL、3mg/mL、4mg/mL进行后续实验。
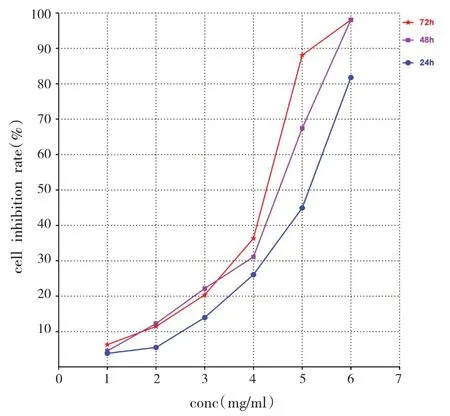
图1 沙棘总酚酸对MGC-803细胞抑制率的影响Fig.1 Effect of total phenolic acid of sea-buckthorn on inhibition rate of MGC-803 cells
3.2 沙棘酚酸对胃癌细胞迁移能力的影响
transwell实验结果显示,沙棘酚酸作用胃癌MGC-803细胞48h后,与对照组相比,三个处理组穿膜细胞数明显减少,差异具有统计学意义(P<0.05),且沙棘酚酸对MGC-803细胞迁移能力的抑制作用呈浓度依赖性(见图2)。
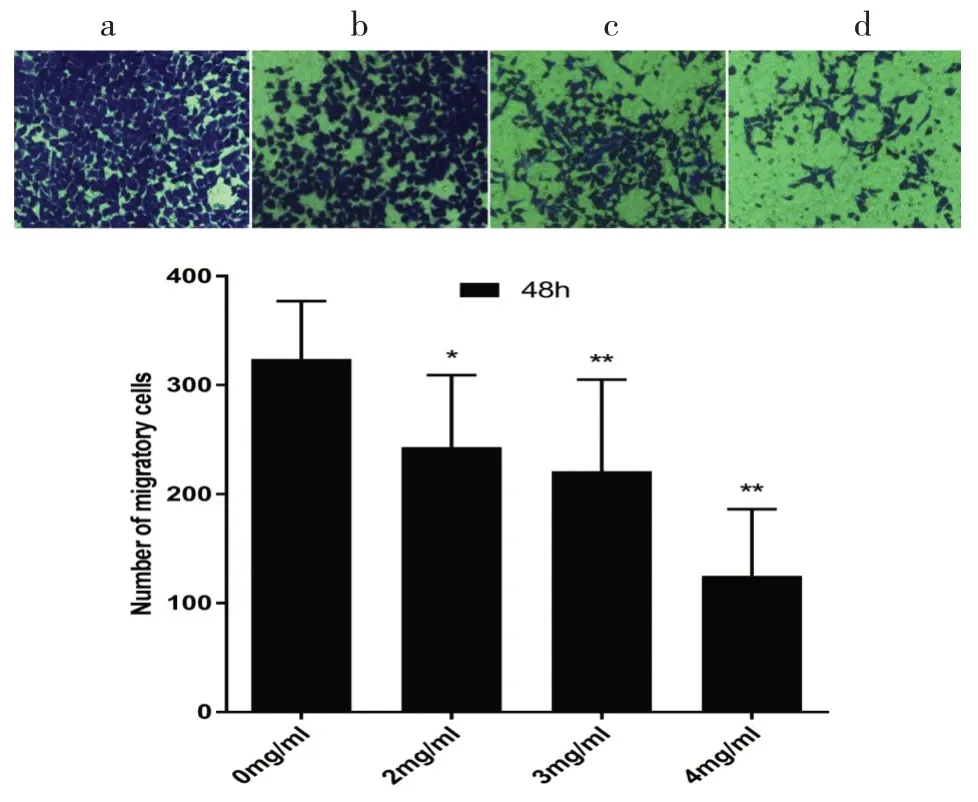
图2 Transwell小室中细胞结晶紫染色图(x200)以及细胞迁移数的柱状图:a表示0mg/mL;b表示2mg/mL;c表示3mg/mL;d表示4mg/mLFig.2 Crystal violet staining of cells in Transwell chamber(X200)and the histogramof cell migration number:a 0mg/mL;b 2mg/mL;c 3mg/mL;d 4 mg/mL
3.3 沙棘酚酸对胃癌细胞周期的影响
沙棘酚酸作用胃癌MGC-803细胞48h后,与对照组相比,三个处理组G0/G1期和S期的细胞比例显著降低,而G2/M期的细胞比例显著升高,差异均具有统计学意义(P<0.05),且沙棘酚酸对MGC-803细胞周期的抑制作用呈浓度依赖性。结果表明,沙棘酚酸对胃癌MGC-803细胞的的周期有显著抑制作用,能将其阻滞于G2/M期(见图3、4)。
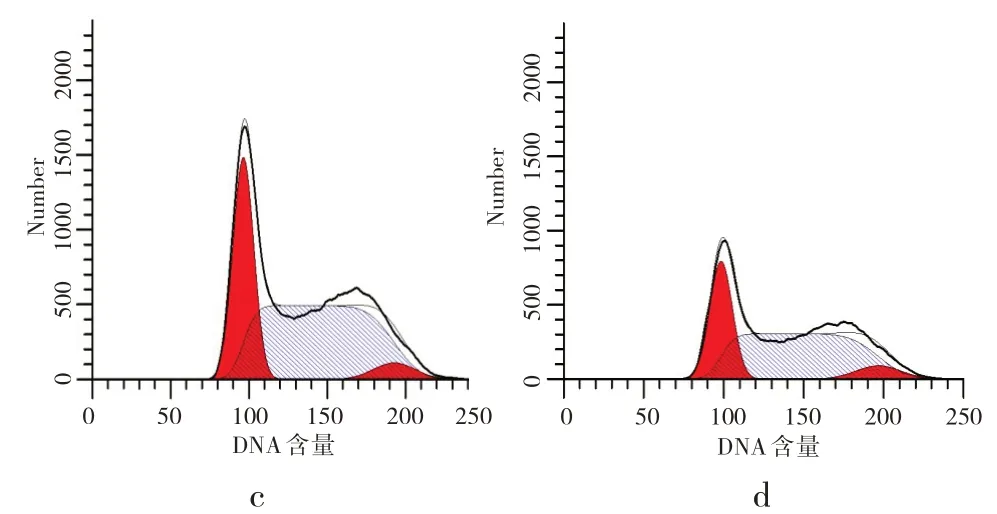
图3 沙棘总酚酸对细胞各周期影响的流式直方图:a表示0mg/mL;b表示2mg/mL;c表示3mg/mL;d表示4mg/mLFig.3 Flow histogram of the influence of total phenolic acid of seabuckthorn on each cell cycle:a 0mg/mL;b 2mg/mL;c 3 mg/mL;d 4 mg/mL
3.4 qRT-PCR结果显示
沙棘酚酸作用胃癌MGC-803细胞48h,各目的基 因的2-ΔΔCT值 分 别为E-cadherin(0.42±0.05)、Gsk-3β(0.10±0.01)、SFRP(5.78±0.37),与对照组比较,SFRP是对照组的(5.78±0.37)倍,SFRP基因被上调,差异具有统计学意义,E-cadherin和Gsk-3β基因表达下调,差异具有统计学意义(见图5)。
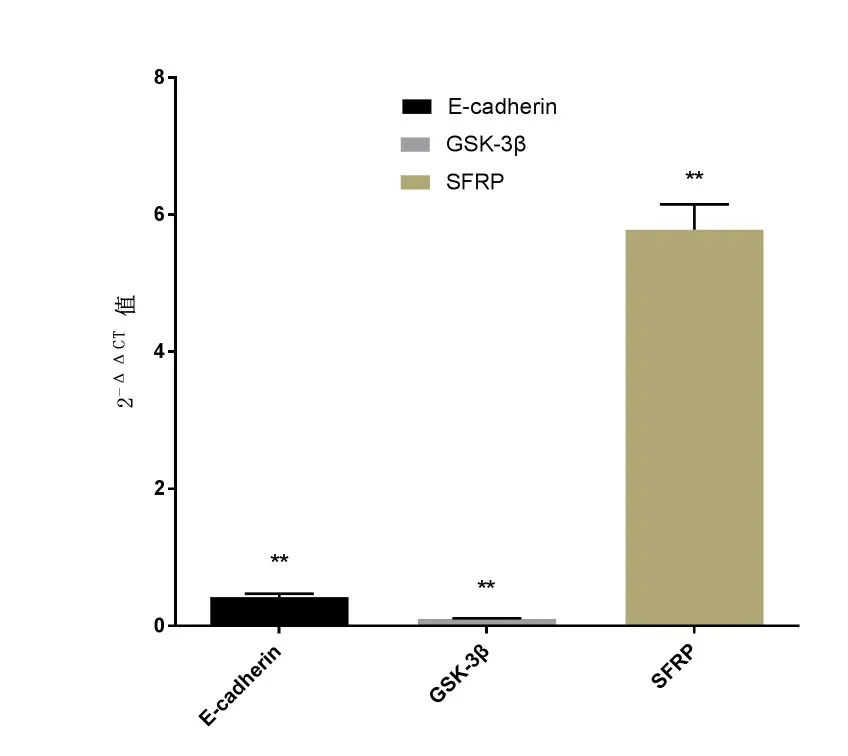
图5 加药前后各目的基因的2-ΔΔCT值柱状图Fig.5 The purpose gene 2-before and after the dosingΔΔCT value histogram
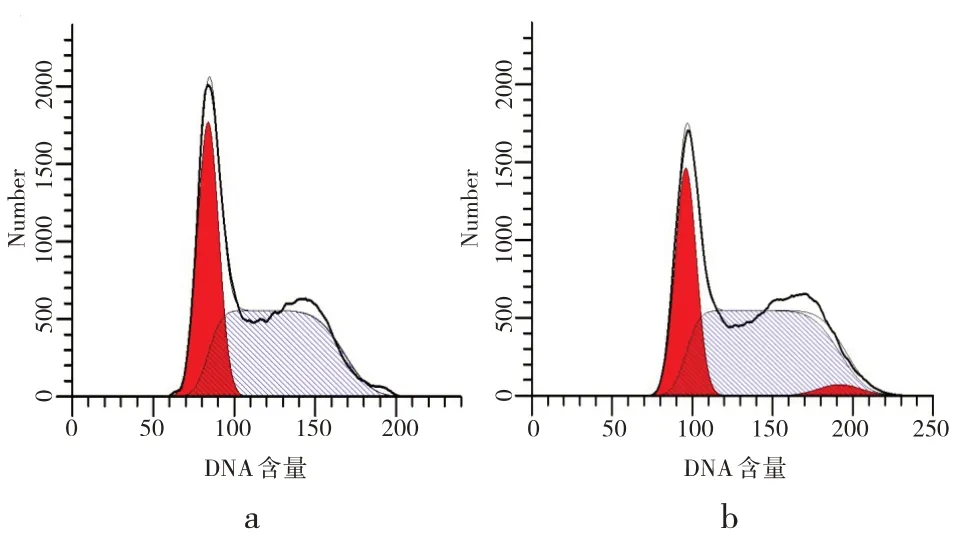

图4 不同浓度沙棘总酚酸对胃癌细胞MGC-803各周期的影响Fig.4 Effects of different concentrations of seabuckthorn total phenolic acid on each cycle of MGC-803 in gastric cancer cells
表2 不同组中各目的基因的相对表达量(±s)Tab.2 Relative expression levels of each target gene in different groups(±s)
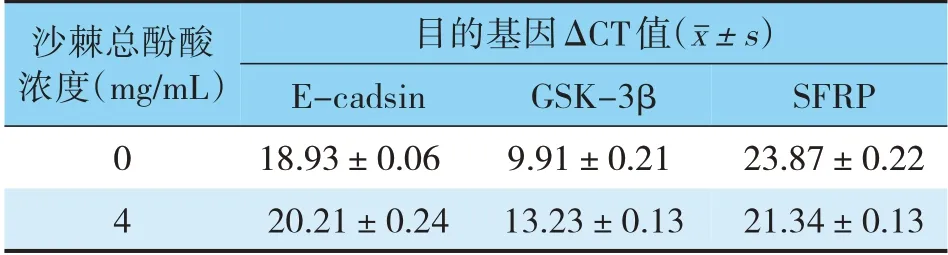
表2 不同组中各目的基因的相对表达量(±s)Tab.2 Relative expression levels of each target gene in different groups(±s)
沙棘总酚酸浓度(mg/mL)目的基因ΔCT值(images/BZ_18_570_715_591_745.png±s)E-cadsin 18.93±0.06 20.21±0.24 0 4 GSK-3β 9.91±0.21 13.23±0.13 SFRP 23.87±0.22 21.34±0.13
4 讨论
胃癌是一种发病率高,死亡率高的恶性疾病[11]。目前临床治疗以手术结合化疗为主,副作用大,效果有限[12,13]。随着中草药抗肿瘤作用的深入研究,发现部分中草药中的活性成分对肿瘤具有很好的抑制作用,对抗肿瘤药物的研究具有重要价值。总酚酸作为沙棘中一种有效的抗肿瘤活性成分,现有文献中对其抗肿瘤研究相对较少,因此本研究通过观察沙棘总酚酸对Wnt/β-catenin的异常激活是已知的人类癌症中常见的异常信号调节通路,因此,有必要探索该信号通路中的靶位点并寻找相应的有效作用物,以抑制癌细胞中Wnt通路的异常活化,从而为癌症治疗提供一种可能。Wnt/β-catenin信号传导途径是一类传导生长刺激信号的通路,由细胞外的Wnt蛋白、膜受体Frizzled、胞质内的β-catenin及下游的转录因子组成[14]。βcatenin可与E-cadherin胞内区结合形成P-catenin/E-cadherin复合体,再与肌动蛋白骨架相连,减弱细胞间黏附,诱导肿瘤的EMT过程从而增强肿瘤细胞的侵袭和转移能力[15]。GSK-3β通过抑制βcatenin蛋白来抑制癌细胞的增殖。SFRP属于分泌型糖蛋白,与Wnt结合,从而竞争性抑制Wnt与Frz/LRP受体结合,而阻遏信号通路的传导。
细胞周期失调与肿瘤细胞的发生发展密切相关[16],细胞周期由四个有序和严密的调控阶段组成(称为G1、S、G2和M)。DNA合成(S期)是两个子细胞的分离,M期是主要的细胞周期进展,S期之前的周期是G1期,为这些细胞准备DNA合成。正常的细胞周期如果失去调控,则会导致肿瘤细胞无限增殖[17,18]。
本研究以人胃癌MGC-803细胞为研究对象,检测并研究沙棘酚酸对胃癌细胞增殖,迁移和周期的影响及机制,为沙棘酚酸抗肿瘤提供实验依据。增殖实验结果显示,沙棘酚酸作用于胃癌MGC-803,随着沙棘酚酸浓度的升高,MGC-803细胞的增殖能力逐渐减弱,说明沙棘酚酸对于MGC-803细胞的生长具有抑制作用。细胞周期实验结果显示,沙棘酚酸将胃癌细胞阻滞在G2/M期。说明沙棘酚酸对胃癌MGC-803细胞的周期具有抑制作用。迁移实验结果显示沙棘酚酸抑制胃癌MGC-803的迁移并呈浓度依赖性,为了探讨可能的机制,本研究测定了相关基因E-cadherin、GSK-3β和SFRP的表达情况,发现沙棘酚酸下调E-cadherin、GSK-3β,上调SFRP。
综上所述,沙棘酚酸在胃癌中具有抗肿瘤效应,能够抑制胃癌MGC-803细胞增殖且呈浓度依赖性,沙棘酚酸还可以抑制胃癌细胞的迁移运动,并阻滞细胞周期在G2/M期,调节Wnt/β-catenin信号通路相关基因的表达。沙棘酚酸安全性高,且可有效抑制胃癌细胞生长,可为将来临床治疗胃癌,尤其是进展期胃癌及化疗药物效果不好的患者提供新的治疗方向。

