人羊膜间充质干细胞改善高龄小鼠睾丸功能的实验研究
张月鑫,刘菡文,施陈楠,宁松,周静,李楚玉,杨晓玉,覃莲菊,刘嘉茵,胡艳秋,崔毓桂
中老年男性雄激素水平降低,发生类似女性围绝经期的临床表现,尤其以性功能下降显著,生育力也随年龄而减退[1]。对于女性,生育力随年龄增大而衰退,以围绝经期闭经结束;而对于男性,生育力减退是一个渐进的过程,生育力不会完全丧失[2]。中老年男性生育力减退主要表现为睾丸组织形态学改变、雄激素合成功能降低、精子参数异常和精子DNA碎片化增多等[3-5]。研究发现,中老年男性生育力减退与其配偶的低妊娠率和高流产率有关[6]。显然,延缓睾丸老化并非补充外源性雄激素那样简单,如何修复中老年睾丸的精子发生和雄激素合成的功能,是当前男性生殖内分泌领域的难题,干细胞治疗已然成为研究热点之一。人羊膜间充质干细胞(human amnion mesenchymal stem cells,hAMSC)是一类具有自我更新和多能性的特殊细胞,具有免疫原性低,易于获得,能分泌大量细胞因子等特点[7]。已有研究证实,间充质干细胞能够治疗细胞损伤,修复老化细胞;骨髓、脐带、脂肪、胎盘等多种来源的间充质干细胞移植,能够改善男性不育[8]。有关羊膜间充质干细胞能否延缓中老年男性睾丸功能减退的研究非常少,特别需要更多实验研究结果的支持。本研究使用hAMSC治疗自然高龄的雄性小鼠,观察治疗前后血清睾酮水平变化、精子质量、睾丸组织学改变以及雄激素合成功能的变化,为hAMSC后期应用于中老年男性睾丸功能减退治疗提供科学依据。
1 材料与方法
1.1 试剂迪夫快速染色液购于珠海贝索生物公司,蛋白裂解液及SDS-PAGE凝胶配制试剂盒、BCA蛋白浓度测定试剂盒、封闭用山羊血清购于碧云天公司,蛋白酶抑制剂购于赛默飞公司,特超敏ECL显影液购自UE公司,含DAPI封片液购自SBA公司,鼠抗人STEM121单克隆抗体购自宝日医公司,兔抗人CD105单克隆抗体、鼠抗鼠类固醇激素生成急性调节蛋白(StAR)多克隆抗体购自艾博抗公司,鼠抗鼠17β-羟基类固醇脱氢酶(17β-HSD)单克隆抗体购自圣克鲁斯公司。
1.2 实验动物10周龄体质量25 g左右和32周龄体质量35 g左右C57BL/6J雄鼠购于维通利华公司,饲养于南京医科大学SPF级动物房中,光照12 h,自由饮食。10周龄小鼠,相当于人20岁左右,作为年轻对照组。购买动物中心育种淘汰的雄性种鼠,年龄为32周龄雄性小鼠,经历1周适应性饲养和3周延长期培养达到36周龄(9个月,生育力显著降低),相当于人男性50岁以上,作为雄鼠生育年龄“高龄”的模型。
1.3 hAMSC的鉴定和质量控制hAMSC细胞的制备参考本中心之前的研究[9]。流式细胞术进行细胞表面分子标志物的鉴定。检测基因包括血管细胞相关标志物(CD11b、CD19、CD34、CD45)、间充质干细胞表面标志物(CD44、CD73、CD90、CD105)和免疫排斥相关的表面标志(HLA-DP/DQ/DR)。台盼蓝染色法进行细胞活力鉴定。
1.4 hAMSC细胞运输和治疗过程31只36周龄雄鼠随机分为5组,分别为生理盐水对照组、1%人血清白蛋白对照组、3.4×106hAMSC细胞/kg治疗组(低剂量组)、6.7×106hAMSC细胞/kg治疗组(中剂量组)、1.4×107hAMSC细胞/kg治疗组(高剂量组),其中生理盐水对照组3只,其余各组每组7只。hAMSC细胞以1%人血清白蛋白的生理盐水制成混悬液,细胞浓度分别为4.2×105/mL、8×105/mL和17×105/mL,分装于1.5 mL的EP管中,使用37℃恒温手提式温箱运输至南京医科大学动物房进行细胞注射。注射体积300μL;细胞注射结束,再用15μL生理盐水冲洗注射管,使细胞全部进入小鼠体内。每周注射1次,共注射4次。治疗结束后,继续饲养5周(相当于1个生精周期)后处死,此时小鼠为44周龄。称量小鼠体质量,眦内采血1 mL。处死小鼠,双侧睾丸称重,一侧固定于布氏液中,另一侧液氮中冻存;睾丸周围脂肪组织称重。
1.5 血清睾酮水平测定血液样本1 500×g离心15 min,吸取上层血清,-80℃保存。使用Unicel Dxl 800 Access免疫分析仪检测血清睾酮水平。
1.6 精子活动率评估鉴于目前本研究实验室尚没有小鼠精子分析的专用CASA仪,为避免人为因素干扰,采取2人相互盲法评估小鼠精子活率。小鼠处死后立即取一侧附睾,置于预热的1 mL M2培养液中,体视镜下用注射器划开附睾,37℃孵育30 min使精子充分游离,收集精子悬液。充分混匀精子悬液,吸取10μL于计数板上,覆盖盖玻片,用×400倍的相差显微镜观察精子运动。
1.7 精子计数精子悬液于4℃冰箱中过夜,待精子活动度降低后进行精子计数。充分混匀精子悬液,吸取10μL于红宝石精子计数板上,覆盖盖玻片,用×200倍的相差显微镜计数100个小方格中的精子总数,再计算1 mL精子悬液中的精子数目。
1.8 精子形态学评估充分混匀精子悬液,吸取10μL于干净载玻片上,采用迪夫快速染色液进行染色,×1 000倍油镜下观察。在每张重复涂片至少评估200个精子,记录正常和异常的精子数目。
1.9 睾丸组织免疫荧光睾丸组织经脱水,透明,浸蜡后常规包埋,4μm切片。常规脱蜡后,经柠檬酸抗原修复液进行抗原修复。切片经山羊血清封闭后孵育一抗STEM121(1∶100),CD105(1∶100),将切片置于湿盒中于4℃冰箱中过夜孵育。磷酸盐缓冲液(PBS)清洗3遍,室温孵育荧光标记的二抗2 h,PBS清洗3遍后使用含DAPI的封片液封片,荧光显微镜下观察。
1.10 睾丸组织病理学观察睾丸组织经脱水,透明,浸蜡后常规包埋,4μm切片。常规脱蜡后,HE染色,显微镜下观察。每张切片随机选择30个生精小管,使用ImageJ软件进行生精小管直径及生精小管细胞层数的测量和计数。
1.11 蛋白质印迹(Western blotting)法检测StAR和17β-HSD蛋白表达水平取小鼠睾丸组织20 mg左右,加入200 μL蛋白裂解液,液氮研磨提取总蛋白。BCA法测定蛋白浓度。蛋白经电泳、转膜、封闭后,孵育抗StAR、抗17β-HSD抗体(1∶1 000)并于4℃过夜,二抗(1∶2 000)室温孵育2 h,ECL法显色,ImageJ软件分析目的条带的相对表达。
1.12 统计学方法每个实验至少3个样本、3次重复。使用GraphPad Prism7.04统计软件分析数据,各组数据以均数±标准差(±s)表示。多组之间比较采用单因素方差分析,组间两两比较(与对照组)采用Dunnett-t检验。两组之间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 hAMSC的鉴定、质量干细胞表面分子标志物流式细胞术检测结果显示,CD44、CD73、CD90、CD105阳性率均超过95%。血管细胞相关标志物(CD11b、CD19、CD34、CD45) 以及免疫排斥相关的表面标志物(HLA-DP/DQ/DR)的阳性率均小于2%,见图1。活细胞计数显示活细胞率为98.07%。细胞倍增时间为32.02 h。

图1 流式细胞术检测hAMSC表面分子标志物
2.2 高龄组雄鼠雄激素水平下降与10周龄年轻雄鼠相比,36周高龄雄鼠体质量增加,睾丸体质比下降(P<0.01),睾周脂肪质量增加(P<0.01)。高龄雄鼠血清睾酮水平较年轻雄鼠显著下降(P<0.05)。与年轻对照组比较,治疗前高龄组雄鼠睾丸组织StAR和17β-HSD蛋白表达水平没有显著差异(均P>0.05);但是,组内样本小(n=7)、个体差异较大[StAR的标准差/均数(s/x):高龄组0.48 vs.年轻组0.39;17β-HSD的s/x:高龄组0.39 vs.年轻组0.16]。附睾精子分析显示,高龄雄鼠的精子计数与年轻雄鼠差异无统计学意义(P>0.05);高龄雄鼠精子活动率降低(P<0.05),正常形态精子率下降(P<0.01)。hAMSC治疗前高龄雄鼠与年轻雄鼠的睾丸组织结构完整,生精小管排列整齐,可见不同阶段的生精细胞,但高龄雄鼠生精小管直径增大,细胞层数减少(均P<0.01),见表1、图2(见封三)。
表1 hAMSC治疗前高龄组与年轻对照组比较 (±s)
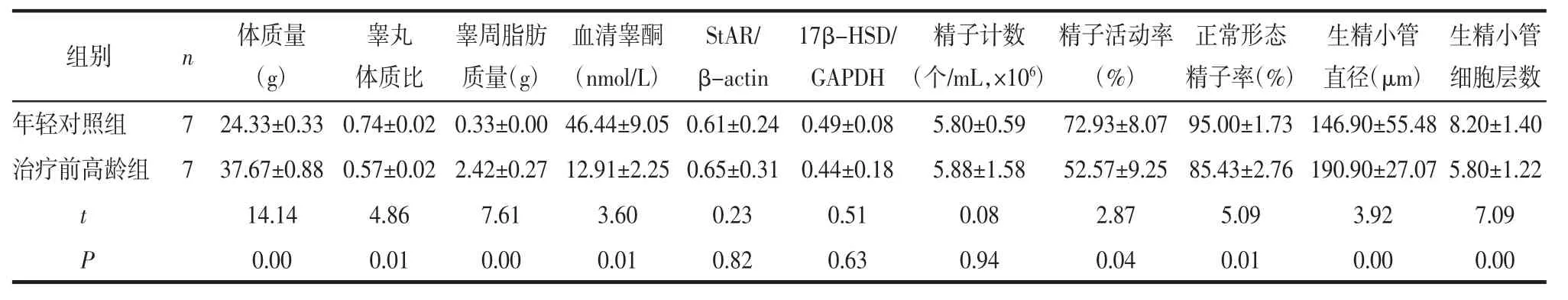
表1 hAMSC治疗前高龄组与年轻对照组比较 (±s)
StAR/β-actin年轻对照组 7 24.33±0.33 0.74±0.02 0.33±0.00 46.44±9.05 0.61±0.24治疗前高龄组 7 37.67±0.88 0.57±0.02 2.42±0.27 12.91±2.25 0.65±0.31 t 14.14 4.86 7.61 3.60 0.23 P 0.00 0.01 0.00 0.01 0.82组别 n 体质量(g)睾丸体质比睾周脂肪质量(g)血清睾酮(nmol/L)17β-HSD/GAPDH 0.49±0.08 0.44±0.18 0.51 0.63精子计数(个/mL,×106)生精小管细胞层数5.80±0.59 72.93±8.07 95.00±1.73 146.90±55.48 8.20±1.40 5.88±1.58 52.57±9.25 85.43±2.76 190.90±27.07 5.80±1.22 0.08 2.87 5.09 3.92 7.09 0.94 0.04 0.01 0.00 0.00精子活动率(%)正常形态精子率(%)生精小管直径(μm)
2.3 hAMSC治疗后高龄小鼠睾丸间质区中有STEM 121和CD105表达高龄小鼠hAMSC治疗后检测STEM121、CD105在睾丸组织中的表达,结果发现,生理盐水对照组和人血清白蛋白对照组的小鼠睾丸组织均无STEM121、CD105阳性表达,而在hAMSC治疗3个剂量组中均有表达,阳性表达细胞都位于睾丸间质区,且高剂量治疗组的阳性细胞数较低剂量组更多,见图3(见封三)。
2.4 高龄雄鼠各组间体质量、睾丸体质比及睾周脂肪无改变hAMSC治疗结束后,各组小鼠体质量、睾丸体质比、睾周脂肪质量差异均无统计学意义(均P>0.05),见图4。
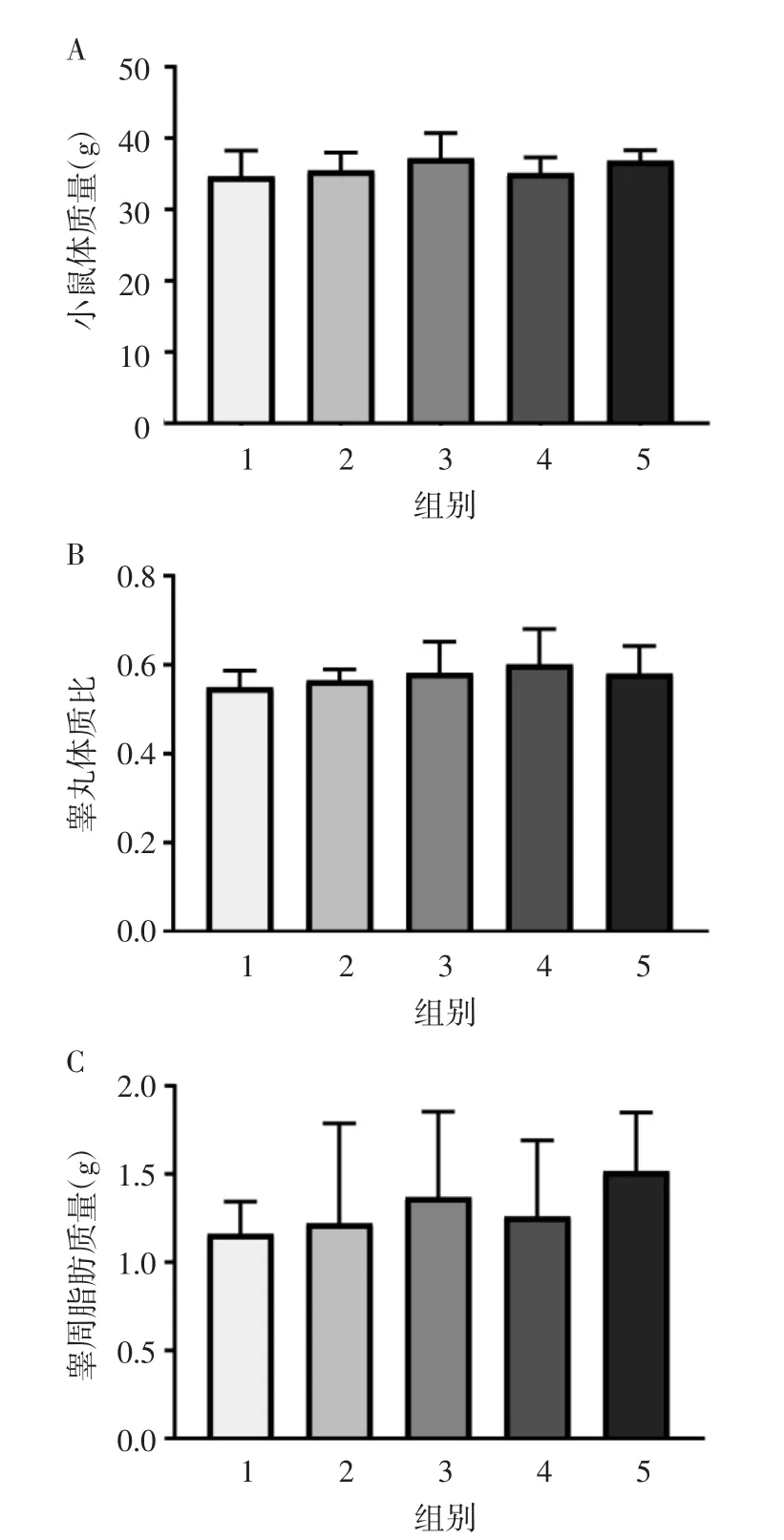
图4 高龄雄鼠hAMSC治疗结束继续饲养5周后各组间体质量、睾丸体质比及睾周脂肪质量比较
2.5 hAMSC提高高龄雄鼠雄激素水平和睾丸组织17β-HSD蛋白表达hAMSC治疗前,生理盐水对照组高龄小鼠的血清睾酮水平较年轻对照组低(P<0.05),与治疗前高龄组的血清睾酮水平差异无统计学意义(P>0.05)。生理盐水对照组、年轻对照组及治疗前高龄组的小鼠睾丸组织内StAR、17β-HSD的蛋白表达差异无统计学意义(均P>0.05),见表2。
表2 生理盐水组和年轻对照及治疗前高龄组血清睾酮和睾酮合成相关酶比较 (±s)

表2 生理盐水组和年轻对照及治疗前高龄组血清睾酮和睾酮合成相关酶比较 (±s)
注:与年轻对照组比较,*P<0.05。
组别 n 血清睾酮 StAR/β-actin 17β-HSD/GAPDH年轻对照组 7 46.44±9.05 0.61±0.10 0.49±0.04治疗前高龄组 7 12.91±2.25 0.65±0.13 0.44±0.09生理盐水对照组 3 16.87±3.31* 0.70±0.21 0.51±0.11 F 9.79 0.13 0.27 P 0.01 0.88 0.77
hAMSC治疗后,高剂量组小鼠的血清睾酮水平较人血清白蛋白对照组升高(P<0.05)。高龄组间睾丸组织StAR蛋白表达无显著差异(P>0.05)。但是,组内样本小(n=7),个体差异较大(s/x:生理盐水组0.30 vs.人血清白蛋白对照组0.33 vs.低剂量组0.39 vs.中剂量组0.31 vs.高剂量组0.39)。与人血清白蛋白对照组相比,高剂量组睾丸组织17β-HSD蛋白表达上调(P<0.05),见表3、图5。
表3 hAMSC治疗后各组间血清睾酮和睾酮合成相关酶比较 (±s)

表3 hAMSC治疗后各组间血清睾酮和睾酮合成相关酶比较 (±s)
注:与人血清白蛋白对照组比较,*P<0.05,**P<0.01。
组别 n 血清睾酮 StAR/β-actin 17β-HSD/GAPDH生理盐水对照组 3 16.87±3.31 0.70±0.21 0.51±0.11人血清白蛋白7 14.85±2.72 0.54±0.18 0.49±0.11对照组低剂量组 7 18.36±3.41 0.49±0.19 0.48±0.19中剂量组 7 15.24±1.92 0.55±0.17 0.71±0.10高剂量组 7 28.51±9.40** 0.84±0.33 0.82±0.09*F 5.56 1.63 4.53 P 0.01 0.40 0.02
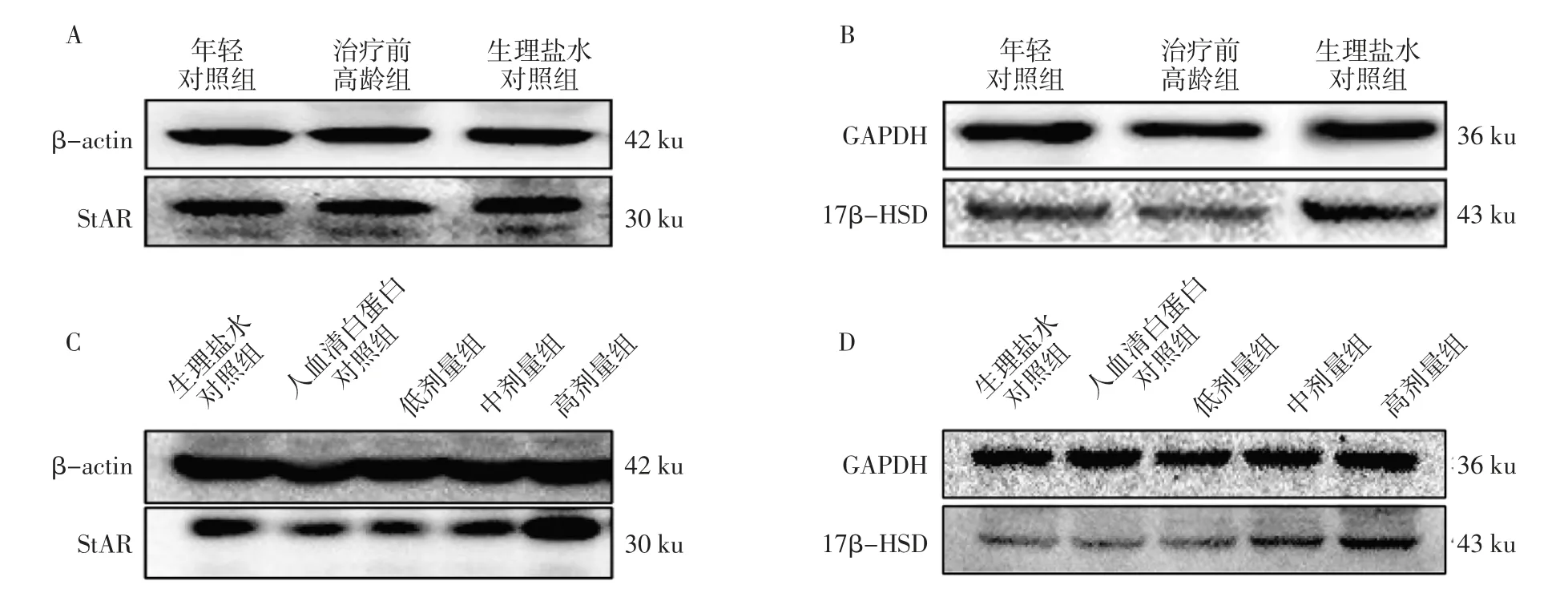
图5 hAMSC提高高龄雄鼠睾丸组织17β-HSD蛋白表达
2.6 精子参数和睾丸组织病理学hAMSC治疗前,生理盐水对照组高龄雄鼠的精子计数、精子活动率与年轻对照组和治疗前高龄组比较差异均无统计学意义(均P>0.05);生理盐水对照组高龄雄鼠的精子正常形态率较年轻对照组和治疗前高龄组下降(均P<0.05)。生理盐水对照组高龄雄鼠的生精小管直径较年轻对照组及治疗前高龄组均增大(均P<0.05)。生理盐水对照组高龄雄鼠的生精小管细胞层数较年轻对照组减少(P<0.05),但与治疗前高龄组相比差异无统计学意义(P>0.05),见表4。
表4 生理盐水对照组、年轻对照组及治疗前高龄组精子参数及睾丸组织病理学比较 (±s)

表4 生理盐水对照组、年轻对照组及治疗前高龄组精子参数及睾丸组织病理学比较 (±s)
注:与年轻对照组比较,**P<0.01;与治疗前高龄组比较,#P<0.05,##P<0.01。
组别 n 精子计数(个/mL,×106) 精子活动率(%) 正常形态精子率(%) 生精小管直径(μm) 生精小管细胞层数年轻对照组 7 5.80±0.59 72.93±8.07 95.00±1.73 146.92±55.48 8.20±1.40治疗前高龄组 7 5.88±1.58 52.57±9.25 85.43±2.76 190.93±27.07 5.80±1.21生理盐水对照组 3 7.04±1.14 54.87±19.09 78.60±0.66**# 240.20±53.74**## 7.00±1.74**F 0.97 2.17 55.31 29.59 20.03 P 0.43 0.20 0.00 0.00 0.00
hAMSC治疗后,高龄雄鼠各治疗组的精子计数、精子活动率、精子正常形态率与人血清白蛋白对照组相比,差异均无统计学意义(均P>0.05)。hAMSC治疗后高龄小鼠各组间的睾丸组织结构完整,生精小管整齐排列,其中可见各阶段生精细胞整齐排列,但生理盐水对照组和人血清白蛋白对照组小鼠的生精小管直径较治疗组增大,偶见有空泡的生精小管,部分小管不完整。中剂量组和高剂量组与人血清白蛋白对照组相比生精小管细胞层数增多(均P<0.05),见表5、图6(见封三)。
表5 hAMSC治疗后各组间精子参数及睾丸组织病理学比较 (±s)

表5 hAMSC治疗后各组间精子参数及睾丸组织病理学比较 (±s)
注:与人血清白蛋白对照组比较,*P<0.05,**P<0.01。
组别 n 精子计数(个/mL,×106) 精子活动率(%) 正常形态精子率(%) 生精小管直径(μm) 生精小管细胞层数生理盐水对照组 3 7.04±1.14 54.87±19.09 78.60±0.66 240.20±53.74 7.02±1.74人血清白蛋白对照组 7 6.56±1.50 73.25±0.64 83.87±3.11 228.60±52.17 6.97±1.73低剂量组 7 6.62±1.49 80.51±8.93 83.43±2.54 155.22±21.60** 7.63±2.11中剂量组 7 5.48±1.42 72.66±10.51 85.80±0.50 122.52±28.53** 8.20±1.75**高剂量组 7 7.49±2.25 78.07±7.31 84.03±3.24 139.62±21.74** 7.90±1.09*F 1.27 3.53 4.00 58.55 3.04 P 0.32 0.02 0.03 0.00 0.02
3 讨论
干细胞在移植治疗中能够发挥多种功能。hAMSC具有免疫原性低,炎症活性低,获取较为容易等特点[10],有研究表明,hAMSC移植入高龄雌鼠体内通过分泌细胞生长因子能够改善卵巢功能[11]。本研究建立的羊膜间充质干细胞株具有典型的间充质干细胞形态,呈旋涡状贴壁生长,体外扩增能力强,检测其细胞表面分子标志物符合间充质干细胞质量鉴定标准,且体外培养过程中可稳定分泌大量细胞因子。笔者所在课题组的前期研究发现hAMSC分泌的细胞因子可改善高龄雌鼠卵巢微环境,促进细胞增殖并延缓细胞凋亡,从而修复卵巢功能[12],这表明hAMSC对于改善高龄女性卵巢功能和提高其生育力具有潜在的临床应用价值。
中老年男性更年期综合征临床表现为睾丸老化、雄激素下降[13]。深入研究中老年男性性腺功能减退机制,可以应用高龄小鼠模型。本研究发现,与10周龄雄鼠相比,36周龄雄鼠血清睾酮水平降低,提示睾丸雄激素合成功能显著下降;睾丸体质比下降、睾周脂肪增加、生精小管直径变大和细胞层数减少。在本研究中,高龄雄鼠睾丸中StAR和17β-HSD的表达并无显著性降低。StAR蛋白能将胆固醇转运至线粒体内膜,是胆固醇转化为孕烯醇酮的限速步骤;17β-HSD蛋白能将脱氢表雄酮转化为睾酮,是雄激素合成的限速酶[14]。本研究仅评估了StAR和17β-HSD蛋白表达水平,没有对其他雄激素合成的关键酶进行研究,推测高龄组雄激素水平下降可能与其他雄激素合成相关酶有关。同时,雄性小鼠与人类男性一样,存在较大的个体差异;睾酮可在芳香化酶(CYP19)的作用下转化为雌二醇,高龄雄鼠睾酮水平下降同时存在雌二醇水平升高,提示睾酮向雌二醇转化增多。高龄雄鼠还存在精子质量下降,表现为正常形态精子率下降,畸形精子增多;精子活动率降低,但差异没有统计学意义,可能与个体差异性较大和样本量较小有关。所以,36周龄雄性小鼠可作为中老年男性性腺功能减退病理机制和治疗实验的研究模型。
不同来源的间充质干细胞被应用于改善男性睾丸功能[8]。本研究从小鼠尾静脉注射hAMSC,发现hAMSC能够改善高龄雄鼠睾丸功能、提高血清睾酮水平,初步实验表明hAMSC对于睾丸衰老具有良性保护作用并促进雄激素合成。STEM121作为一种只在人类细胞胞质中表达的蛋白,常用于干细胞在动物体内的示踪[15]。CD105是间充质干细胞表面标志分子[16]。hAMSC治疗后,通过免疫荧光结果发现各剂量组高龄小鼠的睾丸间质区内有STEM121和CD105的表达,表明hAMSC已成功进入到小鼠睾丸的间质区。有研究发现hAMSC能够改善白消安诱导的睾丸生精功能损伤,表现为精子质量提高[17]。本研究发现,hAMSC治疗后高龄雄鼠的睾丸组织形态趋于修复,主要表现为生精细胞层数增多,生精小管直径趋于正常,这与另一项研究的结果一致,该研究发现人脐带间充质干细胞能够明显修复白消安介导的生精小管组织结构损伤[18]。这提示高龄小鼠体内移植hAMSC后,能够改善生精微环境,延缓高龄雄鼠的睾丸功能减退。
睾丸间质细胞是雄激素合成的细胞[19]。36周龄雄鼠生育力显著降低,相对于人类男性50岁左右;治疗4周并恢复1个生精周期(5周)后,此时小鼠已达44周龄,相对于人类男性60岁左右。本研究发现44周龄生理盐水组雄鼠的血清睾酮水平较年轻小鼠显著下降,但是44周龄雄鼠睾丸组织中StAR和17β-HSD的表达与年轻小鼠和36周龄小鼠相比均无显著差异,这提示44周龄雄鼠雄激素水平下降可能与其他睾酮合成代谢相关酶有关。有趣的是,本研究发现经hAMSC治疗后,高龄雄鼠血清睾酮水平升高,高剂量组睾丸17β-HSD的表达显著升高,表明hAMSC能够通过提高睾酮合成相关酶17β-HSD的表达,促进高龄雄鼠睾酮合成。笔者所在课题组的前期研究发现,hAMSC可分泌多种细胞因子,其中包括血管生成因子,细胞生长和营养因子,促炎、抑炎因子,趋化因子,抗凋亡因子等,且通过静脉注射hAMSC细胞培养上清能够改善高龄小鼠的卵巢功能,这表明hAMSC可能通过旁分泌作用参与组织损伤修复,细胞上清中的某些因子参与细胞内信号通路调控,改善受损组织微环境[20]。因此,推测hAMSC改善高龄雄鼠睾丸雄激素合成功能,可能通过细胞旁分泌作用,改善睾丸间质细胞的功能,促进睾酮合成。当然,笔者所在课题组的前期研究也发现给高龄雌鼠尾静脉注射hAMSC细胞培养上清能够降低其血清黄体生成激素的水平[20]。有研究发现间充质干细胞能够促进雄性糖尿病大鼠的下丘脑-垂体-性腺(HPG)轴,提高血清卵泡刺激素和黄体生成激素水平并促进雄激素合成[21],这表明间充质干细胞促进雄激素合成作用可能不只局限于间质细胞,其对HPG轴可能也有调控作用。
综上所述,hAMSC对高龄小鼠睾丸具有保护性作用,包括修复生精小管组织结构损伤、促进雄激素合成,表明hAMSC在人类中老年男性具有延缓睾丸衰老和促进雄激素合成的作用,因此具有预防和治疗中老年男性迟发性性腺功能减退症的潜在应用前景。

