缬沙坦对大鼠急性肝衰竭的保护作用及其机制研究
李建州 刘小静 叶 峰 李晓青
1.西安交通大学第一附属医院感染科,陕西西安 710061;2.西安交通大学第一附属医院急诊科,陕西西安 710061
急性肝衰竭(acute liver failure,ALF)表现为在短时间内发生大量肝细胞坏死,病情进展迅速,病死率高,发病机制尚不十分清楚[1]。大量研究表明,肾素-血管紧张素系统(RAS)不仅能够维持血压和体液平衡,还能够调节炎症、凋亡和纤维化等病理过程,与各种肝病的发生发展密切相关[2-3]。RAS 阻断剂的应用可为肝脏疾病的治疗提供新思路,但目前关于其在肝衰竭中的研究报道甚少。本研究通过D-氨基半乳糖(DGalN)/脂多糖(LPS)联合腹腔注射诱导大鼠急性肝衰竭模型,采用缬沙坦进行干预,探讨缬沙坦对急性肝衰竭的保护作用及其分子机制。
1 材料与方法
1.1 实验动物
购买180~200 g 的清洁级雄性SD 大鼠60 只,辽宁长生生物技术有限公司,合格证号:2107262001001 67346;生产许可证号:(辽)SCXK2020-0001。饲养及实验过程严格遵守实验动物伦理相关规定。所有实验动物于20~25℃室温饲养1 周后进行实验,实验前禁食12 h。
1.2 主要试剂
D-GalN(货号:G0500)与LPS(货号:L2630)购自美国Sigma-Aldrich 公司。缬沙坦(货号:V129241)购自上海阿拉丁生化科技有限公司。血管紧张素Ⅱ(AngⅡ,货号:E-EL-R1430c)、血管紧张素1-7(Ang 1-7,货号:E-EL-R1138c)、肿瘤坏死因子α(TNF-α,货号:E-EL-R2856c)、白细胞介素-6(IL-6,货号:EEL-R0015c)酶联免疫吸附试验试剂盒,CD68 抗体(货号:22225-1-AP),抗髓过氧化物酶(MPO)抗体(货号:28058-1-AP)均购自武汉三鹰生物技术有限公司。RNA 提取试剂(货号:252250AX)、荧光定量PCR 试剂盒(货号:ET105-01)均购自北京天根生化科技有限公司。CHOP(货号:15204-1-AP)、GRP78(货号:11587-1-AP)一抗均购自上海艾博抗贸易有限公司,辣根过氧化物酶标记二抗(货号:BA1051)购自武汉三鹰生物技术有限公司。
1.3 实验分组及处理方法
采用随机数字表法将实验动物分为正常对照组、肝衰竭组、缬沙坦组,每组各20 只。缬沙坦组腹腔注射缬沙坦(25 mg/kg),30 min 后腹腔注射D-GalN(0.8 g/kg)/LPS(20 μg/kg);肝衰竭组腹腔注射等量生理盐水,30 min 后腹腔注射D-GalN(0.8 g/kg)/LPS(20 μg/kg);正常对照组腹腔注射等量生理盐水,30 min后再次注射等量生理盐水。造模10 h 后每组随机取10 只大鼠统一处死,采血并分离血清,同时留取肝脏组织,冻存备检。继续观察剩余大鼠并记录其存活时间。
1.4 观察指标及检测方法
1.4.1 生化指标及炎症因子的检测 采用生化分析仪(Rayto,Chemray 240)检测大鼠血清中的谷丙转氨酶(ALT)、谷草转氨酶(AST)水平。酶联免疫吸附试验检测大鼠血清或肝组织中TNF-α、IL-6、AngⅡ、Ang 1-7水平。
1.4.2 HE 染色 留取肝脏组织于10%甲醛溶液中固定,按常规步骤进行石蜡包埋、切片、HE 染色,于光学显微镜下观察肝脏病理变化。
1.4.3 免疫组化检测炎症细胞浸润 取石蜡包埋的大鼠肝脏标本,按常规步骤,经切片脱蜡、抗原修复、封闭、加MPO(1∶100 稀释)或CD68(1∶100 稀释)一抗、二抗(1∶10 000 稀释)、显色、苏木精复染、脱水、封片等步骤,最后在光学显微镜下观察,采集图像,蓝色为细胞核,棕褐色为目标蛋白。
1.4.4 荧光定量PCR 检测 采用Trizol 法提取肝脏组织的总RNA,逆转录成cDNA,应用ABI 7500 荧光定量PCR 仪(型号:QuantStudio 6)进行反应,反应体系为cDNA 4 μL,上下游引物各0.4 μL,qPCR 预混液10 μL、超纯水5.2 μL。反应条件为50℃2 min,95℃10 min,95℃30 s,60℃30 s,40 循环,以2-△△Ct进行分析。β-actin 正向引物为5’-CACGATGGAGGGGCCGGACTCATC-3’,反向引物为5’-TAAAGACCTCTATGCCAACACAGT-3’,扩增条带为240 bp。GRP78正向引物为5’-ACGACCCCTGACAAAAGACA-3’,反向引物为5’-GTCAGGCGGTTTTGGTCATT-3’,扩增条带为195 bp。CHOP 正向引物为5’-CCCCAGGAAACGAAGAGGAA-3’,反向引物为5’-CGCACTGACCACTCTGTTTC-3’,扩增条带为210 bp。
1.4.5 Western blot 蛋白印迹分析 每组随机选取5 只处死大鼠留取的肝脏组织标本,按常规步骤提取总蛋白、测定蛋白浓度,后进行SDS 聚丙烯酰胺凝胶电泳,经转膜、封闭、孵育一抗(1∶2000 稀释)、二抗(1∶20 000 稀释)等步骤,最后用ECL 液显色检测蛋白信号,用Band Scan 图像分析软件分析各阳性条带的积分灰度值,分别计算GRP78、CHOP 与内参β-actin 的灰度值之比作为其蛋白相对含量值。
1.5 统计学方法
采用SPSS 20.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较比较采用LSD-t 检验,生存分析采用Log-Rank 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 三组存活情况比较
肝衰竭组在28 h 内全部死亡,正常对照组无死亡,缬沙坦组72 h 的存活率高于肝衰竭组,差异有高度统计学意义(P <0.01)。见图1。
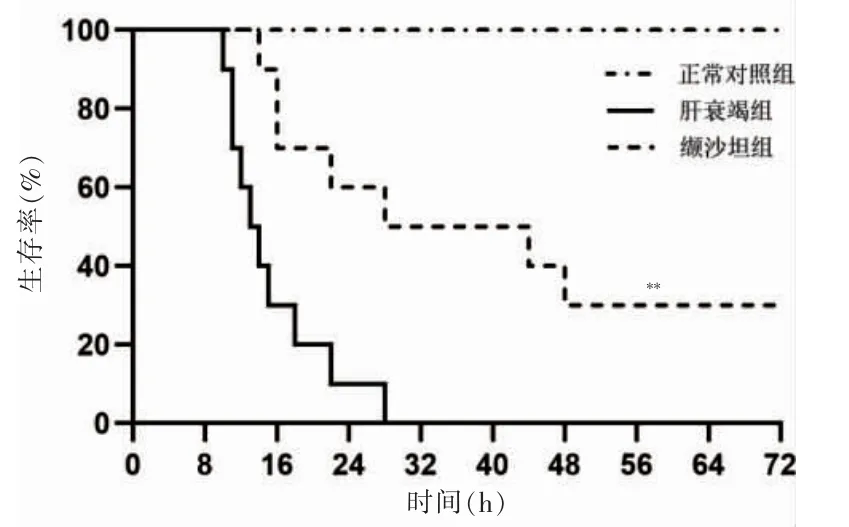
图1 三组生存曲线比较(n=10)
2.2 三组血清及肝脏组织中AngⅡ、Ang 1-7、AngⅡ/Ang 1-7 比值比较
肝衰竭组血清和肝脏组织的AngⅡ、AngⅡ/Ang 1-7比值均高于正常对照组,血清中Ang 1-7 高于正常对照组,肝脏组织中Ang 1-7 低于正常对照组,差异有高度统计学意义(均P <0.01)。缬沙坦组大鼠血清和肝脏组织的AngⅡ、AngⅡ/Ang 1-7 比值均低于肝衰竭组,Ang 1-7 均高于肝衰竭组,差异有高度统计学意义(均P <0.01)。见图2。

图2 三组AngⅡ、Ang 1-7、AngⅡ/Ang 1-7 比值的比较(n=10)
2.3 三组血清生化指标及炎症因子比较
肝衰竭组血清ALT、AST、TNF-α、IL-6 水平均高于正常对照组,差异有高度统计学意义(均P <0.01)。缬沙坦组血清ALT、AST、TNF-α、IL-6 水平均低于肝衰竭组,差异有高度统计学意义(均P <0.01)。见图3。

图3 三组血清生化指标及炎症因子的比较(n=10)
2.4 三组肝组织病理的变化
HE 染色结果显示,正常对照组肝脏组织小叶结构清晰,肝细胞围绕中央静脉呈放射状排列;肝衰竭组肝脏组织部分肝小叶结构紊乱,肝细胞变性坏死严重,缬沙坦组肝脏组织肝细胞变性坏死较肝衰竭组减少,见图4A(封三)。免疫组化结果显示,缬沙坦组肝组织汇管区MPO 和CD68 阳性的炎症细胞较肝衰竭组减少,见图4B、C(封三)。

图4 三组肝脏组织病理染色
2.5 三组肝脏组织GRP78、CHOP 表达水平比较
肝衰竭组肝脏组织中GRP78、CHOP 的mRNA 及蛋白表达水平均高于正常对照组,差异有高度统计学意义(均P <0.01)。缬沙坦组肝脏组织中GRP78、CHOP 的mRNA 及蛋白表达水平均低于肝衰竭组,差异有高度统计学意义(均P <0.01)。见图5。

图5 三组肝脏组织GRP78、CHOP 表达水平比较
3 讨论
近年来研究发现,RAS 与肝炎、肝硬化等各种肝脏疾病的发生发展密切相关[4-5]。目前认为血管紧张素转换酶-AngⅡ-血管紧张素Ⅱ1 型受体(ACE-AngⅡ-AT1R)轴是RAS 的主要功能轴,而AngⅡ是其中的核心分子,可以通过特异性结合AT1R 发挥促炎症、促纤维化效应[6-10]。同时,在体内AngⅡ也能够被ACE2 裂解成Ang 1-7,后者可以与Mas 受体结合发挥抗炎、抗纤维化作用[11-12]。研究表明,AngⅡ能够刺激巨噬细胞分泌IL-6、TNF-α,其本身也是一种重要的炎症因子[13-16]。而IL-6、TNF-α 则是肝损伤中重要的促炎性细胞因子,能够诱导肝细胞凋亡及坏死,加重肝脏炎症[17-19]。AT1R 阻断剂(ARB)可以从受体水平选择性阻断AngⅡ与AT1R 结合,从而拮抗AngⅡ的生物学效应。目前关于ARB 在肝纤维化、肝硬化中的应用研究较多,但其在肝衰竭中的作用报道甚少[2-3]。本研究发现,在急性肝衰竭病理状态下,血清及肝组织中的AngⅡ及AngⅡ/Ang 1-7 水平均明显升高,提示存在ACE-AngⅡ-AT1R 轴的激活。而缬沙坦干预后,急性肝衰竭大鼠的肝功能损伤明显减轻,TNF-α、IL-6等细胞因子水平低于肝衰竭组,肝脏组织中肝细胞坏死及炎症细胞浸润明显减轻。以上实验结果表明,急性肝衰竭时存在RAS 的激活,缬沙坦能够通过阻断RAS 发挥抗炎效应,对急性肝衰竭具有保护作用。
然而对于缬沙坦抗炎作用的具体机制尚不明确。越来越多的研究显示,内质网应激(endoplasmic reticulum stress,ERS)与多种肝脏疾病如病毒性肝炎、酒精性肝病、肝衰竭等密切相关[20-24]。适度的ERS 有利于维持内环境的稳态,持续或过度的ERS 则会影响内质网的结构或功能,激活下游相关的信号通路,继而诱导炎症、凋亡,最终导致脏器的损伤[25]。有研究表明,AngⅡ与AT1R 结合可以激活肾脏细胞的ERS 促进其凋亡,而ARB 可以通过抑制ERS 对糖尿病大鼠发挥肾脏保护作用,因此推测在肝衰竭中同样存在这种现象[26]。实验结果显示,急性肝衰竭大鼠肝脏中ERS 标志分子GRP78、CHOP 水平明显升高,提示存在过度的ERS,这与既往的研究报道一致[27]。而缬沙坦干预后肝衰竭大鼠肝脏组织中GRP78、CHOP 的表达水平明显下调,提示ERS 激活水平的下降。因此本研究提示,在急性肝衰竭时,缬沙坦可能通过阻断RAS抑制肝脏内的ERS 水平,进而抑制ERS 下游相关的炎症通路,减轻细胞因子风暴,最终发挥抗炎保肝作用,但其具体作用机制仍有待于更深一步的研究。
综上所述,缬沙坦可能通过阻断RAS,能够对急性肝衰竭产生保护作用,其作用机制可能与抑制肝脏的ERS 水平有关,阻断RAS 可能为急性肝衰竭的治疗提供新的思路。

