血栓弹力图在评估晚期结直肠癌患者凝血功能中的临床应用价值
宁 军,龚 浩,丁 超,王晨龙,张 敏,任晓磊,王荣祺
北京市海淀医院:1.肿瘤血液科;2.检验科,北京 100080
结直肠癌是目前临床最为常见的恶性肿瘤之一,我国每年约有37万结直肠癌新发病例,其发病率位居我国恶性肿瘤的第3位;而且我国每年因结直肠癌而死亡的患者约18万例,其病死率位居全国恶性肿瘤的第5位[1-2]。由于结直肠癌早期患者缺乏典型临床表现,多数患者确诊时已处于晚期,患者预后极差。近年来,研究显示结直肠癌的发病率呈逐年升高趋势,严重威胁患者的生命健康[3]。临床研究发现,恶性肿瘤患者通常伴有凝血功能异常[4]。血液的高凝状态有利于肿瘤的营养、浸润和转移,但对于其机制尚不明确。目前,对于凝血功能和恶性肿瘤的关系,临床仍处于探索阶段,对于晚期结直肠癌患者的相关报道仍显不足。凝血四项是临床应用较为成熟的凝血功能检测方法,但是该方法仅可对离体血浆进行检测,因而不能完全反映患者的整体凝血功能。而血栓弹力图(TEG)试验是一种基于全血标本的动态检测系统,其可以对血凝块的形成速率、强度及稳定性进行检测,从而对患者的凝血因子、血小板、纤溶物质等方面的功能进行全面评估,因而是评估患者整体凝血功能的一种手段[5]。TEG可以通过最大振幅(MA)、凝固角(Angle角)、凝血反应时间(R)等参数准确地评估机体的凝血功能,进而监测肿瘤患者的凝学功能变化情况,从而为临床诊治提供参考[6]。本研究对80例晚期结直肠癌患者和50例体检健康者进行TEG检测,并对2组TEG参数进行比较,旨在探讨结直肠癌晚期患者凝血功能的变化情况及规律,为临床提供理论指导,现报道如下。
1 资料与方法
1.1一般资料 选取2018年5月至2019年5月本院诊治的合并血栓的晚期结直肠癌患者80例为结直肠癌合并血栓组,未合并血栓的晚期结直肠癌患者80例为结直肠癌未合并血栓组。纳入标准:(1)所有患者均经术后病理学检查确诊为结直肠癌;(2)所有患者在手术前、手术期间及手术后均进行了凝血检测(包括传统凝血功能检测、TEG和深部静脉血管超声检查)。排除标准:(1)合并其他部位恶性肿瘤;(2)妊娠期或哺乳期女性;(3)手术前接受抗凝治疗;(4)合并严重肝肾功能障碍。另外,选取同期于本院行健康体检的健康者80例为对照组,纳入标准:(1)无凝血功能异常;(2)未接受过抗凝治疗。排除标准:(1)经期或孕期女性;(2)有出血病史或血栓病史者,或服用影响凝血功能的药物者及3个月内患其他疾病者。结直肠癌合并血栓组中男37例,女43例;年龄39~79岁,平均(64.7±5.2)岁。结直肠癌未合并血栓组中男39例,女41例;年龄36~77岁,平均(63.9±5.9)岁。对照组中男40例,女40例,年龄40~80岁,平均(64.5±6.5)岁。3组研究对象的性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会审核通过,所有研究对象均对本研究知情并签署知情同意书。
1.2仪器与试剂 TEG检测使用仪器及其配套试剂购自美国Hae-moscope公司,型号Model 5000。具体方法:采集研究对象的清晨空腹肘静脉血1 mL,置于枸橼酸钠抗凝管中,取360 μL血液标本与高岭土混合均匀,随后再添加20 μL氯化钙和340 μL血液标本,混匀后,上机检测,记录TEG图像、MA(即血凝块形成的最大强度)、Angle角(指血凝块达到某一强度的速率)、凝固时间(K,指血凝块强度达到某一水平的速度或其动力学特性)、R(指血液标本从检测开始至血凝块开始形成所需时间)及综合凝血指数(CI)等TEG参数。以厂家说明书上的参数资料为依据,鉴于患者的种族和地区差异,本研究参考国内的研究数据[7],采取相同实验仪器下的参考值范围进行比较(R的正常值参考范围为3.2~7.3 min;K的正常值参考范围为1.0~3.1 min;Angle角的正常值参考范围为50.7~73.4 deg;MA的正常参考值范围为51.3~66.8 mm;CI的正常参考值范围为-2.9~2.8)。
传统凝血四项检验:采用CA-7000全自动血凝分析仪及配套试剂在常温下检测患者的活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、凝血酶原时间(PT);采用双缩脲法测定纤维蛋白原(FIB)。
1.3观察指标 观察并比较3组研究对象的TEG参数和凝血四项,并对3组中测量数值超出正常范围的研究对象的TEG参数进行比较。

2 结 果
2.13组研究对象的TEG参数比较 结直肠癌合并血栓组、结直肠癌未合并血栓组和对照组的R值、K值、Angle值、MA值比较,差异均无统计学意义(P>0.05);但R值、K值、MA值在结直肠癌合并血栓组、结直肠癌未合并血栓组、对照组中呈升高趋势,Angle值呈降低趋势。结直肠癌合并血栓组、结直肠癌未合并血栓组和对照组的CI值比较,差异有统计学意义(F=24.307,P<0.05);其中,结直肠癌合并血栓组的CI值明显高于结直肠癌未合并血栓组和对照组,结直肠癌未合并血栓组的CI值明显高于对照组,差异均有统计学意义(P<0.05),见表1。
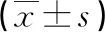
表1 3组研究对象的TEG参数比较
2.23组中测量数值超出正常范围研究对象的TEG参数比较 结直肠癌合并血栓组、结直肠癌未合并血栓组和对照组中R值异常比例比较,差异无统计学意义(P>0.05)。结直肠癌合并血栓组、结直肠癌未合并血栓组和对照组中K值、Angle值、MA值和CI值异常比例比较,差异均有统计学意义(P<0.05);其中,结直肠癌合并血栓组、结直肠癌未合并血栓组中K值、Angle值、MA值、CI值异常比例均高于对照组,差异有统计学意义(P<0.05);结直肠癌合并血栓组中K值、CI值异常比例均高于结直肠癌未合并血栓组,差异均有统计学意义(P<0.05)。见表2。
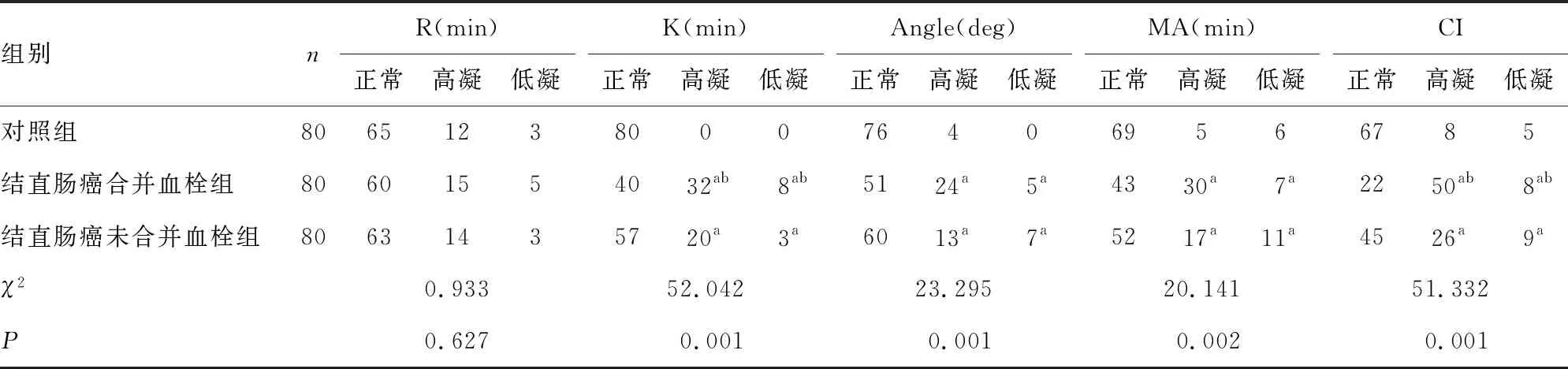
表2 3组中测量数值超出正常范围研究对象的TEG参数比较(n)
2.33组研究对象的传统凝血检验指标比较 结直肠癌合并血栓组、结直肠癌未合并血栓组和对照组的PT、APTT、TT、FIB比较,差异均无统计学意义(P>0.05),见表3。
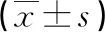
表3 3组研究对象的传统凝血检验指标比较
2.4TEG和传统凝血检验指标对晚期结直肠癌患者凝血功能异常的诊断结果比较 160例结直肠癌患者中,TEG检测出有123例(76.9%)患者的凝血功能存在异常,而传统凝血检验指标检出有92例(57.5%)患者的凝血功能存在异常,组间比较差异有统计学意义(χ2=13.622,P<0.05)。
3 讨 论
结直肠癌是临床常见的一种恶性肿瘤,其发病率及病死率均较高。恶性肿瘤患者通常表现出凝血功能异常现象。正常情况下,机体内的抗凝因子和凝血因子处于动态平衡状态,但当平衡遭到破坏或发生改变时,便可导致机体出现血栓或出血性疾病;而肿瘤细胞分泌的有毒物质及坏死细胞等也会严重影响机体的凝血及抗凝系统。CHEN等[8]研究认为,肝癌患者常存在凝血功能障碍,且预后不良;而TOUKH等[9]研究显示,结直肠癌患者的凝血机制、抗凝机制及纤溶机制呈明显异常状态,且与患者的预后密切相关。相关研究表明,结直肠癌患者的凝血功能异常发生率明显高于健康人群,因而检测并评估结直肠癌患者的凝血功能至关重要[7-9]。
传统的凝血功能检测仅涉及离体血浆凝血级联反应中的部分步骤,该结果可以反映凝血过程中某一阶段的情况,但因缺乏关联性,从而无法反映患者的凝血功能全貌[10];因此其局限性导致临床对凝血状况了解不足,不足以为恶性肿瘤及其与凝血的关联性提供证据。TEG包括对凝血过程及结果的观测,对从凝血开始、血凝块形成、FIB降解等一系列过程进行观测并将结果量化。因此可以对患者凝血因子、蛋白酶原、血小板功能及纤维蛋白溶解等情况进行全面的了解并对其进行观察、分析、评估[11]。陈晶晶等[12]研究显示,采用TEG动态监测恶性肿瘤患者,可以较好地观察肿瘤患者的血液高凝状态,进而降低血栓发生率。还有研究报道了肿瘤患者传统凝血四项指标异常升高,造成血液高凝,甚至形成血栓[13-14]。本研究结果显示,3组的R值、K值、Angle值、MA值及PT、APTT、TT、FIB水平比较,差异均无统计学意义(P>0.05);但3组的CI值差异有统计学意义(P<0.05);其中,结直肠癌合并血栓组的CI值明显高于结直肠癌未合并血栓组和对照组,结直肠癌未合并血栓组的CI值明显高于对照组(P<0.05),提示晚期结直肠癌患者的血液凝血因子水平未呈明显变化,与目前国内其他研究结果不太一致[15];TEG检查结果显示,与体检健康者比较,结直肠癌患者血液处于高凝状态,且合并血栓的结直肠癌患者凝血倾向更为明显。同时本研究结果还发现,3组K值、Angle值、MA值和CI值异常比例比较,差异均有统计学意义(P<0.05);结直肠癌合并血栓组、结直肠癌未合并血栓组中K值、Angle值、MA值、CI值异常比例均高于对照组(P<0.05);结直肠癌合并血栓组中K值、CI值异常比例均高于结直肠癌未合并血栓组(P<0.05)。表明晚期结直肠癌患者中凝血功能异常者明显增多,尤其是合并血栓的患者。另外,从总体凝血指数CI值来看,高凝者占结直肠癌患者中的47.5%(76/160),低凝者占10.6%(17/160),在K值中,结直肠癌患者中高凝例数和低凝例数分别是52例、11例,提示高凝状态患者例数明显多于低凝状态患者,究其原因可能为高凝瘤体的恶性增长和肿瘤浸润、转移、溃疡出血等恶病质,导致机体电解质、代谢及凝血功能紊乱。
综上所述,多数结直肠癌患者出现凝血功能紊乱,且血液高凝状态的发生率较高,临床医生可根据TEG参数结果对患者采取相应处理,如针对血液低凝患者补充相应的血液成分(如血浆、血小板和冷沉淀)以预防出血;针对血液高凝患者,给予预防血栓治疗。针对术期及住院治疗的晚期结直肠癌患者,行TEG监测,可以有效反映患者的凝血功能,进而为临床提供理论参考。

