四项血清指标联合检测在鉴别诊断NSCLC中的价值分析
周明锴
(郑州大学第二附属医院ICU,河南 郑州 450014)
肺癌是一种常见的呼吸系统恶性肿瘤,具有较高的发病率和死亡率,其中约80%-85%的肺癌患者为非小细胞肺癌(Non-small cell lung cancer,NSCLC)[1]。目前,临床上常用于诊断NSCLC的检测方法为胸部影像学检查和细胞组织学检查,但影像学检查费用较高且具有放射性危害,较难被患者接受;病理学检查操作困难,且具有一定的风险性[2]。近年来,血清肿瘤标志物因具有费用低廉、创伤小、操作方便等特点,目前被广泛应用于肺癌的临床鉴别诊断[3]。血清淀粉样物质A(serum amyloid A,SAA)是一种急性时相蛋白质,主要在肝脏中合成,近年来被作为某些肿瘤的标志物而日益受到临床重视。正常状态下,机体内碱性磷酸酶(alkaline phosphatase,ALP)多由肝脏和骨骼产生,当机体出现肝胆疾病时,血清ALP水平升高。细胞角蛋白19片段(cytokeratin 19 fragment,CYFRA21-1)是由细胞角蛋白可溶性片段及单克隆抗体结合而成的细胞角蛋白21片段,是诊断NSCLC的首选肿瘤标志物。胱抑素C(Cystatin C,CysC)是机体内所有有核细胞均能产生的一种半胱氨酸蛋白酶抑制物,可从肾小球滤过,再由近曲小管吸收从而被降解。本研究旨在探讨SAA、ALP、CysC及CYFRA21-1水平联合应用在NSCLC中的诊断价值,以期为NSCLC的临床诊断提供参考,现报道如下。
1 资料与方法
1.1 临床资料
1.1.1 一般资料 选取2016年3月-2018年4月我院收治的经病理学诊断确诊的53例NSCLC患者为NSCLC组,选取同期我院收治的41例肺部良性病变患者为肺良性病变组以及45名同期在我院体检健康者为健康对照组。NSCLC组:男性33例,女性20例,平均年龄(58.9±0.8)岁,平均身体质量指数(Body Mass Index,BMI)(23.8±1.4)kg/m2;肺良性病变组组:男性23例,女性18例,平均年龄(57.3±7.4)岁,平均BMI(23.7±1.8)kg/m2;健康对照组:男性24例,女性21例,平均年龄(56.1±8.1)岁,平均BMI(23.2±1.3)kg/m2。所有研究对象性别(χ2=0.845,P=0.655)、年龄(F=1.433,P=0.242)、BMI(F=2.138,P=0.122)等一般资料比较差异无统计学意义,具有可比性。本研究经我院医学伦理委员会批准通过,所有研究对象均自愿参与研究且签署知情同意书。
1.1.2 纳入、排除标准 纳入标准:所有NSCLC组患者均经由CT、MRI及病理学诊断确诊;所有肺良性病变组患者均经由影像学和病理学检查排除恶性病变;临床资料完整者。排除标准:既往接受过手术、放化疗及免疫治疗患者;合并血液系统疾病,其他良、恶性肿瘤、急慢性感染疾病、严重内分泌疾病、心脑血管疾病及肝肾功能异常者;妊娠或哺乳期妇女;合并精神疾病者。
1.2 检测方法 采集所有研究对象空腹状态下静脉血5ml,放置30min后离心,离心半径5cm,离心速度3000r/min,分离血清,采用罗氏E411全自动电化学发光分析仪及相应配套的试剂盒检测检测CYFRA21-1水平;采用酶联免疫吸附法检测SAA水平(日立7170S全自动生化分析仪;试剂选自宁波普瑞柏生物技术有限公司);采用透射比浊法检测CysC水平(日立7170S全自动生化分析仪;试剂选自广东虹业抗体科技有限公司);采用速率法检测ALP水平(日立7170S全自动生化分析仪;罗氏MODULAR全自动生化分析仪及配套试剂)。所有室内质控数据均在控,所有操作均由我院检验科严格按试剂盒说明书操作,若检测项目出现失控情况,需予以重新检测。
1.3 统计学方法 使用采用Excel 2007软件、SPSS 20.0进行数据处理及统计分析,计数资料采用χ2检验进行比较,计量资料采用均数±标准差(x±s)表示,三组间比较采用F方差分析,三组间两两比较采用LSD-t检验,诊断效果评价采用受试者工作特征(ROC)曲线分析。
2 结果
2.1 三 组 研 究 对 象 血 清ALP、CysC、SAA及CYFRA21-1水平比较NSCLC组患者血清ALP、CysC、SAA及CYFRA21-1水平明显高于肺良性病变组患者及健康对照组(P<0.05),肺良性病变组患者和健康对照组血清ALP、CysC、SAA及CYFR A21-1水平比较差异无统计学意义(P>0.05),见表1。
表1 三组研究对象血清ALP、CysC、SAA及CYFRA21-1水平比较()

表1 三组研究对象血清ALP、CysC、SAA及CYFRA21-1水平比较()
注:与健康组相比,aP<0.05;与肺良性病变组相比,bP<0.05;SAA:血清淀粉样蛋白A;ALP:碱性磷酸酶;CysC:胱抑素C;CYFRA21-1:细胞角蛋白19片段。
组别n ALP(U/L)CysC(mg/L)SAA(mg/L)NSCLC组肺良性病变组健康对照组F值P值53 41 45 130.7±24.6ab 121.7±23.0 114.4±14.5 7.147 0.043 1.1±0.3ab 0.8±0.2 0.7±0.3 30.737 0.000 11.3±3.1ab 8.2±2.1 7.8±2.0 50.315 0.000 CYFRA21-1(ng/mL)3.4±1.1ab 2.7±0.8 2.4±0.5 19.405 0.000
2.2 NSCLC患 者 血 清ALP、CysC、SAA及CYFR A21-1水平单独及联合检测在NSCLC中的诊断价值 血清ALP、CysC、SAA及CYFRA21-1水平单独检测及联合检测诊断NSCLC的AUC值分别为0.672、0.821、0.883、0.761及0.970,联 合 检 测 的AUC值明显高于各项指标单独检测的AUC值(P<0.01),见表2、图1。

图1 血清ALP、CysC、SAA及CYFRA21-1单独及联合检测在NSCLC诊断中的ROC曲线
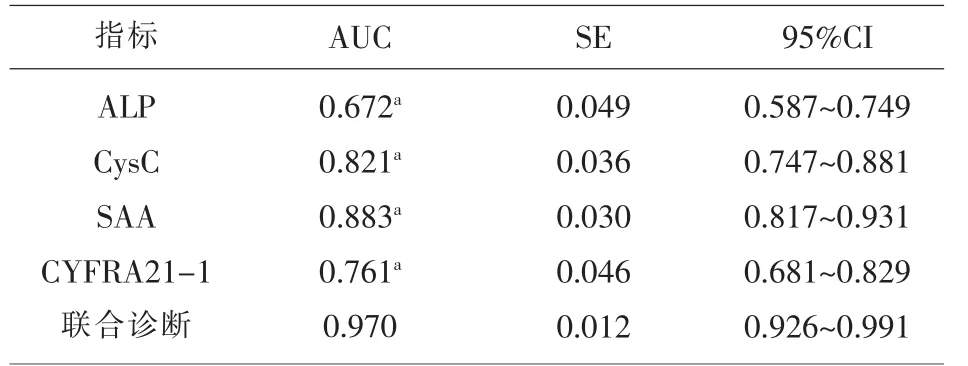
表2 NSCLC患者血清ALP、CysC、SAA及CYFRA21-1水平单独及联合检测在NSCLC中的诊断价值
3 讨论
研究发现[4-6],NSCLC早期临床症状隐匿,NSCLC患者预后较差,其5年生存率仅11%~15%,转移和复发是NSCLC患者死亡的主要原因,而约50%的NSCLC患者在确诊时已处于癌症晚期,多数晚期NSCLC患者对临床治疗措施反应不佳。肿瘤标志物是恶性肿瘤细胞在癌变发生过程中代谢和分泌的生化物质,存在于患者细胞、体液、血液、组织及排泄物中,在血液中含量最高,血清肿瘤标志物检测被广泛应用于癌症的早期诊断。有研究指出[7,8],单项肿瘤标志物检测的阳性率较低,其诊断价值不能满足临床需要,多种血清肿瘤标志物的联合检测是目前癌症诊断方法的研究重点。
大多数肺癌患者在确诊时就已存在远处转移,骨转移是其主要血行转移部位,是导致肺癌患者死亡的主要原因。因此,肺癌骨转移的早期诊断对指导肺癌的临床治疗有重要意义。ALP是一组磷酸单酯水解酶,在碱性环境中可催化磷酸基团水解与转移,主要由肝脏和成骨细胞分泌,并经由肝脏向外排出。研究发现[9,10],当肺癌患者发生骨转移时,骨细胞在损伤情况下将分泌大量ALP以造成磷酸盐沉积,表现为血清ALP水平升高。CysC是临床上常用于反映肾功能损伤程度的检测指标[11,12]。据文献报道[13,14],恶性肿瘤患者体内肿瘤细胞生长、侵袭,引发机体应激反应,导致血清CysC水平升高以抑制胞外胱氨酶的水解活性。SAA在肿瘤的发生、发展过程中起重要作用,能够抑制肿瘤细胞的黏附、转移及血管再生。研究表明[15-18],血清SAA在健康人体内水平较低,在肿瘤患者体内显著上升,一些肿瘤相关巨噬细胞可通过旁分泌途径释放SAA,重塑肿瘤微环境,进而导致肿瘤发生发展。CYFRA21-1在正常肺上皮组织中的水平极低,当上皮细胞发生恶性转化、肿瘤细胞死亡时以溶解片段的形式被释放于血清中,参与癌细胞的增殖、转移。陆友国、丁运生[19,20]等研究发现,NSCLC患者体内CYFRA21-1水平显著升高,且其异常表达与肿瘤分期及淋巴结转移密切相关。
本研究结果显示,NSCLC组血清ALP、CysC、SAA及CYFRA21-1水平较肺良性病变组和健康对照组显著更高,肺良性病变组和健康对照组无显著差异,进一步分析了上述四种血清肿瘤标志物单独及联合检测对NSCLC的诊断价值,结果显示,血清CysC、SAA及CYFRA21-1水平单独检测诊断NSCLC的AUC值分别为0.821、0.883及0.761,联合检测的AUC值为0.970,说明血清ALP、CysC、SAA及CYFRA21-1水平联合应用具有较高的鉴别诊断价值。
综上所述,血清ALP、CysC、SAA及CYFRA21-1水平联合检测能够提高诊断效能,可作为NSCLC的鉴别诊断指标,对NSCLC患者的早期诊断和治疗有重要意义。

