肺癌重症呼吸衰竭ALK抑制剂耐药的基因检测分析
张睿 张郭亮 王飞娟
(铜川市人民医院,陕西 铜川 727000)
肺癌是发病率和死亡率增长最快,对患者健康和生命威胁最大的恶性肿瘤之一,预后极差,其中晚期非小细胞肺癌占所有肺癌的80%[1]。有研究[2]表明,从分子水平研究,非小细胞肺癌的发生机制与其驱动基因突变相关。原癌基因1蛋白酪氨酸激酶ROS(ROS1)是一个单体型受体酪氨酸激酶,可融合形成非小细胞肺癌的致癌性驱动基因。针对ROS1融合基因阳性的靶向药物(ALK抑制剂),如克唑替尼在改善患者生存质量,延长生命周期方面有良好疗效,但最终所有患者都会出现耐药[3]。因此探讨ALK抑制剂发生耐药的机制,是指导非小细胞肺癌进一步治疗的关键。本文分析14例ALK抑制剂治疗后继发耐药的非小细胞肺癌重症呼吸衰竭患者的基因情况,探讨其与耐药机制的相关性。
1 资料与方法
1.1一般资料 选取2013年1月至2018年10月我院肿瘤科收治的接受克唑替尼治疗后出现继发性耐药的非小细胞肺癌重症呼吸衰竭患者14例。其中男4例,女10例;平均(65±8.7)岁;吸烟4例,不吸烟10例;TNM分期:Ⅰ~Ⅲa期1例,Ⅲb~Ⅳ期13例;病理分型:腺癌12例,非腺癌2例;EGFR基因状态:野生型13例,未知型1例;送检样本类型:穿刺组织切片4例,外周血7例,胸水3例。纳入及排除标准:均经临床病理确诊为非小细胞肺癌,且年龄≥18岁;经RT-PCR、NGS或 FISH技术检测提示ROS1基因阳性;均接受克唑替尼口服治疗,且治疗时间超过4周;出现疾病进展,即出现新病灶或基线病灶径总和增加20%左右[4];神志清楚,无言语功能及认知功能障碍;无系统性免疫性疾病、严重感染或其他潜在严重性疾病;临床资料完整,无失访情况;患者及其监护人均签署知情同意书,同意参加本次研究。
1.2方法 所有送检样本均采用NGS技术进行检测。血浆样本检测:抽取患者10 mL外周血置于EDTAD抗凝管中,轻柔颠倒6~8次充分混匀,在4~6 h内于4℃下对样本进行离心,1 600 g 10 min;将离心后的上清血浆分别置于1.5 mL或2 mL离心管中,离心1 600 g 10 min,去除残余细胞,将离心完的上清血浆置于新的1.5 mL或2 mL离心管中,将其与剩余血细胞同置于-80℃冰箱冷冻保存;按照Qiagen提取试剂说明书对分离血浆(2~3 mL)进行血浆ctDNA提取;依据QIAamp DNA Blood Mini Kit提取试剂说明书对血细胞样本进行基因组DNA提取,并采用Qubit对其进行定量处理。胸水样本检测:将提取到的胸水样本10~15 mL保存于2管10 mL无菌管中,并将其置于-20℃或-80℃冰箱中冷冻保存;按照QIAamp DNA Blood Mini Kit提取试剂说明书对胸水样本进行基因组DNA提取,并采用Qubit对进行定量处理。测序方法:制备测序文库,按照建库试剂盒推荐步骤建立行ctDNA和基因组DNA文库;上机测序,按照操作说明书进行上机测序;分析测序数据的生物信息,使用比对软件BWA对测序序列进行比对,MuTect进行SNP变异分析,GATK进行InDel变异分析,contra.py进行拷贝数变异分析。
1.3观察指标 基因改变情况(基因数目、类型、改变位点);有效性指标(血气指标、呼吸频率、心率);安全性指标(住院时间、并发症)。

2 结 果
2.1脑转移情况 8例患者以脑转移为主要进展部位,约占57.1%,6例脑转移患者在出现脑部病灶进展时肺部情况稳定且有所改善,约占75.0%,且6例患者仍存活,占75%。
2.2基因改变情况 3例患者出现1个基因改变,4例患者出现2个基因改变,2例患者出现3个基因改变,2例患者4个基因改变,1例患者出现5个基因改变,2例患者出现6个基因改变,共出现剪切位点(2%),读框内插入缺失(3%),基因多样性改变(3%),基因截断改变(3%),移码突变改变(5%),基因拷贝数变改变异占(6%),基因融合改变(25%),错义突变改变(53%),8类基因突变类型见图3。
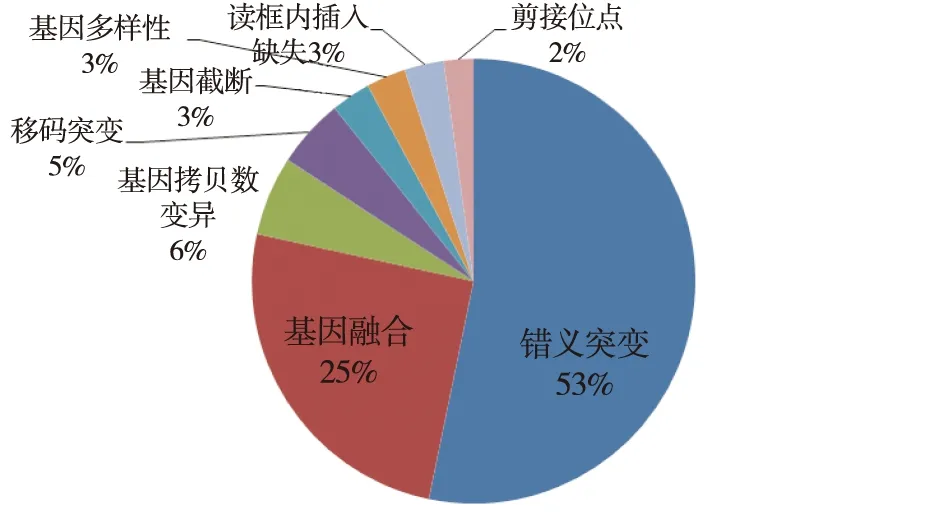
图1 基因改变类型
2.3ROS1获得性突变阳性及突变阴性的基因改变情况 14例耐药的非小细胞肺癌患者共发现51个基因改变,平均每个患者约出现3.6个基因改变。其中13例患者出现ROS1基因融合改变,约占比92.9%;2例患者出现CDKN2A基因突变,约占14.3%;4例患者出现G2032R点基因突变,约占28.6%;2例患者出现TP53点突变,约占14.3%,均存在于获得性ROS1基因突变阳性患者中;3例患者出现TP53点突变,约占21.4%,均存在于获得性ROS1基因突变阴性患者中,还在此类患者中发现TERT、NEF2L2、PTPRD、OR5L2等罕见基因及K-RAS、EGFR、KIT、BRAF、PIK3CA等常见基因突变。
3 讨 论
手术治疗、化疗及放疗在改善晚期非小细胞肺癌的生存率方面无显著作用,且存在较多严重并发症[5]。因此应用新型的高效的抗癌药物则尤为重要。
近年来,多种病理类型的肺癌中都可见到驱动基因的改变,但两种以上驱动基因突变在同种类型的肺癌中少见[6]。针对基因突变的靶向药物治疗具有疗效好,生存率明显提高,预后改善及并发症少的优点,但存在耐药率极高的局限性[7]。EGFR是肺癌中最常见的致癌驱动基因,而ALK是一种跨膜受体酪氨酸激酶,可激活多个细胞通路,是非小细胞肺癌的新型致癌驱动基因,是目前临床常见的治疗靶点[8]。胶质母细胞瘤中发现的ROS1融合基因属于胰岛素受体家族,也被证实为新的肺癌治疗靶点,在0.9%~2.0%的非小细胞肺癌患者中可检测该基因[9],其基因阳性患者多为年龄偏小,但其与EGFR及ALK融合基因等突变并不能共存于肺癌患者体内,在EFGR和ALK融合基因阴性的非小细胞肺癌患者中ROS1基因的检测率明显提高[10]。
本文研究采用NGS检测技术对患者的血液样本、胸水样本及组织切片样本进行检测,具有高度敏感性和特异性。综上所述,笔者认为,ROS1融合基因阳性的非小细胞肺癌重症呼吸衰竭患者耐药发生机制相对复杂,可能与多种基因突变相关,可以采用NGS检测技术测定耐药基因,以指导临床用药,但由于本文样本量较少,且采用的血液样本是否只代表影响疾病进展的最主要DNA基因突变仍存疑,需要进一步深入研究。

