新型植物基载体对乳糖酶的高效递送及保护
侯欣尧,邓紫玙,2,梁宏闪,2,,李 斌,2,3
(1.华中农业大学食品科技学院,湖北 武汉 430070;2.环境食品学教育部重点实验室,湖北 武汉 430070;3.湖北省功能食品工程技术研究中心,湖北 武汉 430068)
乳糖是由D-葡萄糖和D-半乳糖在乳糖合成酶的催化下通过β-1,4-糖苷键连接而成的二糖,广泛存在于牛奶及奶制品中[1-2]。乳糖不能直接被人体吸收,需要被消化道中产生的乳糖酶分解为单糖后才可以被吸收利用。若部分乳糖酶缺乏的人群一次性摄入较多的乳糖,乳糖未被水解进入结肠后,被肠道微生物分解,产生大量的乳酸、甲酸、醋酸等短链脂肪酸和甲烷、H2、CO2等气体,会造成肠道内渗透压升高使得肠腔内水分增多而引起腹涨、肠鸣、肠绞痛直至发生水泻等症状,该现象被称为乳糖不耐受[3]。乳糖酶缺乏和乳糖吸收不良在世界范围内广泛发生,但存在较大的地理差异,全世界大约有40亿 人面临乳糖不耐受[4],大部分集中于亚洲人和非洲裔美国人,欧洲乳糖不耐症患病率低于亚洲[5]。在我国大约有90%以上的成年人有乳糖酶缺乏的现象[6]。乳糖酶的缺乏由遗传因素决定并随着年龄的增长,肠道内乳糖酶的活性逐渐降低,导致成年人乳糖不耐症患病率更高。目前为缓解乳糖不耐受这一问题,已经研发出相关方法,其中包括生产低乳糖或无乳糖制品。但目前有研究表明,乳糖不耐症患者长期食用无乳糖制品会导致营养不良问题,如钙、磷元素和维生素的缺乏,骨骼处于亚健康状态,患骨质疏松的风险更高等[7],因此将乳糖酶以酶制剂的形式添加到乳制品中是解决乳糖不耐症最根本最直接的选择,具有较大的发展潜能。
生物酶制剂安全、无毒,将其用于解决乳糖不耐症是近年来的一个研究热点,具有重要的临床价值和社会意义。乳糖酶于1998年底被我国食品添加剂标准化委员会列入食品添加剂目录,作为食品原料进行管理。目前有研究发现用乳糖酶治疗儿童腹泻继发乳糖不耐受能显著提高临床疗效,缩短治疗疗程且无明显不良反应[8]。因此,利用乳糖酶制剂治疗儿童腹泻继发乳糖不耐受在保证婴幼儿乳糖摄入的同时缓解乳糖不耐受症状,是治疗腹泻继发乳糖不耐受的理想方法。其中β-半乳糖苷酶是最常见的乳糖酶补充剂,可将其在消费者食用前以液态形式添加到牛奶中,或与乳制品一起以固体形式加入牛奶中[9]。由于单一裸露的乳糖酶在口服时易被胃酸破坏,因此众多研究者聚焦构造乳糖酶递送体系,保护其顺利通过胃液,抵达肠道发挥作用[10-11]。然而已有研究对乳糖酶在胃液中保护效果欠佳,使其在主要作用部位小肠处活性较低,因此乳糖酶的递送仍需开发出一种绿色、生物相容性好的有效递送系统,在满足安全性的同时实现对乳糖酶的高效保护及靶向递送。
自然界中,花粉孢粉素外壁具有良好的弹性、物理和化学抗性、紫外线屏蔽能力和抗氧化活性。这些特性使植物能够保护其遗传物质不受外界因素影响[12-14]。因此可通过提取孢粉素生产无过敏原外壳,即孢粉素外壁胶囊(sporopollenin exine capsules,SECs)[15]。同时,SECs被美国食品和药物管理局普遍认为是安全材料[16-17]。近年来,从天然花粉的孢子中提取的SECs由于结构均匀、力学和化学稳定性强、孔隙率大、内腔大、可利用性丰富等特点,被广泛用于药物及营养素包封[18]。向日葵花粉外壁比许多其他花粉外壁对酸和碱的处理更有弹性,且该花粉为单腔大孔径花粉,便于物质负载,是一种优质的递送材料。根据Rienzo等[19]的研究可知,虽然向日葵花粉外壁表面孔隙大使其便于物质的负载,然而在递送过程中负载物较易从花粉表面孔中释放,影响负载物活性或稳定性。针对这一问题,可以通过适宜的聚合物涂层技术进行调控,保护负载物在递送过程中的稳定性。
海藻酸钠(sodium alginate,Alg)又称海藻胶、褐藻酸钠或海带胶,是一种从天然褐藻中提取的聚阴离子多糖的钠盐,因其无毒同时具有良好的生物黏附性、生物相容性、生物可降解性及胶凝特性,被广泛用于食品工业、医药工业、日用化工业等领域[20]。茯苓多糖(carboxymethylpachymaran,CMP)为茯苓的主要成分,但其水溶性低,影响其研究应用[21],而经过羧甲基化的CMP其水溶性及生物活性均显著提高[22],同时还表现出显著的免疫调节、抗炎和抗氧化活性[23]。此外,最近的研究表明,CMP具有显著的pH值敏感性和优异的溶胀能力,因此有很大潜力成为一种新的药物或营养素载体[24]。
本实验采用不同Alg与CMP溶液体积比的混合凝胶体系作为包膜材料,对负载乳糖酶的新型植物基材料(向日葵SECs)进行包膜,探究不同多糖比例对乳糖酶的释放及保护效果,优化最佳配比,以期最大化实现对乳糖酶的保护及控制性释放。
1 材料与方法
1.1 材料与试剂
β-半乳糖苷酶 上海源叶生物科技有限公司;向日葵花粉 卡尔科学实验室;羧甲基CMP 武汉润歌生物科技有限公司;邻硝基苯β-D-半乳吡喃糖苷(2-nitrophenyl-β-D-galactopyranoside,ONPG)、Alg国药集团化学试剂有限公司。
1.2 仪器与设备
DZ-3BCII真空干燥箱 上海索普仪器有限公司;JSM-6390LV扫描电子显微镜 日本NTC公司;Carl Zeiss LSM880激光共聚焦显微镜 德国耶拿公司;Thermo Multskan Go全自动酶标仪 上海鼎谦生物科技有限公司;SPX-150BIII生化培养箱 杭州绿博仪器有限公司;FiveEasy Plus pH计 梅特勒-托利多仪器(上海)有限公司;YP502N电子天平 上海精密科学仪器有限公司;MIX-30S涡旋仪 杭州米欧仪器有限公司。
1.3 方法
1.3.1 花粉SECs的制备及表征
1.3.1.1 SECs的提取
称取2 g脱脂向日葵花粉加入15 mL 85 g/100 mL磷酸溶液,酸解处理不同时间(3、5、10、20 h)后,真空过滤收集花粉,随后经过一系列洗脱:热水(50 ℃,5×100 mL)→热丙酮(50 ℃,2 h,100 mL)→2 mol/L热盐酸(50 ℃,1 h,100 mL)→热水(50 ℃,5×100 mL)→热丙酮(50 ℃,1×100 mL)→热乙醇(50 ℃,2×100 mL),每次洗涤之间至少悬停5 min。真空过滤收集处理后的SECs,在60 ℃烘箱中干燥至质量恒定,放入干燥箱贮存备用。
1.3.1.2 激光共聚焦显微镜分析
未脱脂和经脱脂酸解处理的SECs通过激光共聚焦显微镜分析其荧光。配备3 个光谱反射/荧光检测通道,6 条激光线(405、458、488、514、561、633 nm)和1 个倒置显微镜。
1.3.1.3 扫描电子显微镜观察
取干燥的样品用导电胶置于载物台上,用洗耳球吹去未粘合样品。经过离子溅射仪喷金后,在10 kV电子下用电子显微镜观察脱脂后向日葵花粉的形貌。
花粉SECs切面制备是通过将SECs固定在扫描电子显微镜样品固定带上,将其浸入液氮中20~30 s后,使用一把钢制手术刀片切割而成。
1.3.2 负载实验
50 mg花粉SECs与1 mL 1 mg/mL乳糖酶溶液涡旋均匀混合10 min,将混合液转移至6 孔板中,用锡纸覆盖6 孔板的上端且扎孔。将6 孔板置于30 ℃真空干燥箱真空干燥0.5 h,而后关闭真空阀继续干燥2.5 h后得到负载样品。
1.3.3 乳糖酶活力测定
1.3.3.1 磷酸盐缓冲液(pH 6.5)配制
称取8.8 g磷酸二氢钾(KH2PO4)、250 mg七水硫酸镁(MgSO4•7H2O)、18.6 mg二水乙二胺四乙酸(C10H14N2Na2O8•2H2O)及8.0 g三水磷酸氢二钾(K2HPO4•3H2O)溶解于600 mL水中,搅拌至溶液均一稳定。而后用pH计进行测量,误差在0.05之内。测量完毕后,将溶液转入1 000 mL容量瓶,用水定容并摇匀,至于4 ℃冷藏贮存。
1.3.3.2 ONPG底物溶液配制
将250.0 mg ONPG溶解于80 mL磷酸盐缓冲液(pH 6.5)中,而后转移至100 mL容量瓶中,用反应缓冲液定容摇匀,制备不得早于使用前2 h。
1.3.3.3 Na2CO3溶液配制
称取50 g Na2CO3、37.2 g二水乙二胺四乙酸溶解于约700 mL的超纯水中,缓慢搅拌至固体完全溶解。最后定容至1 000 mL的容量瓶中,摇匀。可放至室温密封贮存。
1.3.3.4 酶活力测定
配制1.00 mg/mL乳糖酶溶液作为对照组母液。每个样品取两支试管,一支作为实验组,一支作为对照组。将所有试管、ONPG底物溶液和Na2CO3溶液同时放置于37.0 ℃水浴锅中平衡30 min,而后取出放在试管架中,按照已定的顺序排好。在样品液中快速加入5.00 mL ONPG底物溶液,在对照液中加入2.00 mL Na2CO3溶液,涡旋混合均匀。室温下静置,精确反应10 min。迅速加入2.00 mL Na2CO3溶液于样品液中,5.00 mL ONPG底物溶液于对照液中,涡旋混合均匀。从每个试管取200 μL溶液于微孔板中,每支试管样品做3 次平行,使用Thermo Multskan Go全自动酶标仪在420 nm波长处精确测量样品和对照液的吸光度。
1.3.4 包膜实验
配制5%的Alg及6%的羧甲基CMP溶液。采用4 个不同体积比(Alg∶CMP=1∶0、1∶1、2∶1、3∶1)Alg-CMP多糖混合液与50 mg负载后的SECs均匀混合。使用1 mL的针筒逐滴加于50 mL、0.05 mol/L的CaCl2溶液均匀搅拌后,静置10 min后真空抽滤,超纯水洗涤3 次后,得到硬化后的凝胶球。
1.3.5 体外释放实验
将不同比例Alg-CMP体系(Alg∶CMP=1∶0、1∶1、2∶1、3∶1)制成的凝胶球加入模拟胃液(simulated gastric fluid,SGF,pH 2.5),放入恒温摇床37 ℃、100 r/min孵育2 h。收集凝胶球,水洗后加入模拟肠液(simulated intestinal fluid,SIF,pH 7.4),37 ℃、100 r/min恒温摇床孵育6 h。固定时间下取出均匀混合的样品液1 mL,测量其在420 nm波长处的吸光度。同时取锥形瓶,加入未经包膜处理的负载乳糖酶的SECs(乳糖酶质量相同),按照上述相同条件,固定时间下取出均匀混合的样品液1 mL,测量其在420 nm波长处的吸光度,作为对照组。
1.3.6 冻干保护效果评价
羧甲基CMP具有优良的特性,常作为冻干制剂中蛋白质的赋形剂。因此将乳糖酶液和Alg-CMP体系制备的凝胶球进行冻干处理后测其酶活力,由此验证Alg-CMP体系是否具备成为乳糖酶冻干保护剂的潜力。酶活力损失率计算如下:

1.4 数据分析
各组实验均进行3 次平行测定,数据分析采用Excel软件,结果表示为±s。作图采用Origin Pro 8.5。
2 结果与分析
2.1 SECs的制备与表征
向日葵花粉为单腔花粉,在去除其致敏内容物,较大空腔为药物及营养素的包埋提供了充足的负载空间。依据实验室对向日葵孢粉素的前期研究可得[25],其脱脂10 h后经过不同时间的磷酸酸解处理,得到SECs。SECs通过粒径测定、形貌分析及C、N元素分析等一系列表征,表明经磷酸处理后,其内容物去除程度不断提高,致使其内腔中空程度显著增大。研究发现,在酸解处理10 h后,其内腔较大,同时SECs形态结构保持完整。因此本实验采用磷酸处理10 h后的向日葵SECs作为目标递送载体。
由图1a、b对比可知,经脱脂和酸解处理后向日葵孢粉素中内容物被去除,SECs内腔的中空程度得到了较大提高,为负载乳糖酶提供了充足空间。SECs的扫描电子显微镜切面图进一步证明了向日葵SECs内容物被充分去除(图1c)。从图2可以清晰观察到,向日葵孢粉素外壁具有微米级大孔和纳米级小孔,可实现乳糖酶的负载。从上述形貌特征可知,向日葵SECs表面具孔,同时其内腔大、粒径分布均一,是实现乳糖酶高效负载的优异载体。

图1 向日葵SECs激光共聚焦显微镜和扫描电子显微镜图像Fig.1 CLM and SEM images of SECs

图2 脱脂和酸解处理后向日葵SECs扫描电子显微镜图像(×30)Fig.2 SEM images of defatted SECs and acid treated SECs (× 30)
2.2 β-半乳糖苷酶负载
基于实验室前期研究[25],本实验采用真空负载技术实现乳糖酶的负载。实验发现在SECs与β-半乳糖苷酶质量比50∶1,负载温度30 ℃、负载3 h条件下,向日葵SECs的酶活力保留率高达(85.40±1.19)%。图3是采用FITC荧光标记的乳糖酶负载前后向日葵SECs的激光共聚焦显微镜图(激发片波长460~550 nm,发射片波长590 nm)。对比图3可看出,荧光标记的乳糖酶已被成功负载于向日葵SECs内,进一步说明向日葵SECs可作为乳糖酶的优良的载体。但由于向日葵SECs表面存在大小孔,虽然为乳糖酶的负载提供了通道,但是前期实验验证发现多孔的结构使其不能在胃环境下提供对乳糖酶的保护。因此需要在负载乳糖酶后,使用高聚物包埋技术进一步实现对花粉大小孔的包埋,同时可利用高聚物的性质赋予体系一定的环境相应性。

图3 荧光标记的乳糖酶负载前(a)和负载后(b)向日葵SECs激光共聚焦显微镜图Fig.3 CLM images of free SECs (a) and SECs loaded with fluorescent labeled β-Gal (b)
2.3 体外模拟实验
2.3.1 微球形貌
本实验选择使用Alg与Alg-CMP体系实现对花粉大小孔的包埋。图4显示,Alg凝胶球在SGF中模拟消化2 h后,其形态结构与0 h相比并未有较大变化,仍是球体。从形态上分析,这有利于保护乳糖酶在胃液环境中不受破坏,保持其活性。在SIF消化的过程中,凝胶球慢慢溶解,这表明乳糖酶在肠液环境中可被缓慢释放,显示出一定的释放靶向性。

图4 Alg凝胶球在SGF和SIF中的溶出过程照片Fig.4 Photographs displaying the dissolution process of ASG in SGF and SIF
从图5可得,Alg与CMP混合(体积比1∶1)所制的凝胶球在SGF和SIF中的变化情况类似Alg凝胶球。在SGF中孵育2 h后,其形态结构与初始相比并未有显著变化,这表明加入CMP后的凝胶球同样具备保护乳糖酶在胃酸环境下不被破坏的特点。之后在SIF消化过程中,凝胶球逐渐溶解,这表明加入CMP并不影响乳糖酶在肠液中的响应性释放。

图5 Alg-CMP凝胶球在SGF和SIF中的溶出过程照片Fig.5 Photographs displaying the dissolution process of Alg-CMP in SGF and SIF
2.3.2 扫描电子显微镜分析
从图6可知,初始状态,SECs可包裹在Alg凝胶中,SGF孵育2 h后,凝胶结构部分松散,但仍可看出凝胶可黏附在SECs外。这进一步说明了该体系具备一定的保护乳糖酶抵抗胃环境的能力。SIF中凝胶球随着模拟消化时间的延长逐渐溶解,乳糖酶被释放于肠液中发挥作用。从图7可知,在经过胃环境孵育2 h后,凝胶结构基本无变化,SECs仍紧密包裹于凝胶网络中。推测Alg与CMP间的相互作用可以一定程度增强凝胶强度,从而可以为负载有乳糖酶的SECs提供更强的保护。负载有乳糖酶的SECs在经过不同包膜材料处理后,其在SIF中的酶活力保留率将进一步验证。

图6 Alg凝胶球在SGF和SIF中溶解过程扫描电子显微镜图Fig.6 SEM images displaying the dissolution process of ASG in SGF and SIF

图7 Alg-CMP凝胶球在SGF和SIF中的溶解过程扫描电子显微镜图Fig.7 SEM images displaying the dissolution process of Alg-CMP in SGF and SIF
2.3.3 体外释放
实验显示,仅使用向日葵SECs负载乳糖酶,未进行表面聚合物包埋,该体系测得乳糖酶基本全部失活(对照组,结果未显示),表明SECs上大小孔虽然可实现对乳糖酶的负载,然而其未能在胃部的强酸环境中对乳糖酶提供高效保护。因此,需要Alg或Alg-CMP体系实现对花粉大小孔的包埋。如图8所示,在SIF中孵育4 h后释放基本达到平衡。其中仅使用Alg制备的微球中乳糖酶活力保留率最低,对乳糖酶的保护效果不理想。这可能是由于Alg形成微球的空间网络状结构较疏松,导致其在SGF环境中H+对乳糖酶活力产生了破坏作用[26]。而加入CMP后,在经过SIF消化4 h后酶活力显著提高,尤其是Alg与CMP溶液体积比为1∶1时,其酶活力保留率最高,约55%,对乳糖酶起到明显的保护作用。这可能是由于加入CMP后,凝胶球形成的空间网络状结构更为致密,从而可以抵抗胃环境达到对乳糖酶活性更好的保护效果,这与扫描电子显微镜分析结果可以相互验证。关于CMP与Alg间的相互作用力影响凝胶结构,进而影响酶活力保留率的原因,据推测可能与两种多糖的结构具有一定关系。Alg结构中含有大量羧基,是一种阴离子多糖也是酸性多糖,其结构上的Na+可以与Ca2+发生离子交换,快速形成水凝胶[27]。CMP是β-吡喃糖苷键结合的多糖,也是一种阴离子多糖,据王博等[28]研究发现,CMP的分子链构象与糖溶液的浓度、溶剂性质及离子强度密切相关,不同物化性质的溶液都会对其分子链的构象产生很大影响。从结构方面看,这两种多糖结构较为相似,因此具有较好的生物相容性[29]。这两种多糖分子中含有大量羟基和羧基,分子间可通过范德华力作用形成物理交联使得分子之间的作用力增加,从而使得凝胶球的网状结构更为致密[30],起到一定的缓释效果,这与图8结果也吻合。综上可知,Alg与CMC溶液体积比为1∶1时所制备的凝胶球对乳糖酶的保护效果最佳。
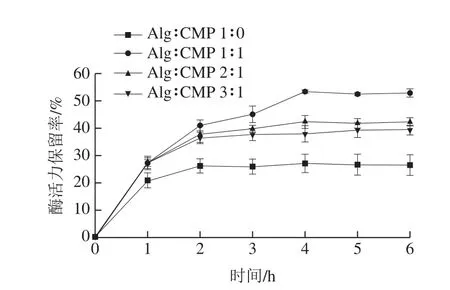
图8 包膜后SECs外模拟累积释放图Fig.8 In vitro simulated cumulative release of β-Gal from SECs after capsulation
2.4 冻干保护
真空冷冻干燥技术应用广泛,尤其在食品、生物、医药等多种领域[31]。酶制剂经过冷冻干燥技术处理后可延长其储存性能,有利于对其活力的保持[31]。但是对于稳定性较差的酶制剂如乳糖酶,经冷冻干燥后,可一定程度损失其活性。因此可开发具有优良冷冻保护效果的体系,最大化减小冷冻条件对酶活力的不利影响。由表1可知,经Alg-CMP体系保护的乳糖酶冻干后经过SIF释放的酶活力高于纯酶液,因此该体系具有作为乳糖酶冻干保护剂的能力。其保护机制可能是因为SECs物理和化学性质稳定,具有良好的抗高温高压等特性。通过SECs坚硬的外壳对乳糖酶进行封装,相当于乳糖酶抵抗外界不良环境的天然屏障,极大增强了乳糖酶对外界不利环境的抗性。之后通过多糖体系将花粉上的微孔包封,一方面是进一步增强其抗性,另一方面是在包封过程中,由于蛋白质分子内存在大量的氢键,而多糖类化合物含有大量的自由羟基,它们之间相互结合将蛋白质分子牢牢地束缚在花粉之中,从而保护了蛋白质分子在冷冻干燥过程中不变性,进而起到保护乳糖酶活性的作用[31-32]。综上所述,Alg-CMP体系具有作为乳糖酶的冻干保护剂的潜力。

表1 经SIF消化6 h后冻干乳糖酶与冻干Alg-CMP体系中乳糖酶活力损失率Table 1Enzymatic activity loss percentage of freeze-dried β-Gal and freeze-dried β-Gal in Alg-CMP system after 6 h incubation in SIF
3 结 论
将向日葵花粉经过一系列处理后采用真空负载技术可实现对乳糖酶的高效负载。但是由于向日葵SECs表面的大小孔,需要进一步对SECs进行包膜处理。包膜实验采用4 个不同比例的Alg与CMP多糖体系(Alg∶CMP=1∶0、1∶1、2∶1、3∶1),与负载后的SECs均匀混合后制备凝胶球。在体外模拟消化实验中,通过形貌图以及扫描电子显微镜图可以验证Alg-CMP凝胶球在模拟消化释放时,在SGF中基本不变,在SIF中凝胶溶解。体外消化释放图也进一步证实凝胶球在SIF消化过程中乳糖酶在逐步释放,在4 h左右基本释放达到平衡。同时结果显示Alg-CMP微球(体积比1∶1)可以有效阻止乳糖酶过胃失活,实现在肠道中的响应性释放,最大化保存酶活性。实验还发现,Alg-CMP体系负载的乳糖酶在冻干处理后具有高效保护乳糖酶的效果,体系具备成为乳糖酶冻干保护剂的潜力。通过对向日葵SECs递送体系的构建及后续实验,成功论证了其可以作为乳糖酶高效递送及保护载体的可行性,为乳糖不耐症的治疗提供了新的思路和想法。

