辣椒粉中黄曲霉菌生长及其产毒规律的预测模型构建
赵 雪,靳欣迪,刘 斌,赵旭博
(西北农林科技大学食品科学与工程学院,农业农村部农产品质量安全风险评估实验室(杨凌),陕西 杨凌 712100)
辣椒粉是一种常见的香辛料,富含辣椒素、VC和胡萝卜素等物质,其独特的风味及香气特性深受广大消费者青睐,在世界各地广泛种植。我国是辣椒种植、消费及外贸大国,所创造的经济价值位居蔬菜类商品第一。传统的农业操作习惯使得辣椒在收获、加工及运输过程中极易受到霉菌污染[1]。霉菌污染不仅会降低辣椒品质,且在一定条件下,某些霉菌会产生高稳定性的真菌毒素,一般的烹饪方法难以消除[2],这对喜好摄入辣椒产品人群的食品安全问题构成了巨大威胁。
真菌毒素目前已成为世界上最重要和最热点的食品安全问题之一,黄曲霉为好氧型腐生真菌,其产生的黄曲霉毒素为1类致癌物[3]。常见的有黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)和黄曲霉毒素G2(aflatoxin G2,AFG2)4 种结构,其中AFB1毒性最强,其具有肝毒性、免疫毒性、神经毒性和致畸性[4]。联合国粮农组织资料显示,全球每年约有25%的农作物因真菌毒素污染而被销毁,其中香辛料也为真菌毒素易污染的食品,一些组织和国家相应出台了限量标准以降低由于香辛料摄入黄曲霉毒素对人类所构成的潜在健康风险。欧盟规定香辛料中AFB1和黄曲霉毒素总量最高限量值为5 µg/kg和10 µg/kg[5]。美国规定食品中黄曲霉毒素限量为20 µg/kg[6]。在中国,除胡椒外,绿色食品香料及其产品中AFB1和黄曲霉毒素总量的最高限量为5 µg/kg和10 µg/kg[7]。尽管这些监管措施能有效阻止受真菌毒素污染的香辛料进入消费市场,但对进入市场流通及消费环节的香辛料,污染了霉菌后极可能在适宜的环境条件下继续生长并产生毒素,因此,采用环境因子控制黄曲霉的继续繁殖生长及毒素代谢累积,对保障辣椒粉的食品安全具有重要社会意义。
预测微生物学是20世纪80年代初起始的一门交叉性学科,它通过构建数学模型模拟不同培养条件下微生物生长[8]。21世纪以来,随着计算机技术的迅猛发展,针对黄曲霉生长动力学模型的研究渐多[9-10]。Marín等[11]设计了含水量(10%~30%)和温度(10~42 ℃)实验,预测了黄曲霉菌株在开心果中的生长速率及毒素量,结果表明当开心果贮存温度20 ℃、含水量高于10%时,30 d内黄曲霉毒素含量超过欧盟最大限量值。Mousa等[12]模拟了黄曲霉在糙米和精米上的径向生长速率,评估了黄曲霉毒素与水分活度(aw,0.82~0.92)及温度(12~42 ℃)的关系,结果表明线性Arrhenius-Davey模型拟合预测优于Polynomial模型,且糙米较精米更利于菌株生长及毒素产生。本研究以辣椒中分离的产毒黄曲霉菌为研究对象,对不同温度、aw及pH值条件下辣椒粉中黄曲霉菌的径向生长变化及黄曲霉毒素累积量进行分析,采用Baranyi and Roberts模型构建生长动力学初级模型,对比二阶多项式模型、Arrhenius模型和三阶多项式的生长拟合效果,构建黄曲霉菌的二阶多项式产毒动力学模型。旨在为辣椒及辣椒粉生产、贮运等环节中的环境因素控制及保障食品安全提供参考依据。
1 材料与方法
1.1 材料与试剂
干辣椒购于超市,粉碎后过40 目标准筛,4 ℃冷藏备用。
AFB1、AFB2、AFG1、AFG2标准品 美国Sigma公司;乙腈(色谱纯) 德国Merck公司;氯化钠、磷酸氢二钠、磷酸二氢钾、氯化钾(均为分析纯)中国上海国药化学试剂有限公司;氯霉素 上海卡努生物科技有限公司;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB) 北京奥博星生物技术有限责任公司;真菌基因组DNA提取试剂盒 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
JYL-A070万能粉碎机 济南九阳有限公司;IS128 pH计 上海仪迈仪器科技有限公司;DYY-6C电子天平北京市六一仪器厂;SB-5200DT超净工作台 哈尔滨市东联公司;86-1霉菌培养箱 上海福玛实验设备有限公司;Aqualab Pawkit水分活度仪 美国Meter公司;LC-10AT高效液相色谱仪 日本Shimadzu公司;荧光检测器 美国Waters公司;Cloversi-C18色谱柱 瑞典Akzo Nobel公司;IAC-SEP®黄曲霉毒素总量免疫亲和柱中检维康生物技术有限公司。
1.3 方法
1.3.1 黄曲霉菌的分离与纯化
取15.0 g辣椒样品放入盛有135 mL无菌水的锥形瓶中,封口后,将锥形瓶置于100 r/min的恒温摇床中,振荡20 min。随后,梯度稀释,取各稀释度的菌悬液100 μL均匀涂布到含1‰氯霉素的PDA平板上,28 ℃培养4 d。挑取菌落形态不同的菌株反复纯化,直到得到单一菌株。
1.3.2 黄曲霉菌分子生物学鉴定
基因组DNA提取:单一菌落接种于PDB培养基中,28 ℃、120 r/min摇床培养3 d,按照试剂盒说明提取各菌株DNA。
聚合酶链式反应(polymerase chain reaction,PCR)扩增:采用通用引物ITS1/ITS4扩增菌株ITS序列。引物序列为ITS1:5’-TCCGTAGGTGAACCTGCGG-3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’。反应体系为ddH2O 6.0 μL、ITS1/ITS4引物各1.0 μL、PCR Supermix 10.0 μL、基因组DNA 2.0 μL。扩增程序:94 ℃预变性5 min;94 ℃变性1 min;55 ℃退火1 min;72 ℃延伸1 min;扩增循环36 次,72 ℃终延伸10 min。反应结束后取7 μL PCR产物进行1.5%琼脂糖凝胶电泳检测。
琼脂糖凝胶电泳检测:电泳时间20 min、电压120 V、电流300 mA、功率250 W。回收PCR产物,由生工生物工程(上海)股份有限公司进行测序,拼接结果经Nucleotide BLAST核酸比对,选取序列相似度最高的菌株作为鉴定结果。
1.3.3 黄曲霉菌产毒力检测
黄曲霉菌株以单点点植法接种于3 个PDA平板上,28 ℃培养7 d。用打孔器分别在每个板的菌落中心、中间及边缘各取2 块带琼脂块的菌落,并转移至装有6 mL色谱纯甲醇的离心管中。涡旋振荡5 min后,3 500 r/min离心3 min,上清液即为待测液。
1.3.4 色谱条件
Cloversi-C18色谱柱(150 mm×4.6 mm,5 μm);流动相甲醇-水(45∶55,V/V);流速1.0 mL/min;荧光检测器,激发波长360 nm,发射波长440 nm;进样体积20 μL。
1.3.5 标准溶液的配制
黄曲霉毒素(AFB1、AFB2、AFG1和AFG2)标准溶液:分别称取适量标准物质溶于色谱甲醇中,配制成含量分别为1.0、2.0、4.0、20.0、100.0 µg/kg和200.0 µg/kg的混合标准储备溶液,于4 ℃避光保存。
1.3.6 实验设计
采用温度为20、28、37、45 ℃,aw为0.85、0.90、0.93和0.97及pH值为4.5、5.0和5.5的环境因子设计,监测黄曲霉在辣椒粉中的生长及产毒量。
1.3.7 孢子悬液制备
将黄曲霉菌株接种于PDA培养基,28 ℃培养5 d后,在超净工作台内用无菌水冲洗菌落,4 层脱脂棉纱布过滤掉菌丝,使用血球计数板对孢子悬浮液进行计数,并用无菌水调整至105CFU/mL用于接种。配制的孢子悬液保存于4 ℃冰箱中。
1.3.8 生长基质
称取5.0 g辣椒粉于9 个盛有45 mL蒸馏水的锥形瓶中(3 个平行),充分涡旋振荡,用HCl/NaOH溶液将提取液pH值分别调整为4.5、5.0和5.5,并记录使用量,根据各个pH值水平的平均使用量计算后续添加量。以初始含水量(5.48±0.31)%(干基)、aw0.645±0.027、pH 5.1±0.07的空白辣椒粉为生长基质。为确保无霉菌污染,于24 个1 L锥形瓶中分别装入275 g辣椒粉,121 ℃高压灭菌20 min。根据辣椒粉的吸附等温线计算各aw应加水量,水量减去各pH值水平下应加HCl/NaOH溶液量作为实际加水量,最终得到3 个pH值和4 个aw组合的辣椒粉。混合后样品贮存于4 ℃冰箱3 d,每间隔6 h混匀一次,以使辣椒粉充分达到平衡,最终的aw由水分活度仪测定。
1.3.9 接种及菌落生长测定
将辣椒粉无菌移至培养皿(每瓶24 个皿),压实形成单层。接种10 µL孢子悬液至每皿中心。在3 个pH值水平下随机抽取12 个aw相同的平板放入无菌塑封带,袋内有装有特定甘油水溶液烧杯,以保持容器中大气的相对湿度与辣椒粉的aw相同。装有培养皿的塑封袋放置在4 个不同温度水平的培养箱中。连续25 d采用电子数字卡尺在正交方向上进行直径测量,各条件下6 个平板的均值即为该时刻菌落直径。
1.3.10 黄曲霉毒素检测
培养至第8、16天和25天时,每个培养条件下随机抽取3 个平板检测辣椒粉中的黄曲霉毒素含量,以均值作为最终结果。
1.3.10.1 样品检测
准确称取2.5 g粉碎样品于50 mL离心管中,加入25 mL乙腈-水(80∶20,V/V),以70 r/min速率振荡30 min后,3 500 r/min离心3 min。槽纹滤纸过滤上清液至10 mL离心管中后,取3 mL滤液加入27 mL 5%吐温-20的磷酸盐缓冲液(pH 7.4)混匀,调节pH值至7,用玻璃纤维滤纸过滤。将IAC-SEP®黄曲霉毒素总量免疫亲和柱连接于20 mL玻璃注射器下,准确移取滤液20 mL注入玻璃注射器中,将空气压力泵与玻璃注射器连接,调节压力使溶液以1~2 滴/s的速率通过亲和柱,直至空气吹出柱内全部液体,再用10 mL超纯水以1~2 滴/s淋洗亲和柱直至空气吹出柱内全部液体。最后用1.0 mL色谱级甲醇以1~2 滴/s的流速淋洗亲和柱,将全部淋洗液收集于玻璃试管中,涡旋混匀,待测。色谱条件与1.3.3节黄曲霉菌产毒力检测部分所用条件相同。
1.3.10.2 精密度
采用10 µg/kg混合标准溶液测试仪器的精密度,每3 h进样一次进行仪器的日内精密度测量,同一时间点连续5 d进样测量仪器日间精密度。
1.3.10.3 加标回收
空白辣椒粉中加入2.0、4.0、20.0 µg/kg混合标准溶液,每个水平平行测定6 次。
1.4 数据处理
数据用Excel 2010、Origin 9.1以及Design Expert 8.0软件进行相关计算与绘图。
1.4.1 黄曲霉菌生长模型拟合
1.4.1.1 初级模型拟合
采用Baranyi and Roberts弹性生长函数进行黄曲霉菌生长的非线性回归拟合,其模型如下[13]:
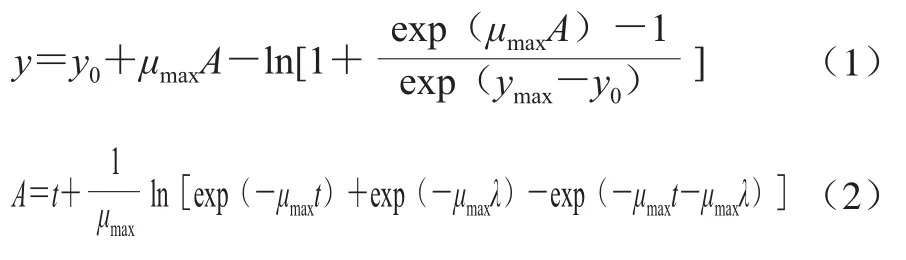
式中:y为菌落半径/mm;y0为初始菌落半径/mm;ymax为最大菌落半径/mm;μmax为菌落最大径向生长率/(mm/d);λ为滞后期/d;t为时间/d。
1.4.1.2 二级模型拟合
用修正的二阶多项式模型、Arrhenius-Davey模型及三阶多项式模型拟合温度、aw及pH值对菌落生长速率(μ)的影响[14-16]。
1)二阶多项式模型
为获得更优拟合效果,对aw作如下变换[17]:

则二阶多项式模型变为:

式中:T为温度/℃;aw为水分活度;pH为酸碱度;a0~a9为非线性回归估计系数。
2)Arrhenius-Davey模型
将pH值引入Arrhenius-Davey方程后,表达式如下:
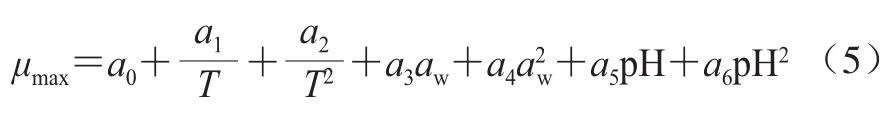
式中:T为温度/℃;aw为水分活度;pH为酸碱度;a0~a6分别为非线性回归估计系数。
3)三阶多项式模型

式中:T为温度/℃;aw为水分活度;pH为酸碱度;a0~a10为非线性回归估计的系数。
1.4.2 黄曲霉毒素产生量模型拟合
采用二阶多项式方程进行温度、aw及pH值对黄曲霉毒素产生量的影响描述。拟合模型具有如下形式[16]:

式中:Aflatoxins为黄曲霉毒素总量/(µg/kg);T为温度/℃;aw为水分活度;pH为酸碱度;t为培养时间/d;a0~a14为非线性回归估计的系数。
1.4.3 模型验证与评价
设计重复实验,用同样的方法,将28、37 ℃实验条件下辣椒粉中黄曲霉菌的实际生长速率及产毒量与所建立动力学模型的预测值进行比较分析,进行模型有效性和可靠性的验证。采用Ross[18]提出的偏差因子(Bf)、准确度因子(Af)及均方根误差(root mean square error,RMSE)评价构建模型性能。

式中:n为观察值数量;DF为自由度。
Bf、Af及RMSE是评估数学模型常用数学指标[19]。Bf越接近1,表明模型预测值与观察值越相符。Af表示预测值与观察值间的平均偏差,Af=1,表明所有预测值和观察值均相等;Af值越大,该模型预测的平均精确度越低。RMSE反映预测值与观察值的离散程度,RMSE值越小,表示测量精度越高。
2 结果与分析
2.1 黄曲霉菌株鉴定
黄曲霉菌株培养5 d后呈现出黄绿色,并产生分生孢子(图1)。琼脂糖凝胶电泳结果表明该菌株在600 bp左右出现特异性条带。NCBI核酸数据库中编号为MN511742.1的黄曲霉ITS区段DNA序列与未知菌株的同源性为99.83%(578/579),比较得分为1 064 bits,随机搜索概率为0.0。因此,认定该菌株为黄曲霉菌。高效液相色谱法测得该菌株此时的产毒量为51.4 µg/kg。

图1 黄曲霉菌在PDA培养基上的菌落形态Fig.1 Colonial morphology of Aspergillus flavus in PDA medium
2.2 吸附等温线
由图2可见,同一温度下辣椒粉的平衡含水量随aw的增加而上升,aw低于0.5时,吸附等温线上升平缓,aw高于0.5时,随aw增加平衡含水量增长加快。根据曲线趋势可判定辣椒粉吸附等温线为第III型等温线,与花生壳/仁吸附等温线类型一致[20]。
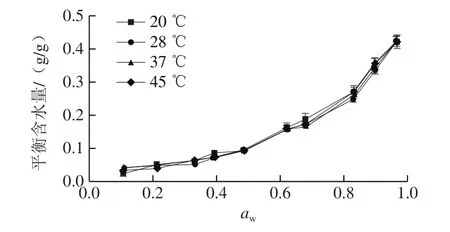
图2 辣椒粉不同温度下的吸附等温线Fig.2 Moisture sorption isotherms of chili powder at different temperatures
2.3 初级生长模型构建
不同温度、aw及酸碱度组合下,黄曲霉菌的最大径向生长速率如表1所示。从培养条件观察,本实验中最大径向生长速率随温度的升高先增大后减小,最适温度为28~37 ℃;aw与菌株生长率呈正相关,aw为0.97时达最大;pH值对菌株生长影响较小。在温度28 ℃、aw0.97、pH 4.5时,最大径向生长速率最大(11.73 mm/d),大于黄曲霉在黑胡椒(7.25 mm/d)、水稻(6.51 mm/d)的生长数据,这可能是由于培养基差异造成菌株碳氮利用率及糖代谢速度不同所致[21]。此外,温度在20~37 ℃范围之外,或温度适宜但aw小于0.90时,黄曲霉菌株生长较缓。温度低于20 ℃、aw小于0.85或温度高于45 ℃时,黄曲霉菌不生长。

表1 不同温度、aw和酸碱度下黄曲霉菌最大径向生长速率Table 1 Maximum radial growth rates of A.flavus under different temperature, water activity and pH conditions
2.4 二级生长模型构建
用3 种不同模型量化了黄曲霉生长对环境变量的响应。标准误差、测定系数(R2)及RMSE如表2所示。可见二阶多项式模型的R2值最高(0.991),RMSE值最小(0.069),其次为三阶多项式模型和Arrhenius-Davey模型,表明修正的二阶多项式模型能更好地描述温度、aw及pH值对生长速率的影响。图3为二阶多项式模型的预测结果响应面图,反映出pH值对最大径向生长速率的影响可忽略不计,这可能是因为本实验选取的酸碱度范围较小所致;曲率出现在25~35 ℃范围,表明辣椒粉中黄曲霉菌的最适生长温度为此温度,与小麦粉中霉菌的研究结果类似[22];由aw分析,菌株最大径向生长速率随aw的增加而增大,谷物中也存在aw越高,真菌生长越快的规律[23],相关研究已证实真菌的最适aw为0.974~0.987[24]。此外,温度和aw显著影响辣椒粉中黄曲霉菌生长,此协同作用在其他霉菌中同样被观察到[25-26]。

表2 黄曲霉菌生长二级动力学模型的估计参数Table 2 Estimated parameters of the secondary kinetic model for A.flavus growth

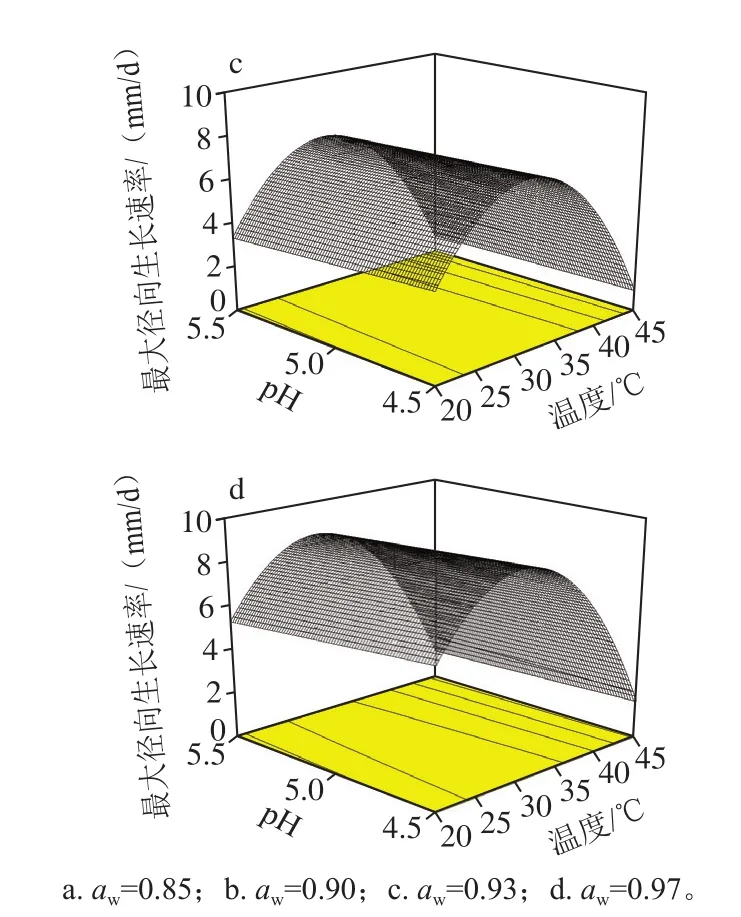
图3 二阶多项式模型预测对黄曲霉菌最大径向生长速率影响的响应面图Fig.3 Response surface plots for the second-order polynomial model predicting the effect of temperature, water activity and pH on the maximum radial growth rate of A.flavus
2.5 黄曲霉毒素产生量模型构建
AFG2、AFG1、AFB2、AFB1平均保留时间分别为(10.165±0.1)、(11.598±0.1)、(12.865±0.1)min和(14.932±0.1)min(图4)。表3为标准曲线的线性回归方程,相关系数R2均大于0.999 8,表明标准曲线线性良好。检出限和定量限分别由3 倍信噪比和10 倍信噪比计算得到[27]。本研究黄曲霉毒素的检出限在0.14~0.21 µg/kg之间,定量限在0.47~0.70 µg/kg之间。日内精密度和日间精密度实验相对标准偏差(relative standard deviation,RSD)在0.3%~1.6%范围之内(表4),表明该仪器稳定性良好、可靠性高。黄曲霉毒素在低、中、高3 个水平的加标回收率在82.6%~117.0%之间,RSD为2.8%~8.3%(表5),说明该方法可靠。
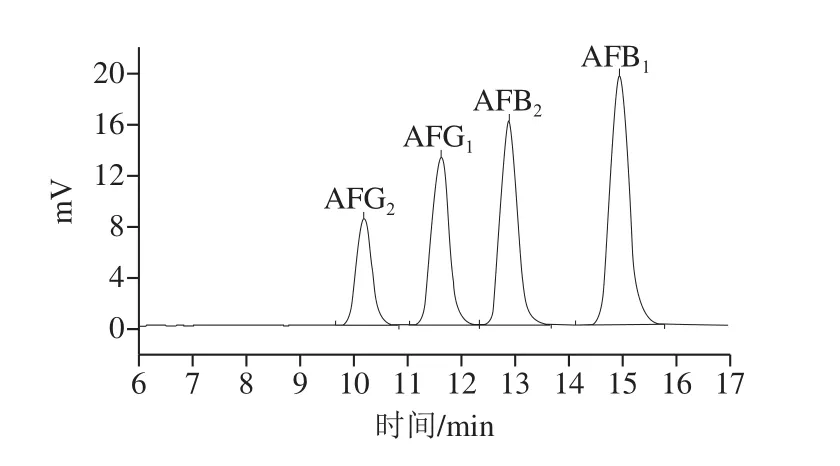
图4 AFG2、AFG1、AFB2、AFB1标准色谱图Fig.4 Chromatograms of AFG2, AFG1, AFB2 and AFB1 standards

表3 黄曲霉毒素回归方程、相关系数及线性范围Table 3 regression equations, correlation coefficients and linear ranges for aflatoxin

表4 仪器日内精密度和日间精密度(n=5)Table 4Intra-day precision and inter-day precision of the instrument (n= 5)

表5 辣椒粉中黄曲霉毒素加标回收率Table 5 Spiked recoveries of four aflatoxins in chili powder
不同环境条件下培养8、16、25 d辣椒粉中黄曲霉毒素产生量见表6,共分析到AFB1、AFB2和AFG2三种真菌毒素。由表6可知,随培养时间延长,毒素累积量急剧增加。在温度28 ℃、aw0.97、pH 4.5时黄曲霉毒素总量最高,达到143.65 µg/kg,远高于其在PDA培养基的产毒量[28]。由毒素种类看,AFB1的检出量远高于AFB2和AFG2。应用二阶多项式方程描述辣椒粉中黄曲霉毒素总量黄曲霉毒素与培养条件的关系,结果见表7,R2为0.976、RMSE为0.598,拟合效果良好。方差分析结果表明,pH值对黄曲霉毒素的影响不显著,但温度和aw对黄曲霉毒素影响极显著,这一结论与黄曲霉菌株生长规律一致。温度一方面调控着黄曲霉菌三羧酸循环、脂肪酸生物合成、糖代谢、氨基酸代谢等初级代谢途径,另一方面也影响着黄曲霉毒素生物合成路径上相关酶的表达[29]。轻度胁迫能引发黄曲霉毒素的产生,但温度过低(25 ℃)则阻抑毒素转录合成过程,温度过高(37 ℃)则抑制部分结构基因的表达[30-31]。水分含量也通过调控黄曲霉菌株的生长发育及次级代谢影响着黄曲霉毒素的生物合成[32]。
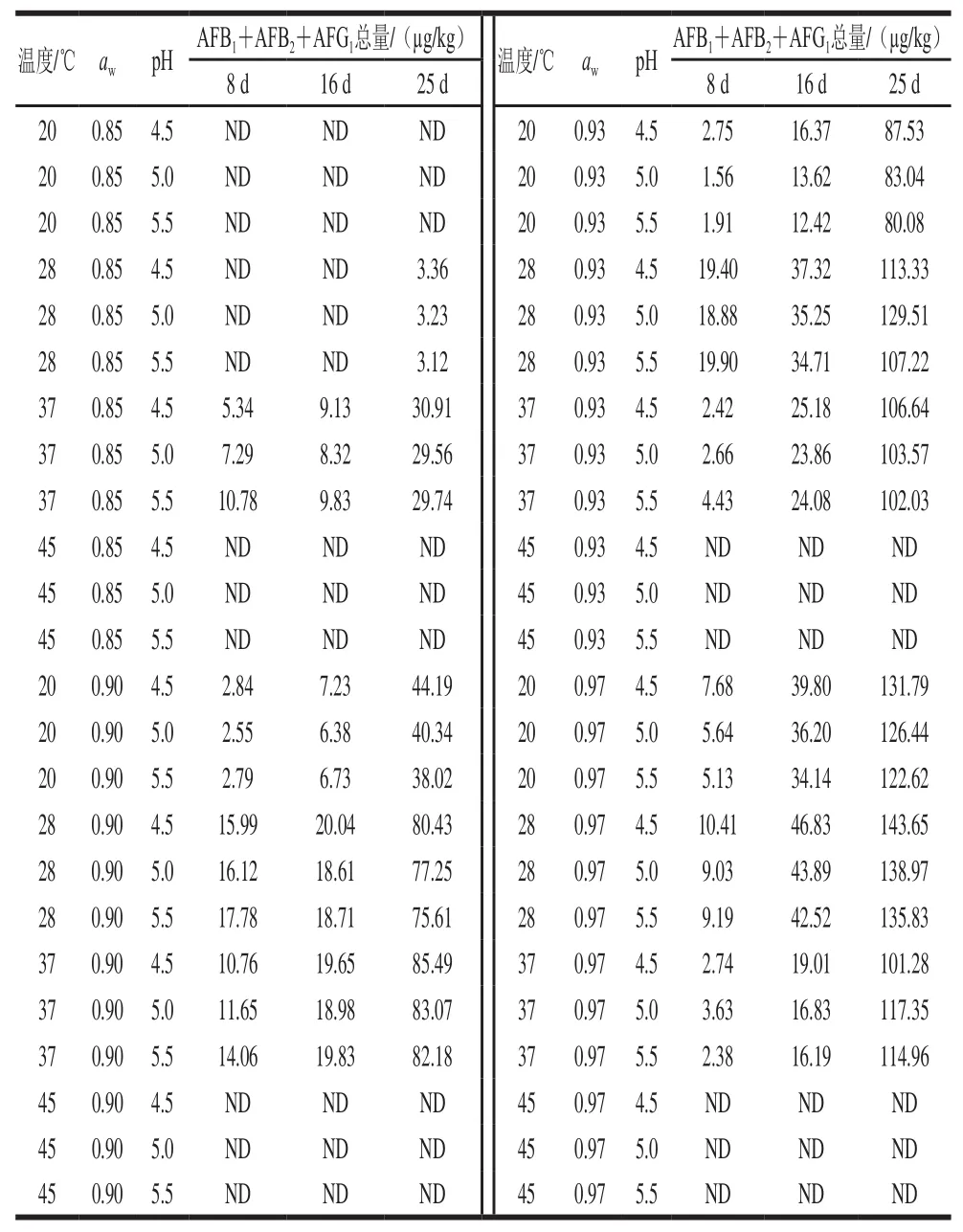
表6 不同温度、aw、酸碱度及培养时间下辣椒粉中黄曲霉毒素含量Table 6 Contents of aflatoxin in chili powder under different conditions of temperature, water activity, pH and culture time
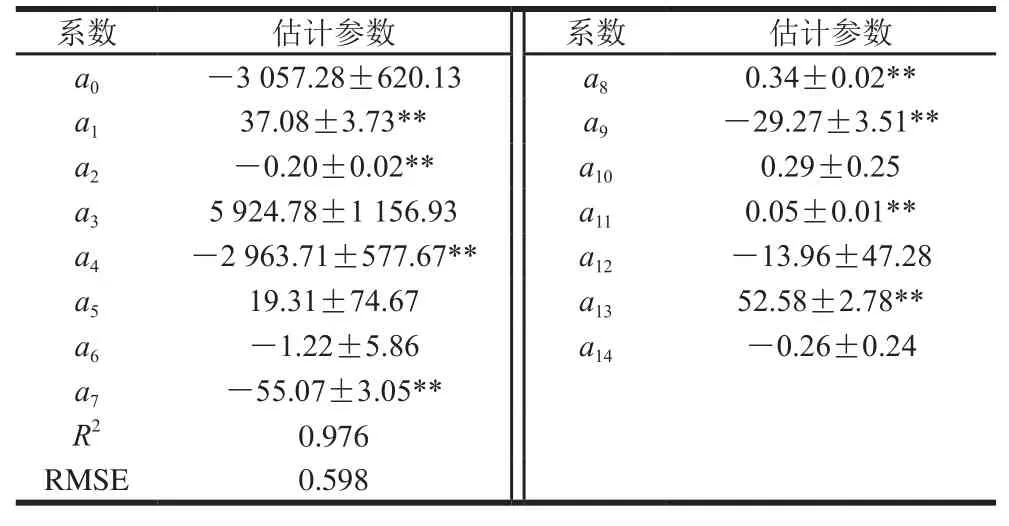
表7 二阶多项式模型拟合黄曲霉毒素动力学的估计参数Table 7Estimated parameters of the second-order polynomial model for aflatoxin production
2.6 模型验证与评价
表8由Bf、Af及RMSE三个方面评价了辣椒粉中环境因子对黄曲霉菌生长及产毒量模型预测的能力,通常而言,Bf值在0.70~1.15,Af值在1.10~1.90时模型是可接受的[33]。修正的线性二阶多项式模型的Bf为1.077 0,Af为1.131 9,RMSE为0.094 3。与Arrhenius-Davey模型和三阶多项式模型相比,Bf和Af更接近于1,3 个模型的RMSE相差无几,因此,本研究修正的线性二阶多项式模型更优地预测了环境因子对辣椒粉中黄曲霉比生长速率的影响,这一研究结果在玉米基质中也得到了证实[34]。此外,二阶多项式模型能较好地描述辣椒粉中黄曲霉菌株产黄曲霉毒素的规律,数学验证结果显示,Bf和Af分别为1.120 7和1.171 2,RMSE为0.128 7。图5二阶多项式模型的预测值与观察值形成的数据点均匀分布在等价线两侧,显示出较优的相关性,进一步证实了上述模型预测结果。
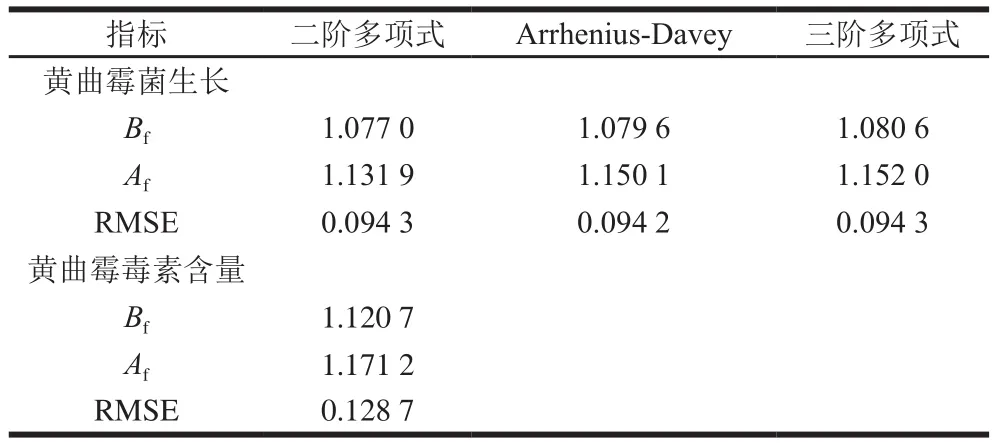
表8 辣椒粉中黄曲霉生长及黄曲霉毒素含量预测模型评价Table 8 Evaluation of the models for the growth of A.flavus and aflatoxin production in chili powder

图5 黄曲霉最大径向生长速率(a)和黄曲霉毒素含量(b)观察值与模型预测值验证Fig.5 Comparison of observed maximum radial growth rates of A.flavus (a) and aflatoxins (b) with model predicted values
3 结 论
本研究对环境条件温度、aw及pH值对辣椒粉中黄曲霉菌生长及黄曲霉毒素产生量的综合影响构建了预测模型,二阶多项式模型表现出良好的整体性能,可作为可靠的预测模型。结果表明,温度28 ℃、aw0.97、pH 4.5时,辣椒粉中黄曲霉菌的生长速率和产毒量均达到最大。温度和aw显著影响菌落的生长和毒素产生,温度28 ℃、aw<0.85或温度>45 ℃的条件下菌株未能生长,在此条件下贮藏辣椒粉可有效避免黄曲霉菌生长及黄曲霉毒素产生,可为辣椒粉的安全储藏及进一步加工提供可供借鉴的基础数据,同时为延长辣椒粉的货架期提供理论依据。

