高分辨熔解曲线技术在筛查21羟化酶缺乏症患者热点基因突变中的临床应用价值*
张新杰,徐晓薇,王朝,王学韬,吕玲,蔡春泉,舒剑波
(天津市儿童医院&天津大学儿童医院a.儿科研究所,b. 内分泌科,天津 300134)
先天性肾上腺皮质增生症(congenital adrenal hyperplasia ,CAH)是一种常染色体隐性遗传病,其中最为常见的是由CYP21A2基因缺陷引起的21 羟化酶缺乏症(21-hydroxylase deficiency,21-OHD),占比高达90%~95%。在2019年上海浦东召开的临床遗传学高峰论坛上,各专家均呼吁重视罕见病基因携带者的筛查。早期的筛查可降低新生儿死亡率、减少因女婴外生殖器男性化而造成的性别误判,同时改善其生长发育。因此,针对人群中21-OHD患者及携带者的CYP21A2致病基因热点突变筛查具有重要意义。
21-OHD患者可根据其临床表型分为失盐型、单纯男性化型、非经典型3种。在失盐型中最常见的基因突变位点为CYP21A2基因I2G和 p.Q319X位点,在单纯型中最常见的位点为I2G和p.I173N位点[1-5]。本研究建立的高分辨熔解曲线(high resolution melting curve, HRM)主要针对c.293-13A/C>G(I2G)、c.518T>A(p.I173N)、c.955C>T(p.Q319X)以及c.1069C>T(p.R357W)突变进行筛查。该技术具有高灵敏度,可检测出基因中单个碱基的差异,并能初步识别DNA片段中的序列变体,目前已被成功应用于多种遗传病的基因突变检测,包括地中海贫血、Rett综合征、Klinefelter综合征[6-8]等。然而,其应用于检测CYP21A2基因突变的相关报道少见[9]。本研究采用HRM技术筛查21-OHD患者CYP21A2基因突变,报道如下。
1 材料与方法
1.1研究对象 收集2009年1月至2014年12月于天津市儿童医院内分泌科门诊就诊或内分泌病房住院且未经过临床治疗的21-OHD患者15例,其中男7例,女8例,年龄(2.6±2.7)岁。各患者21-OHD特异性实验室检查指标——血浆17-羟孕酮(17-OHP)的浓度为(143.3±96.5)ng/mL。同时排除非21-OHD引起17-OHP升高的11-羟化酶缺陷症、P450氧化还原酶缺陷症、17-羟基脱氢酶缺陷症及17,20-裂解酶缺陷症等。另收集同期保健门诊就诊的体检健康儿童30例作为健康人对照组,其中男21例,女9例,年龄(6.4±2.2)岁。本研究经天津市儿童医院医学伦理学委员会审核批准(No.2016021),各研究对象及家属均知情同意。
1.2主要仪器及试剂 LightCycler®480高通量实时荧光定量PCR系统(美国Roche公司),凝胶成像仪(美国Bio-Rad公司),NanoDrop2000超微量紫外分光光度计(美国Thermo公司)。Forget-Me-NotTMEvaGreen qPCR Master Mix(美国Biotum公司),血液基因组DNA提取试剂盒(Genomic blood DNA mini kit,北京康为世纪公司),TaKaRa LA Taq酶(北京宝生物公司)。
1.3方法
1.3.1标本采集及基因组DNA的提取 采集21-OHD患儿就诊时或住院时(体检健康者于体检时采集)的空腹静脉血0.5 mL,EDTA-K2抗凝,采用血液基因组DNA提取试剂盒提取全血基因组DNA,NanoDrop2000超微量紫外分光光度计测定DNA的浓度和纯度,取DNA吸光度(A260/280 nm)值在1.8~2.0之间,浓度为15~65 ng/μL的样本用于后续试验。DNA样本置于-20 ℃保存。
1.3.2引物设计及普通PCR扩增CYP21A2基因 参考文献[10]中的引物序列及PCR反应条件进行PCR反应。ME008上游引物序列:5′-GCTTCTTGA
TGGGTGATCAAT-3′,退火温度56.5 ℃;ME066下游引物序列:5′-CTCAATCCTCTGCAGCG-3′,退火温度61.1 ℃,产物片段大小 3 400 bp。 PCR总反应体系为25 μL,包括20 μmol/L上、下游引物各0.5 μL,2.5 mmol/L dNTPs Mixture 2 μL, 2×La PCR bufferⅠ 12.5 μL,125 U LA Taq酶 0.25 μL,模板DNA 1.5 μL,无菌ddH2O补足体积至25 μL。反应条件:95 ℃预变性5 min;95 ℃ 30 s,65 ℃ 30 s(每个循环温度降低1 ℃),72 ℃ 2 min,10个循环;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,35个循环,整个PCR反应共计45个循环;72 ℃ 10 min。取扩增产物2 μL,经20 g/L琼脂糖凝胶电泳,采用凝胶成像仪扫描并拍照。
1.3.3DNA测序及序列分析 将部分扩增所得的PCR产物送至苏州金唯智生物科技公司进行Sanger测序。测序结果用Chromas2 .6.4序列分析软件分析并与GenBank中NCBI参考序列(NC_000006.12,NM_000500.7)进行比对分析。
1.3.4HRM引物设计与合成 应用Primer Premier 5.0软件对CYP21A2基因各突变位点所在区域进行HRM引物设计。本次研究共设计了3对用于HRM检测的引物,其中c.955和c.1069共用同一对引物。所有的HRM引物均委托苏州金唯智公司合成,并采用tPAGE方式纯化,见表1。

表1 HRM技术的特异性引物
1.3.5HRM检测所用反应条件及结果分析 PCR 反应总体积为20 μL,包括 10 μL 预混液(2×PCR Mix)、10 μmol/L正、反向引物各1 μL,1 ngCYP21A2基因DNA模板。PCR反应条件:95 ℃预变性5 min,95 ℃ 变性30 s,60 ℃ 退火10 s,72 ℃延伸10 s, 共45个循环。HRM熔解曲线分析条件:95 ℃ 1 min,40 ℃ 1 min,数据收集从65 ℃~95 ℃,温度上升为1 ℃/s,且每升高1 ℃ 进行25次数据采集,将所获取的数据使用 LightCycler®480高通量实时荧光定量PCR系统进行熔解曲线和差异图分析。为排除单次实验的随机误差,将所有经过测序的突变型样本进行3次重复检测,计算CYP21A2基因4个突变位点相应突变型的熔解Tm值的变异系数(coefficient of variation,CV)。
1.3.6统计学分析 数据分析采用SPSS 26.0统计软件。
2 结果
2.121-OHD患者CYP21A2基因突变结果分析 对15例21-OHD患者的CYP21A2基因进行测序,并对其突变位点进行统计分析,结果见表2。在15例患儿中有9例为单一位点的纯合突变,另外6例均携带2个不同位点的杂合突变。
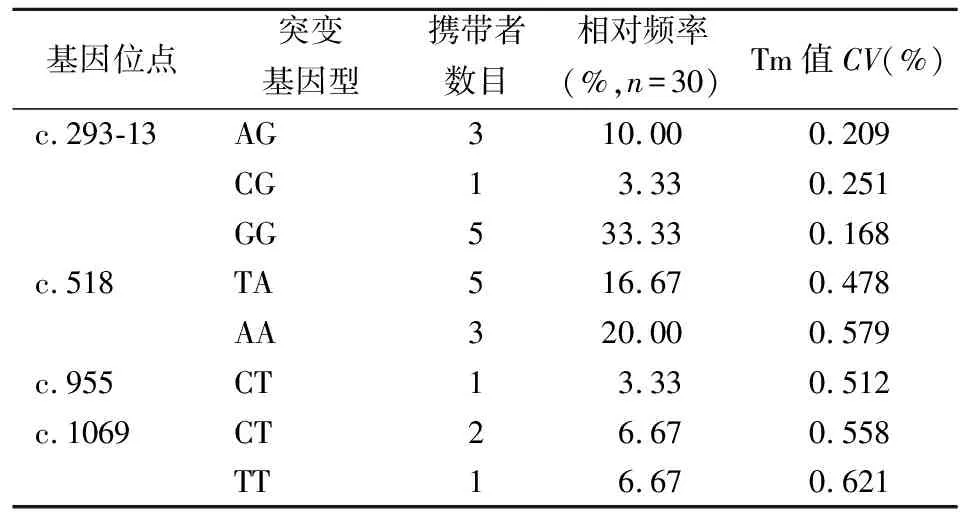
表2 CYP21A2基因4个突变位点相关统计结果
2.2CYP21A2基因在c.293-13位点的PCR-HRM分析结果 针对CYP21A2基因上的c.293-13位点所建立的HRM分析方法能较好地区分致病位点的基因型,该位点是1个多态性位点,AA和CC均为野生基因型,用30例已经完成基因测序的健康人样本进行方法验证,没有发现突变型,其典型的基因测序图和差异熔解曲线见图1。

注:A,c.293-13野生CC基因型;B,c.293-13野生型AA基因型;C, c.293-13纯合突变基因型; D, c.293-13杂合突变A>G基因型;E, c.293-13杂合突变C>G基因型;F, c.293-13位点的差异熔解曲线;箭头示突变位点。
2.3CYP21A2基因在c.518位点的PCR-HRM分析结果 应用上述方法对CYP21A2基因上c.518位点进行HRM分型检测,其典型的基因测序图和差异熔解曲线结果见图2。
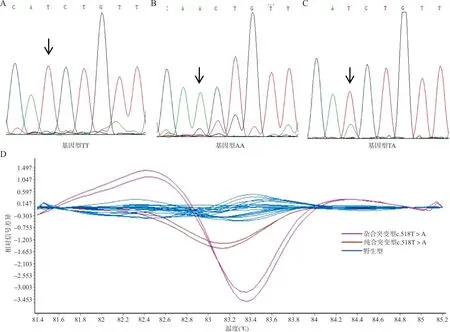
注:A,c.518野生TT基因型;B, c.518纯合突变基因型;C, c.518杂合突变T>A基因型; D, c.518位点的差异熔解曲线;箭头示突变位点。
2.4CYP21A2基因在c.955和c.1069位点的PCR-HRM分析结果 将CYP21A2基因中c.955C>T和 c.1069C>T这2个位点置于同一片段中,应用上述方法进行HRM检测,其典型的基因测序图和差异熔解曲线结果见图3。
3 讨论
为了保证HRM能准确地检测21-OHD的致病基因CYP21A2,本研究应用PCR技术进行了初步扩增。Tusié-Luna等[11]和Prado等[12]报道在距离CYP21A2基因30 000 bp的位置上存在1个与之高度同源的假基因CYP21A1P,且这2个基因在外显子区和内含子区的同源性分别高达98%和96%。故而,在本研究中应用PCR技术初步扩增CYP21A2基因特异性地排除假基因的干扰显得尤为重要。本研究进一步将c.955C>T和c.1069C>T这2个相近位点设计在同一段PCR片段上进行扩增,突变位点在PCR产物中的位置并没有影响HRM技术扫描分析的准确性,真正起影响作用的是PCR扩增产物的长度,这与Reed等[13]的报道相似。本研究建立的CYP21A2基因HRM分析方法能很好地区分突变型与野生型的标本,Tm值CV均较低,为后续临床分析提供了一定的技术支持。
HRM是一种快速、可行、廉价且易于使用的方法。根据笔者经验,相对于Sanger测序14元/样品的成本,HRM检测可以将每个患者的成本降低至3元/样品,且其结果可以在半个工作日内获得,而Sanger测序需要1~2个工作日。此外,如Jones等[14]报道的低水平的等位基因嵌合如果只通过基因测序手段极容易被漏检,而HRM的检测原理是基于核酸分子的基本特性,故能很好地避免这个问题。因此,将HRM用于大规模基因突变筛查及基因分型对于拥有大量患者的实验室极具吸引力。

注:A,c.1069野生CC基因型;B, c.1069杂合突变C>T基因型;C, c.1069纯合突变基因型; D, c.955野生CC基因型;E, c.955杂合突变C>T基因型;F, c.1069和c.955位点的差异熔解曲线;箭头示突变位点。
HRM在21-OHD临床检测中也具有广泛的应用策略。据21-OHD临床实践指南总结[15],典型21-OHD的发病率依国家和地区的不同约为1∶14 000~1∶18 000。因此,在人群中大规模快速筛查高频致病突变,辅助完善21-OHD的基因突变谱研究十分必要。此外,在临床特殊群体如多囊性卵巢综合症(PCOS)患者中,利用本研究中的HRM检测方法也具有重要的应用价值。Livadas 等[16]曾报道PCOS与非经典型CAH具有相似的临床特征,如高雄激素血症、多毛症、排卵和月经功能障碍等。仅凭临床表现区分该2种疾病是有一定难度的,对具有这类症状的患者,鉴别诊断PCOS和非经典型先天性肾上腺皮质增生(CAH)是正确治疗的关键。Moran等[17]曾报道在育龄女性和患有高雄激素血症的女性群体中,PCOS患病率较非经典型CAH升高40~50倍;Legro等[18]也建议,应该在高风险人群中,包括具有PCOS相应症状的女性中筛查非经典型CAH。所以,在基数略大的PCOS患者中利用本研究所建立的HRM检测方法进行21-OHD基因筛查具有良好的应用前景。本研究建立的针对CYP21A2基因致病突变HRM的检测方法适合在高危人群或临床可疑患者中进行筛查,为后期对于21-OHD的流行病学调查提供了一种有效和便利的手段,具有较高的临床应用价值。
本研究的局限性及不足之处在于目前HRM主要应用于致病基因已知的单基因遗传病的突变筛查,报告受测基因序列中多存在1个或多个变异,因而不能完全取代基因测序。特别是针对CYP21A2基因上致病的嵌合重组以及大片段缺失,仍需要结合多重连接依赖探针扩增技术(MLPA)进行检测。但它确实可将测序工作缩减为在HRM检测阳性后的确证和对精确突变或多态性的最终诊断。此外,本研究中建立的HRM检测方法未包含全部CAH的常见致病变异位点,这也是我们后续进一步研究的方向。

