CYP2C19、CYP2D6基因多态性与精神分裂症患者氯氮平代谢的关联研究*
张婷,张阳东,饶庆敏,林裕龙
(1.广州医科大学附属脑科医院检验科,广州510370;2.火箭军特色医学中心中心实验室,北京100088)
细胞色素P450药物代谢酶(CYP)2C19和CYP2D6作为细胞色素P450第二家族中重要的代谢酶,参与了人体内众多的药物代谢途径。该2个酶的编码基因均存在多态性,不同的基因型可不同程度影响酶的活性。其中CYP2C19常见的等位基因有3种:*1、*2和*3,CYP2C19*1/*1为快代谢型,CYP2C19*1/*2 和CYP2C19*1/*3为中间代谢型,CYP2C19*2/*2、CYP2C19*2/*3和CYP2C19*3/*3为慢代谢型。在亚洲人群中较为常见CYP2D6等位基因有*1、*2、*4、*10和*41,其中CYP2D6*1、*2为快代谢型等位基因,*4、*10和*41基因均可使编码的CYP2D6酶活性减弱,携带*4、*10和*41中1种等位基因的杂合体为中间代谢型,携带*4、*10和*41中1种等位基因的纯合体或同时携带功能降低等位基因的杂合体为中低代谢型[1]。
氯氮平(Clozapine,CZ)是一种新型的抗精神分裂症药物,其锥体外系反应等不良反应较少[2]。CZ在临床上治疗精神分裂症的有效率为30%~60%[3-4],效果较为显著,因此,目前已成为抗非典型精神分裂症重要的备选药物。CZ在体内的主要代谢产物为去甲氯氮平(Norclozapine,NCZ)。研究显示,维持剂量持续服用CZ 2周后,血药浓度可达到稳态,即机体对CZ的吸收速度与消除速度达到平衡[2]。此时,个体NCZ/CZ比值基本恒定,受药物浓度的影响较小,可以作为衡量CZ代谢效率的指标[5]。有学者认为CYP2C19酶和CYP2D6酶是代谢CZ的主要关键酶[5-6]。导致CZ个体间药物代谢差异的主要遗传因素是CYP2D6*10等位基因和CYP2C19缺陷等位基因(*2,*3),这些等位基因在中国汉族人群中普遍存在。CYP2C19或CYP2D6慢代谢者服用CZ后血药浓度更高,将有可能增加严重不良反应的发生率。目前,CYP2C19和CYP2D6对CZ代谢的影响仍存在许多争议[7],这可能和种族、人群、地域和饮食的差异有关。本研究旨在探讨CYP2C19、CYP2D6基因多态性与CZ代谢的相关性,为进一步完善CZ个体化用药提供依据。
1 材料与方法
1.1研究对象 收集2018年1月至2019年6月广州医科大学附属脑科医院精神科住院的224例精神分裂症患者,男163例,女61例,年龄(44.0±15.7)岁。纳入标准:(1)符合《精神障碍诊断和统计手册-Ⅳ》(DSM-Ⅳ)精神分裂症的诊断标准[2];(2)单一服用CZ:初始剂量均为50 mg/d,根据患者实际情况调整剂量至维持剂量,最大维持剂量400 mg/d。服药率为100%,服药依从性良好。排除标准[2]:(1)脑器质性疾病或其他类型精神病;(2)糖尿病、血液病、心血管病、消化道疾病或呼吸道疾病史的患者;(3)有物质滥用史;(4)有吸烟行为的患者;(5)对CZ有严重不良反应,无法耐受400 mg/d CZ维持剂量治疗的患者;(6)近1周内未服用抗精神病药, 6周内未服用长效抗精神病药。本研究经广州医科大学附属脑科医院伦理委员会审核批准(No.AF/SC-02/02.1),各研究对象均知情同意。
1.2仪器与试剂 DNA提取试剂盒(上海百傲科技股份公司),CYP2C19基因与CYP2D6基因多态性实时荧光定量PCR试剂盒(广州海思医疗科技公司),CZ标准品(批号:5-EOD-183-1,深圳凯美科技公司),NCZ标准品(批号:#066M4095,深圳振强生物技术公司),CZ和NCZ内标物(地西泮)(批号:161102,山东信宜制药公司),CZ和NCZ对照品(批号:S1325376,中国药品生物制品研究所)。ABI 7300型实时荧光PCR扩增仪(美国ABI公司),Thermo Evolution 201紫外可见分光光度计(美国赛默飞公司),Agilent 1260高效液相色谱仪(美国安捷伦公司)。
1.3方法
1.3.1标本采集 各研究对象按维持剂量服药2周后,于服药前晨起采集空腹静脉血4 mL,1 000×g离心10 min分离1 mL血清至1.5 mL EP管,用于监测CZ和NCZ血药浓度。另取EDTA-K2抗凝血2 mL,用于CYP2C19和CYP2D6基因多态性检测。无法及时检测的标本置于-80 ℃保存。
1.3.2CZ和NCZ血药浓度检测 取上述1 mL血清加至10 mL离心管中,加入10 μg/mL内标液50 μL,快速振荡。加入提取剂乙酸乙酯与二氯乙烷(80∶20)4 mL,密塞后旋转震荡2 min,2 000×g离心10 min。吸取上清液至5 mL离心管中,置于50 ℃真空箱中干燥。采用Agilent 1260高效液相色谱仪检测CZ和NCZ的血药浓度。进样前加入100 μL流动相溶解药物,快速振荡,吸取15 μL进样。线性范围为50~1 200 ng/mL。
1.3.3DNA提取 取EDTA-K2抗凝血,按DNA提取试剂盒说明书操作提取基因组DNA。使用Thermo Evolution 201紫外可见分光光度计测定DNA的浓度和纯度,取DNA吸光度(A260/280 nm)值在1.8~2.0之间,浓度为5~15 ng/μL的样本用于后续试验。DNA置于-80 ℃保存。
1.3.4实时荧光定量PCRCYP2C19基因多态性PCR总反应体系为25 μL,包括反应液23 μL和模板DNA 2 μL。PCR循环参数:37 ℃ 10 min,95 ℃ 5 min;95 ℃ 15 s,62 ℃ 60 s,共40个循环:并在此阶段结束时使用ABI实时荧光PCR扩增仪自带软件采集荧光信号。结果判读:若该位点为纯合野生型:FAM通道Ct值≤36,VIC通道Ct值>36或无Ct值;若该位点为杂合突变:FAM通道Ct值≤36,VIC通道Ct值≤36;若该位点为纯合突变:FAM通道Ct值>36或无Ct值,VIC通道Ct值≤36。
CYP2D6基因多态性PCR总反应体系为20 μL,包括反应液18 μL和模板DNA 2 μL。PCR循环参数:95 ℃ 10 min;95 ℃ 15 s,65 ℃ 60 s,共45个循环,并在此阶段结束时采集荧光信号。结果判读:当内部控制讯号Ct值<35时,若ΔCt<6,曲线为阳性,若ΔCt>6,曲线为阴性;当内部控制信号Ct值>35时,重新检测样本质量或稀释后复检。若ΔCt介于6~7之间,需重复测试,若重复测试后ΔCt仍介于6~7之间,则需测序确认结果。
按基因型的代谢类型分组及结果判读。基因型为CYP2C19*1/*1分为CYP2C19快代谢型,基因型为CYP2C19*1/*2和CYP2C19*1/*3分为CYP2C19中间代谢型,基因型为CYP2C19*2/*2和CYP2C19*2/*3分为慢代谢型。基因型为CYP2D6*1/*1、CYP2D6*1/*2和CYP2D6*2/*2分为CYP2D6快代谢型;CYP2D6*1/*41、CYP2D6*1/*4、CYP2D6*1/*10、CYP2D6*2/*4、CYP2D6*2/*10和CYP2D6*2/*41分为CYP2D6中间代谢型。基因型为CYP2D6*4/*10、CYP2D6*10/*10和CYP2D6*4/*41分为CYP2D6中低代谢型。
1.4统计学分析 采用IBM SPSS Statistics 20.0软件进行。各组间的年龄、CZ、NCZ、CZ+NCZ及NCZ/CZ比值的比较采用方差分析,各组间性别比较采用χ2分析。采用多因素线性Logistic回归方程分析性别、年龄、CYP2C19代谢型和CYP2D6代谢型与CZ代谢的关联。以P<0.05为差异有统计学意义。
2 结果
2.1各精神分裂症患者CYP2C19和CYP2D6的基因频率CYP2C19与CYP2D6不同代谢类型的224例精神分裂症患者性别和年龄等具体数据见表1。CYP2C19等位基因*1、*2和*3的基因频率分别为62.3%、33.9%和3.8%。CYP2D6等位基因*1、*2、*4、*10和*41的基因频率分别为22.3%、11.8%、0.7%、61.2%和4.0%。

表1 不同CYP2C19和CYP2D6基因频率在各代谢组的性别和年龄比较
2.2CZ、NCZ血药浓度及NCZ/CZ比值在剂量调整过程中的变化规律 224例受检对象中,有98例在初始剂量至维持剂量的药物剂量增加过程中检测了3次CZ和NCZ的药物浓度,结果发现,首次剂量、2次剂量和3次剂量这3组间的CZ、NCZ和CZ+NCZ差异均有统计学意义,而3组间NCZ/CZ的比值差异无统计学意义。见表2。

表2 98例患者CZ剂量增量过程中的血药浓度及NCZ/CZ比值
2.3CYP2C19、CYP2D6代谢类型与CZ代谢的相关性
2.3.1CYP2C19、CYP2D6代谢类型与CZ代谢的关联 将患者分别按照CYP2C19代谢类型和CYP2D6代谢类型分组,各组CZ、NCZ、CZ+NCZ总浓度及NCZ/CZ比值见表3。结果表明,患者按CYP2C19代谢类型分组后,快代谢型、中间代谢型和慢代谢型的NCZ/CZ比值差异有统计学意义,且快代谢型和中间代谢型均显著高于慢代谢型(P<0.01)。

表3 各代谢组CZ、NCZ、CZ+NCZ及NCZ/CZ比值
2.3.2CYP2C19与CYP2D6基因组合协同分析NCZ/CZ比值 在同一CYP2C19代谢类型中各组CYP2D6代谢型间的差异均无统计学意义(P>0.05)。见表4。

表4 CYP2C19与CYP2D6基因组合协同分析NCZ/CZ比值*
2.4多因素线性回归分析结果 分别以CZ、NCZ、NCZ+CZ、NCZ/CZ比值为因变量,性别、年龄、CYP2C19代谢型和CYP2D6代谢型为自变量,进行多因素线性回归分析。CZ线性回归方程为CZ=649.36-147.77性别-4.60年龄(F=50.54,P<0.01);NCZ线性回归方程为NCZ=234.28-68.7性别-1.30年龄-39.64CYP2C19慢代谢型(F=46.83,P<0.01); NCZ+CZ线性回归方程为NCZ+CZ=883.64-216.44性别-5.90年龄-92.12CYP2C19慢代谢型(F=54.72,P<0.01);NCZ/CZ线性回归方程为NCZ/CZ=0.33-0.01性别-0.01年龄-0.01CYP2C19慢代谢型(F=7.11,P<0. 01);各多因素线性回归方程模型均有统计学意义。见表5。
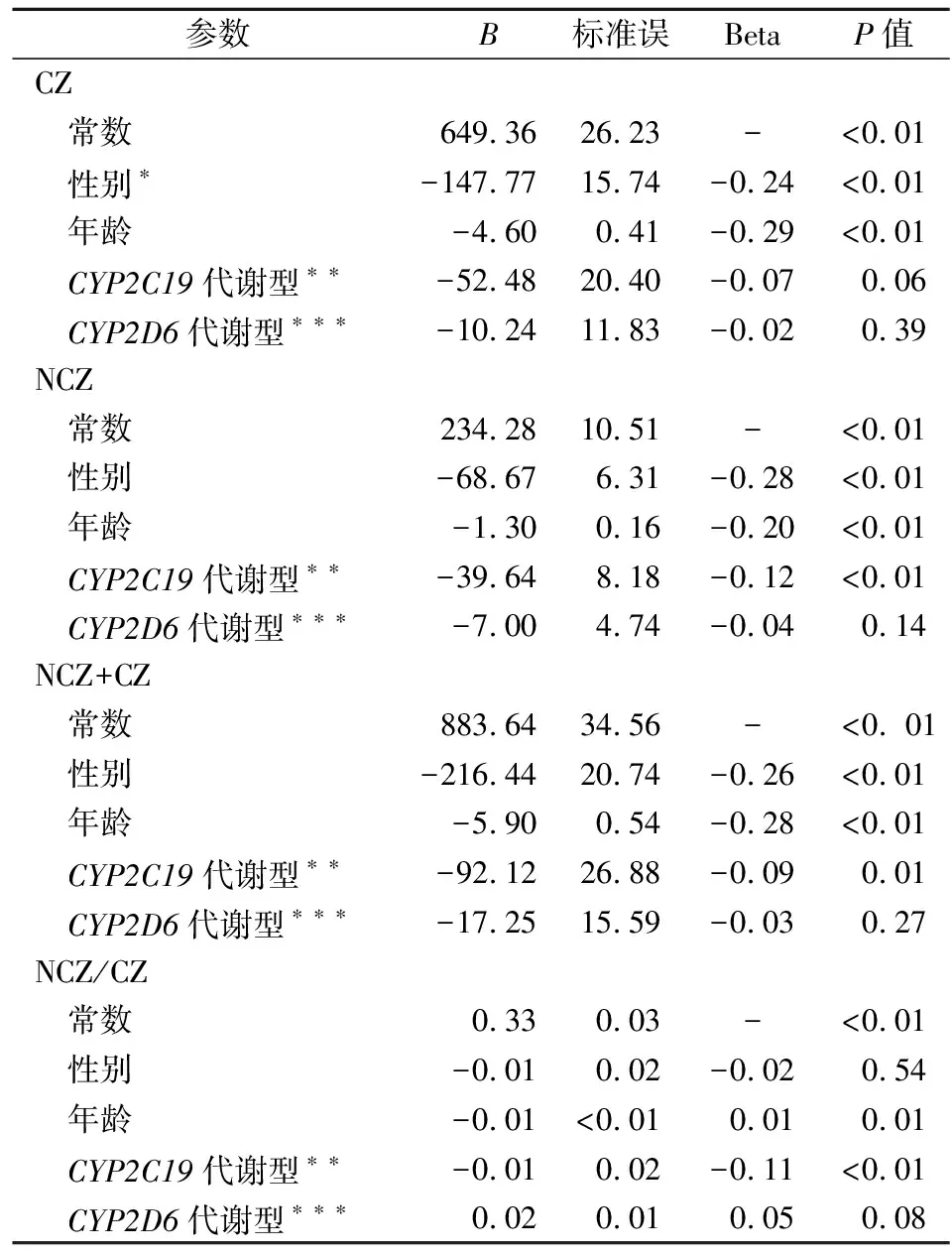
表5 多因素线性回归方程模型
3 讨论
本研究检测了224例服用CZ的精神分裂症患者的CYP2C19基因型、CYP2D6基因型以及维持治疗后的CZ和NCZ的血药浓度,并分析CYP2C19基因、CYP2D6基因与CZ代谢的相关性。本次研究患者的维持剂量一致、单一服用CZ、年龄性别均衡、均无吸烟行为,可以排除药物剂量、药物相互作用、年龄性别、吸烟行为对药物浓度的影响。患者近1周内未服用抗精神病药,6周内未服用长效抗精神病药,可以排除既往用药对CZ和NCZ血药浓度的影响。患者CYP2C19和CYP2D6等位基因分布与人群等位基因分布基本一致[8-10],故而,也排除基因型分布对结果造成的影响。98例患者在药物剂量调整过程中的血药浓度的动态监测结果显示,虽然不同药物剂量调整阶段药物浓度有明显的差异,但NCZ/CZ比值没有显著差异。因此,NCZ/CZ比值作为衡量CZ代谢速率的主要分析指标,可以忽略不同患者用同一维持剂量治疗可能导致的药物浓度差异的影响。
224例患者中CYP2C19慢代谢型的NCZ浓度、CZ+NCZ总浓度及NCZ/CZ比值均低于CYP2C19快代谢型和CYP2C19中间代谢型(P<0.05),可以推测CYP2C19参与CZ的代谢,CYP2C19慢代谢型基因引起酶活性下降,导致CZ代谢能力显著降低,使NCZ的生成减慢,致使NCZ/CZ比值降低[3,6]。以CYP2D6代谢类型分组,CYP2D6快代谢型、中间代谢型和中低代谢型的CZ浓度、NCZ浓度、CZ+NCZ总浓度及NCZ/CZ比值差异均无统计学意义(P>0.05)。为了进一步证实CYP2D6对CZ代谢的影响,笔者比较了同一CYP2C19代谢型中不同CYP2D6代谢类型的NCZ/CZ比值。结果显示,在同一CYP2C19代谢型基因中,不同代谢类型CYP2D6的NCZ/CZ比值差异均无统计学意义(P>0.05),提示CYP2D6酶对CZ代谢影响不显著[7,11]。多因素回归分析显示,女性、高龄和CYP2C19慢代谢型与NCZ/CZ比值呈负相关,提示女性、高龄患者的CZ代谢率下降,与文献[12]结果一致;CYP2C19代谢酶对CZ代谢影响显著,而CYP2D6代谢酶可能不参与CZ代谢,与上述分析结果一致。也有文献发现了不一样的研究结论,其认为CYP2C19酶不参与CZ的代谢[11],或者认为CYP2D6酶是影响CZ代谢中的关键酶之一[5,13]。这可能是由于CYP2C19基因和CYP2D6基因在种族和人群的分布差异或饮食习惯等不同所致。
临床上由CZ血药浓度过高引起的严重不良反应包括:心肌炎、粒细胞缺乏和麻痹性肠梗阻等[6]。为了避免这些严重不良反应,需为患者制定个体化的用药方案。虽然CZ在治疗精神分裂症时可依据药物浓度、疗效和不良反应来确定个体的维持剂量,但这些指标的使用存在滞后性。因此,在CZ的临床用药中,CYP2C19基因型是需要密切关注的基因型之一。临床医生可以根据CYP2C19代谢类型适当调整用药剂量,为患者选择合适的维持剂量的同时,使患者在治疗中获得较好的疗效。

