miRNA-21-5P在食管鳞癌患者中的鉴别诊断价值
张国玲,吴贺明,郭莲怡
(1.锦州医科大学第一附属医院消化内科,辽宁锦州121000;2.中国人民解放军联勤保障部队第968医院放射科,辽宁锦州121000;3.朝阳市中心医院消化内科,122000)
食管癌是多基因、多阶段、多因素共同作用于机体而产生的结果,目前认为是致癌基因与抑癌基因结构及功能异常并不断累积的过程。食管癌发病原因尚不明确,中国临床肿瘤学会(CSCO)2020年食管癌诊疗指南为我国临床食管癌的诊疗提供了规范和标准[1],但临床上对于食管癌的诊断与筛查仍难以实现早期发现与治疗。
微小RNA(microRNA,miRNA)在调控蛋白质编码过程中具有重要作用[2]。通过mRNA可以调节人体各种组织中蛋白质的表达水平,1个miRNA可以配对多个基因,不同miRNA也可以调控同一基因[3]。研究表明,人类30%~50%的基因受到miRNA调控,在人类生长发育和疾病的发生、发展过程中起着重要调节作用[4]。Guo等[5]研究发现,miRNA表达谱在食管癌组织中存在显著差异。另有学者发现,miRNA-21-5p (miR-21-5p,has-mir-21-5p)主要存在于17q23.1,且与消化道肿瘤的进展相关,其推测miR-21-5p或可作为食管癌检测的潜在肿瘤标志物[6]。本研究旨在检测miR-21-5P在食管鳞癌患者血清及组织标本中的表达水平,评估miR-21-5P鉴别诊断食管鳞癌的临床效能。
1 材料与方法
1.1研究对象 收集2019年12月至2020年3月于朝阳市中心医院消化内科就诊的食管鳞癌患者50例作为疾病组,其中,男32例,女18例,年龄(51.0±3.7)岁。纳入标准:均经病理组织学证实为食管鳞癌,且按照2020中国临床肿瘤学会(CSCO)食管癌诊疗指南[1]明确诊断。未经任何治疗或药物干预。排除诊断:(1)怀孕或哺乳期妇女;(2)任何器官移植史以及现存的功能性移植物(角膜或毛发移植除外);(3)严重疾病史或由其他证据表明为严重疾病或患有任何的疾病使患者不适合参加试验;(4)同时参加其他临床研究试验的患者。另收集同期消化内科就诊的胃镜、病理组织学共同诊断为食管炎(反流性食管炎、药物等损伤所致食管炎等)患者20例作为相关疾病对照组,其中,男13例,女7例,年龄(50.2±4.0)岁。本研究经朝阳市中心医院医学伦理学委员会批准(医伦审〔2019〕17号),患者及家属知情同意。
1.2仪器与试剂 Nanodrop 2000超微量分光光度计(美国赛默飞世尔科技公司),AERIS-BGO96 PCR基因扩增仪(新加坡艺恩高科技公司),LightCycler480实时荧光定量PCR分析仪(北京龙跃生物科技发展公司)。miRNA提取试剂盒、miRNA cDNA合成试剂盒、miRNA荧光定量PCR试剂盒(昆明康为世纪公司)。
1.3标本采集 用无抗凝剂的真空管采集食管鳞癌患者及食管炎患者入院时的空腹静脉血5 mL,室温凝固,4 ℃、4 000 r/min离心10 min,取上层血清,置于-80 ℃保存;收集胃镜检查中及手术中食管鳞癌患者癌组织及癌旁组织(距离其超过5 cm处食管粘膜处组织,且经病理组织学证实无癌细胞);胃镜检查中采集食管炎患者组织,置于-80 ℃保存。
1.4RNA提取及逆转录反应 按照miRNA提取试剂盒说明书操作提取各组患者血清及组织中的miRNA,采用Nanodrop 2000超微量分光光度计测定其吸光度,取吸光度(A260/280 nm)值为1.9~2.1的样本用于后续试验,样本置于-80 ℃保存。纯化提取的miRNA,按照逆转录试剂盒说明书将RNA逆转录为cDNA。样本置于-20 ℃保存。
1.5引物设计及荧光定量PCR 根据NCBI中GenBank数据库查询的miRNA-21(NR_029493.1)和U6(NR_004394.1)的基因序列号,采用Primer Express 5.0引物设计软件设计,并送昆明拓源经贸公司合成。miRNA-21-5P上游引物序列:5′-TAGCTTATCAGACTGATGTTGA-3′,下游引物序列:5′-AGTGCGTGTCGTGG-3′[7],退火温度60 ℃,产物片段大小73 bp。U6上游引物序列:5′-CTCGCTTCGGCAGCACA-3′,下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′,退火温度60 ℃,产物片段大小106 bp。按照miRNA qPCR Assay Kit说明书操作进行PCR反应,PCR总反应体系为20 μL,包括:2×miRNA qPCR Mixture(ROX) 10 μL,10 μmol/L上、下游引物各0.4 μL,cDNA 1.0 μL,ddH2O补足至20 μL。在LightCycler480荧光定量PCR分析仪上完成操作。PCR循环参数:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火/延伸1 min,共40个循环。采用LIMS/BarCode软件于60 ℃时收集荧光信号并进行熔解曲线分析,结果以2-△△Ct法计算,实验重复3次。

2 结果
2.12组患者组织及血清miRNA-21-5P的表达水平比较 食管鳞癌组癌组织中miRNA-21-5P的相对表达量为4.36±0.29,显著高于食管炎患者(0.96±0.07),差异有统计学意义(t=27.570,P<0.05)。而癌旁组织中miRNA-21-5P的相对表达量为1.31±0.16,与癌组织比较,差异亦有统计学意义(t=20.100,P<0.05)。此外,食管鳞癌组血清中miRNA-21-5P的相对表达量为3.60±0.09,显著高于食管炎患者(1.01±0.05),2组间差异有统计学意义(t=24.43,P<0.05)。
2.2血清miRNA-21-5P表达与食管鳞癌患者临床病理参数的关系 根据组织学类型分组对比,在低分化组中miRNA-21-5P的相对表达量较中、高分化组均显著升高,差异具有统计学意义(P<0.05);根据肿瘤浸润的深度分组对比,T3~T4组miRNA-21-5P相对表达量较T1~T2组显著升高,差异具有统计学意义(P<0.05);根据肿瘤组织大小分组对比,淋巴结有转移组的miRNA-21-5P相对表达量较淋巴结无转移组显著升高,差异具有统计学意义(P<0.05);根据TNM分期分组对比,miRNA-21-5P相对表达量在TNM分期Ⅲ~Ⅳ期组显著高于Ⅰ~Ⅱ期组,差异具有统计学意义(P<0.05)。见表1。
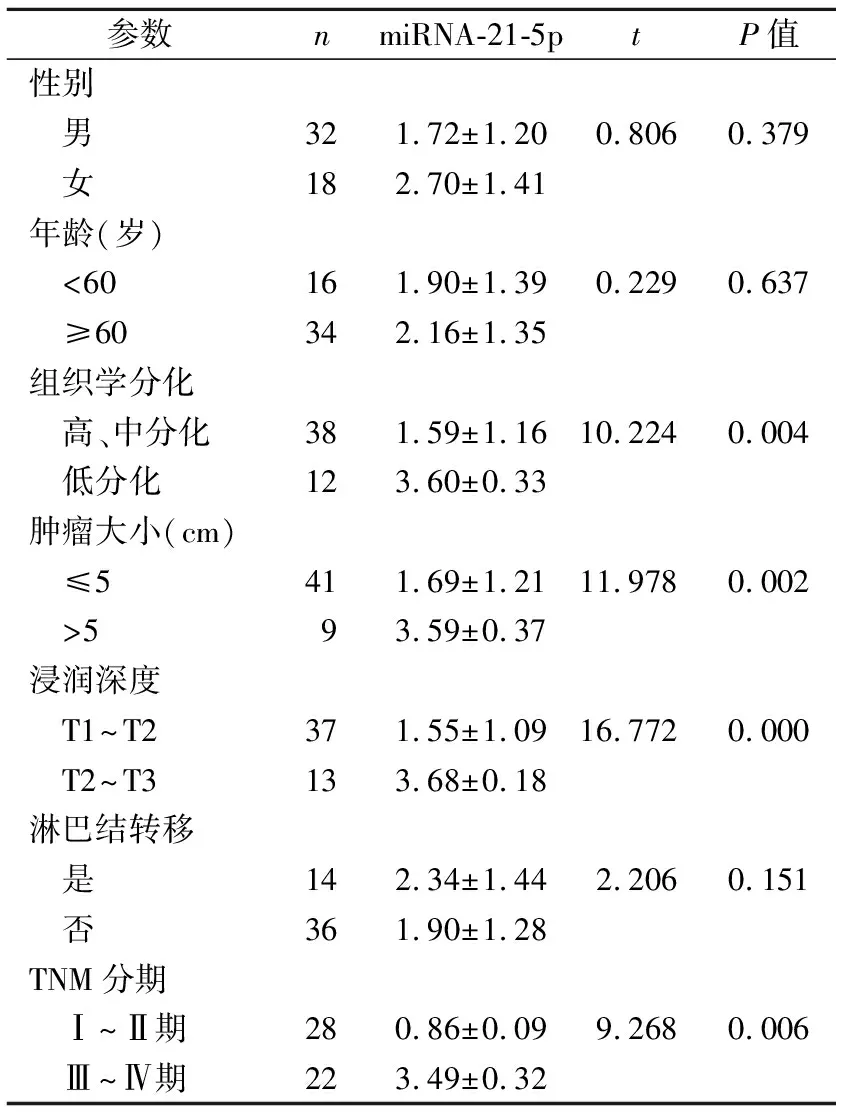
表1 miRNA-21-5p的表达与食管鳞癌患者临床病理参数的关系
2.3ROC曲线评估组织及血清中miRNA-21-5P的表达对食管鳞癌鉴别诊断的价值 以食管鳞癌患者作为疾病组,食管炎患者作为对照组,ROC曲线分析结果显示,组织中miRNA-21-5P鉴别诊断食管鳞癌的ROC曲线下面积(AUCROC)为0.767(95%CI:0.650,0.859),当cut-off值为0.39时,其敏感性为88%,特异性为75%。血清miRNA-21-5P鉴别诊断食管鳞癌的AUCROC为0.671(95%CI:0.549,0.779),当cut-off值为0.63时,其敏感性为80%,特异性为66%。见图1。

图1 血清及组织中miRNA-21-5P鉴别诊断食管鳞癌的ROC曲线
3 讨论
MicroRNA(miRNA)在调控蛋白质编码过程中具有重要的应用价值,在人类某些肿瘤及炎症[8-9](如血管生成、侵入性、转移和分化)等过程中发挥重要作用。本研究通过检测食管鳞癌患者血清及组织中miRNA-21-5P的表达,结果发现其在食管鳞癌患者血清及组织中的表达水平均显著高于食管炎患者,由此推断食管癌患者血清及组织中miRNA-21-5P表达水平的上调与食管鳞癌的发生密切相关。ROC曲线分析结果显示,组织中miRNA-21-5P鉴别诊断食管鳞癌的ROC曲线下面积(AUCROC)为0.767(95%CI:0.650,0.859),当cut-off值为0.39时,其敏感性为88%,特异性为75%。而血清miRNA-21-5P鉴别诊断食管鳞癌的AUCROC为0.671(95%CI:0.549,0.779),当cut-off值为0.63时,其敏感性为80%,特异性为66%。虽然组织中miRNA-21-5P诊断的敏感性及特异性更佳,但由于血清标本更容易采集,更广泛的应用于临床,有望成为食管癌鉴别诊断的生物学标志物。
食管鳞癌中miRNA-21-5P作用的分子机制目前尚不明确,仍需进一步研究。王燕忠等[10]研究发现,食管鳞癌患者血清中的STAT3是miRNA-21-5p调控的靶基因,并且与食管癌细胞的增殖和凋亡密切相关。本研究中发现,miRNA-21-5p的表达水平与食管癌分化程度、淋巴结转移、浸润程度关系密切,分析原因可能与食管鳞癌发病机制相关。然而,由于本研究纳入的样本数量存在局限性,可能影响临床鉴别诊断的特异性及敏感性。此外,本研究因组织标本采集不便,未纳入健康人对照组,下一步我们将增加健康人对照组,并将地域分布等因素纳入研究中,以期阐明其在食管癌中的发病机制及临床诊断中的作用。

