母体抗SSA/SSB抗体阳性胎儿完全性房室传导阻滞超声表现
李 岩,王清国,耿 斌,秦金霞,帖永新,常凤玲,冯 俊,翟慧萍
(1.新乡市中心医院超声一科,河南 新乡 453000;2.滨州市人民医院超声科,山东 滨州 256603;3.首都医科大学附属北京安贞医院小儿心脏中心,北京 100029;4.新乡市第二人民医院超声科,河南 新乡 453000)
母体抗SSA抗体(anti-Sjögren syndrome A antibody)/SSB抗体(anti-Sjögren syndrome B antibody)经胎盘进入胎儿体内,其所介导的免疫炎症反应可致胎儿免疫性房室传导阻滞(atrioventricular block, AVB),发病率约为1/20 000[1],以Ⅲ度房室传导阻滞最为常见,即完全性房室传导阻滞(complete AVB, CAVB),胎儿心排血量下降、器官供血不足,心率缓慢,如未能及时处理,可致胎死宫内。产前早期诊断胎儿心律失常类型并给予适当治疗、预防心力衰竭发生,对于改善胎儿预后具有重要意义。本研究观察母体抗SSA/SSB抗体阳性CAVB胎儿超声表现。
1 资料与方法
1.1 研究对象 回顾性分析2010年10月—2020年5月7胎于新乡市中心医院经超声诊断为CAVB胎儿,孕妇年龄26~34岁,平均(30.1±2.7)岁;孕周25~30周,平均(28.03±1.73)周;均为单胎妊娠;孕妇无明显临床症状,妊娠前未接受相关检查,妊娠期抗SSA/SSB抗体呈阳性并诊断为干燥综合征而接受相关治疗;其中2名孕妇有不良孕产史。检查前孕妇均签署知情同意书。
1.2 仪器与方法 采用GE Voluson E10和Philips IE33彩色多普勒超声诊断仪,凸阵探头,频率3.5~5.0 MHz。嘱孕妇仰卧,由2名具有5年以上工作经验的超声科医师以二维超声观察胎儿四腔心切面、三血管切面,左、右心室流出道及主动脉弓切面,判断是否存在心内结构异常;以M型取样线检测心房壁、心室壁及二尖瓣的运动情况,观测每个心动周期内心房和心室的搏动节律情况,意见不一时协商达成共识。储存左心室流入道及流出道血流频谱,自二尖瓣A波开始至主动脉收缩期波峰起始点测量PR间期,测量二尖瓣E峰和A峰血流速度,取3个以上心动周期的平均测值作为结果。选取胎儿腹部横切面,于下腔静脉与脐静脉间血流明亮处采集静脉导管(ductus venosus, DV)血流频谱,将脉冲多普勒取样容积置于脐动脉(umbilical artery, UA)与胎盘附着处,获取脐动脉血流频谱;将取样点置于胎儿大脑中动脉(middle cerebral artery, MCA)中段血管,获得连续5个以上血流频谱。记录各血流参数,包括收缩期峰值速度(peak systolic velocity, PSV)、搏动指数(pulsatility index, PI)及阻力指数(resistance index, RI)等。
1.3 跟踪随访 记录孕妇干燥综合征治疗情况、妊娠结局及胎儿预后或转归。
2 结果
7名孕妇血清抗SSA抗体、抗Ro52抗体呈阳性,其中4名抗SSB抗体均呈阳性。
7胎均于孕中或孕中晚期检出CAVB。二维超声见4胎心房壁、房间隔、腱索或二尖瓣环回声增强。7胎心房率范围为139~152次/分,心室率为58~70次/分,存在房室分离。脉冲多普勒显示E峰慢于A峰,A-A间距不等,E、A峰无固定关系。4胎二尖瓣舒张期血流频谱E/A>1,3胎E/A>1或E/A<1。2胎DV血流频谱a波缺失,5胎a波反向(图1)。5胎UA收缩期峰值流速与舒张末期流速比值(S/D)升高,2胎舒张末期血流缺失。7胎MCA血流频谱PI升高(图2),RI值正常。6胎伴有三尖瓣少量反流。7胎均未合并其他心内外结构畸形。见表1。

图1 孕27周+2胎儿(病例1) A.二维超声声像图显示胎儿心脏房间隔、腱索等回声增强(箭); B.胎儿DV血流频谱图示a波反向; C.M型超声声像图显示心房与心室收缩完全分离,心房率152次/分,心室率58次/分; D.脉冲多普勒图示E峰、A峰间隔不等,无固定关系,二尖瓣舒张期血流频谱E峰>A峰
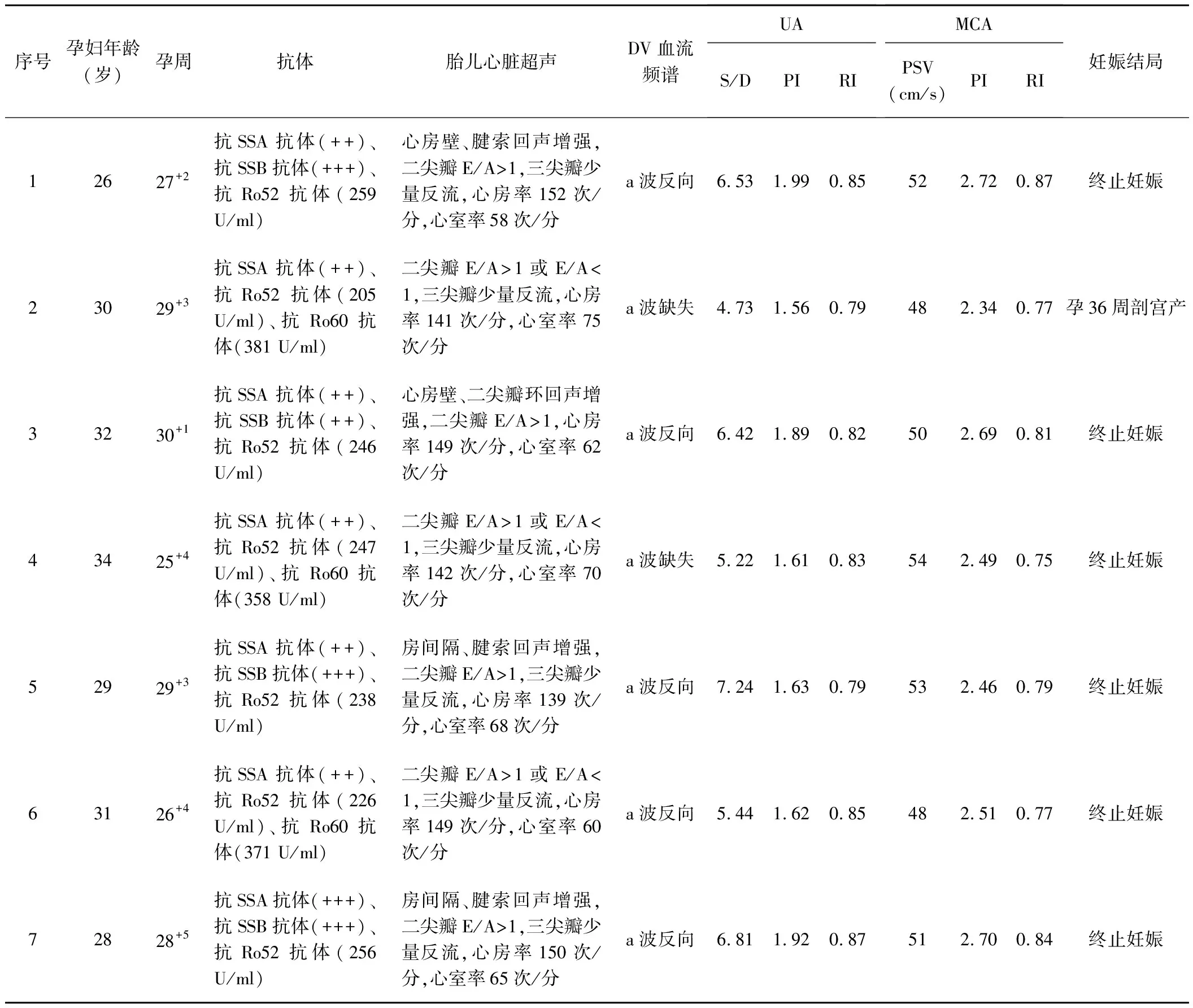
表1 CAVB胎儿一般资料及超声征象
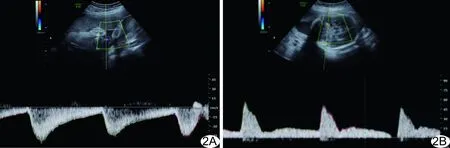
图2 孕29周+3胎儿(病例2) A.UA血流频谱图示S/D增高; B.MCA血流频谱图示PI增高
6名孕妇经住院治疗胎儿心率仍未好转,选择终止妊娠;其中1名(病例1)口服药物治疗1年后再次妊娠,孕期接受药物治疗,未发现胎儿心律失常;1名孕妇(病例2)经治疗后胎儿转为Ⅱ度二型AVB,并于孕36周剖宫产1名女婴,出生后2个月心电图提示心率正常,超声心动图显示心房壁、二尖瓣环等无明显回声增强。
3 讨论
抗SSA抗原是由Ro52和Ro60两种多肽共同构成的核糖核蛋白复合物。既往研究[2]表明,约86%免疫性CAVB胎儿的母体血清抗SSA抗体呈阳性。血清抗Ro52抗体是导致胎儿免疫性AVB的主导抗体,Ro52多肽中的氨基酸p200到p239表位与胎儿发生CAVB关联最为紧密[3-4]。抗Ro52抗体≥50 U/ml与胎儿CAVB、心内膜弹力纤维增生症发生高度相关[4]。除与抗体介导的炎症反应、心肌损伤有关外,胎儿CAVB还可能与抗体影响钙离子通道活性导致心肌细胞内钙离子沉积、心肌细胞功能受损以及凋亡有关。约55%免疫性CAVB胎儿的母体血清抗SSB抗体呈阳性,且多数抗SSA、SSB抗体均呈阳性,仅<1%为单纯抗SSB抗体阳性[5]。本组7名孕妇抗SSA抗体、抗Ro52抗体均呈阳性,抗Ro52抗体水平均≥50 U/ml;其中4名抗SSA、SSB抗体均呈阳性,提示胎儿CAVB与母体抗SSA、Ro52抗体密切相关,与既往报道[2-4]相符。
本组4胎心房壁、房间隔、二尖瓣环或腱索回声增强,提示抗SSA/SSB抗体、补体、纤维化及钙化不仅存在于房室结,还可见于心肌层;抗SSA/SSB抗体所致心肌炎性反应使窦房结功能不良或丧失,同时引起周围组织纤维化而影响心肌收缩功能。NIEID等[6-7]发现约20% CAVB胎儿可发展为心脏瓣膜病、心内膜弹力纤维增生症或扩张型心肌病。
本组7胎心房率为139~152次/分,心室率≤70次/分,心房率快于心室率,心房壁与心室壁机械运动不相关,两者无对应关系;多普勒超声显示7胎E、A峰无固定关系,4胎二尖瓣舒张期血流频谱E/A>1,3胎E/A>1或E/A<1,提示母体抗SSA抗体阳性可致胎儿心房壁、房室瓣环等回声增强,使心肌僵硬度增加,左心房顺应性减低,心肌收缩功能下降[8]。本组1胎出生2个月后心电图提示心率正常,超声显示心房壁、二尖瓣环等无明显回声增强,提示对母体抗SSA/SSB抗体阳性胎儿应密切监测,及早干预可改善胎儿预后。孕12周后母体抗SSA、SSB抗体可通过胎盘传递至胎儿循环,孕18~24周可能造成胎儿心脏传导阻滞[9-10],因此对抗体筛查阳性母体应从孕16周起每周复查胎儿超声,若期间无异常发现,则孕中、晚期可每2周复查。随访中除应关注胎儿心律、心功能外,还应注意有无心脏受累的其他表现,如心内膜、瓣膜病变等;同时建议孕妇应于孕早期接受血清抗体筛查,以便规范化管理。
胎儿DV、UA及MCA血流频谱可反映其血流动力学变化,判断心律失常胎儿宫内状况。DV血流频谱波形主要反映胎儿心房顺应性、血管阻力及心功能变化,正常生理状态下,DV a波保持向心正向运动。本组3胎DV a波缺失,4胎a波反向。胎儿严重心动过缓导致心输出量下降,心功能受损;为对抗前向血流阻力,胎儿心房代偿性收缩,中心静脉压增高,表现为DV a波缺失或反向[11]。UA血流频谱改变可反映胎盘、胎儿及母体的部分病理变化,S/D升高和舒张末期血流缺失提示胎盘—胎儿循环不良,胎儿宫内缺血缺氧,与不良妊娠结局高度相关[12]。本组5胎UA S/D升高,2胎舒张末期血流缺失;结合DV血流频谱判断胎儿缺氧已处于失代偿期,且存在酸中毒、右心衰竭,应立即干预处理。MCA血流频谱可直接反映胎儿颅内血液循环情况,胎儿宫内缺氧时,“脑保护效应”使脑血流量代偿性增加, PI、RI值下降。MORALES-ROSELL等[13]研究发现MCA血流的PI值在妊娠29周达到峰值,约为2.10,随后逐渐下降。本组7胎PI值均远高于2.10,表明胎儿宫内缺氧较重,脑血管调节机制失代偿,PI升高,提示胎儿预后不良。
综上所述,母体抗SSA/SSB抗体阳性可致胎儿CAVB;产前筛查发现孕妇抗SSA/SSB抗体阳性时,应密切监测胎儿心脏及血流动力学变化,早期诊断、及时干预,以减少不良妊娠结局。

