双能CT评估喉部鳞癌分化程度
冯瑶杰,吕艳娥,瞿 姣,李青青,杨亚英,高 洁
(昆明医科大学第一附属医院医学影像科,云南 昆明 650032)
喉癌中,鳞状细胞癌(鳞癌)占90%~95%[1]。喉癌分化程度是影响患者预后的独立危险因素[2],通常分化程度越低,术后复发越快,转移率越高[3],术前评估喉癌分化程度对选择治疗方式及判断预后有重要意义。双能CT可多参数定量分析病灶,对评估病变组织特点及功能状态具有一定价值[4]。既往研究[5-7]应用双能CT评估肿瘤分化程度,而针对喉癌分化程度的研究较少。本研究观察双能CT评估喉癌分化程度的价值。
1 资料与方法
1.1 一般资料 收集2016年9月—2019年11月于昆明医科大学第一附属医院接受术前双能量颈部CT并经手术病理证实的92例喉癌患者,男91例,女1例,年龄36~76岁,平均(57.8±8.0)岁;临床主要表现为声嘶、吞咽或呼吸困难、颈部淋巴结肿大等;临床分期19例Ⅰ期,42例Ⅱ期,21例Ⅲ期,10例Ⅳ期。纳入标准:①于术前2周内接受CT检查,此前未经手术或放射、化学治疗;②临床、影像学及病理学资料完整;③图像清晰。
1.2 仪器与方法 采用Siemens第二代炫速双源CT行喉部常规CT平扫和双能量动脉期及静脉期增强扫描,扫描范围自颅底至颈根部。平扫采用智能最佳管电压(CARE kV)技术及自动管电流调节(CARE Dose 4D)技术模式,管电压100 kV,层厚1 mm,层间距0.7 mm。增强扫描参数:A球管管电压80 kV,管电流255 mA;B球管管电压Sn140 kV,管电流60 mA,螺距0.8,矩阵512×512;应用双筒高压注射器以流率3.0 ml/s经肘静脉注入对比剂碘海醇(350 mgI/m1)1.2 ml/kg体质量,跟注生理盐水30 ml,以对比剂示踪法触发扫描,触发点设于舌骨层面颈动脉内,触发阈值100 HU,分别延迟5 s及25 s行动脉期及静脉期双能量扫描。
1.3 图像分析 由2名具有5年头颈部影像学诊断经验的主治医师以双盲法将动脉期及静脉期80 kV及Sn140 kV薄层图像导入Siemens syngo MMWP工作站进行后处理。选择“Liver VNC”模式获得相应期相碘图,针对显示病变最大层面,分别于病灶及颈内动脉区域放置面积5~15 mm2感兴趣区(region of interest, ROI),尽量避开囊变、坏死、伪影、骨骼、血管及病灶边缘,测量碘浓度(iodine concentration, IC)及碘图CT值(Overlay值),计算其标准化碘浓度(normalized iodine concentration, NIC):NIC=病灶IC/同层面颈动脉IC。选择“Monoenergetic”模式获得单能量图像,并于病灶区域与碘图位置一致放置ROI,得到相应期相40~190 keV能量水平能谱曲线,计算对应期相病灶的能谱曲线斜率λHU:λHU=(CT40 keV-CT100 keV)/60。每个病灶测量3次,以2名医师测量平均值为最终结果。
1.4 统计学分析 采用SPSS 25.0统计分析软件,以Shapiro-Wilk检验对数据进行正态性检验,Levene检验行方差齐性检验。以±s表示符合正态分布的计量资料,行单因素方差分析;两两比较采用Bonferroni检验(方差齐)或Tamhane'sT2检验(方差不齐)。针对差异有统计学意义的参数绘制鉴别不同分化程度喉癌的受试者工作特征(receiver operating characteristic, ROC)曲线,评估其诊断效能。采用Spearman相关检验分析各定量参数与喉癌分化程度的相关性,0≤rs<0.2为相关性极弱或无相关,0.2≤|rs|<0.4为弱相关,0.4≤|rs|<0.6为中等相关,0.6≤|rs|<0.8为强相关,0.8≤|rs|<1.0为极强相关。P<0.05为差异有统计学意义。
2 结果
92例中,31例高分化鳞癌,38例中分化鳞癌,23例低分化鳞癌,均为单发病灶。
2.1 不同分化程度喉癌双能CT相关参数比较 高、中、低分化喉癌动脉期、静脉期双能定量参数总体差异均有统计学意义(P均<0.01)。两两比较,低分化喉癌动脉期及静脉期IC、NIC、Overlay值及λHU均高于高分化喉癌和中分化喉癌(P均<0.05);中分化喉癌静脉期λHU高于高分化喉癌(P<0.05),其余参数与高分化喉癌差异均无统计学意义(P均>0.05)。见表1及图1~3。

图1 患者男,57岁,右侧杓会厌皱襞高分化鳞癌 A、B.动脉期碘图(A)及能谱曲线图(B)示病灶IC、NIC、Overlay值、λHU分别为1.8 mg/ml、0.16、42.3 HU、1.89; C、D.静脉期碘图(C)及能谱曲线图(D)示病灶IC、NIC、Overlay值、λHU分别为2.0 mg/ml、0.48、46.8 HU、2.23
表1 不同分化程度喉部鳞癌双能CT定量参数比较(±s)

表1 不同分化程度喉部鳞癌双能CT定量参数比较(±s)
分化程度动脉期IC(mg/ml)NICOverlay值(HU)λHU静脉期IC(mg/ml)NICOverlay值(HU)λHU高1.91±0.30 0.18±0.03 36.26±6.83 2.05±0.29 2.22±0.33 0.56±0.10 41.34±5.40 2.33±0.31 中2.06±0.290.19±0.0437.77±7.722.21±0.462.35±0.200.57±0.0743.72±5.662.59±0.41∗低2.51±0.63∗#0.22±0.05∗#47.77±13.15∗#2.75±0.56∗#2.72±0.53∗#0.66±0.13∗#48.26±7.78∗#2.99±0.62∗#F值12.2875.19110.23816.69011.1166.3628.37913.058P值<0.0010.007<0.001<0.001<0.0010.003<0.001<0.001
注:*:与高分化鳞癌比较,P<0.05;#:与中分化鳞癌比较,P<0.05
2.2 双能CT定量参数与喉部鳞癌分化程度相关性分析 动脉期IC、λHU及静脉期IC、Overlay值、λHU均与肿瘤分化程度呈中等负相关(rs=-0.51、-0.46、-0.40、-0.43,-0.49,P均<0.05),动脉期NIC、Overlay值及静脉期NIC均与肿瘤分化程度呈弱相关(rs=-0.31、-0.35、-0.27,P均<0.05)。

图2 患者男,45岁,左侧声带中分化鳞癌,累及声门下区 A、B.动脉期碘图(A)及能谱曲线图(B)示病灶IC、NIC、Overlay值、λHU分别为2.0 mg/ml、0.17、44.6 HU、2.39; C、D.静脉期碘图(C)及能谱曲线图(D)示病灶IC、NIC、Overlay值、λHU分别为2.2 mg/ml、 0.61、 59.8 HU、 3.13

图3 患者男,48岁,右侧声门上区低分化鳞癌 A、B.动脉期碘图(A)及能谱曲线图(B)示病灶IC、NIC、Overlay值、λHU分别为2.4 mg/ml、0.21、53.0 HU、3.14; C、D.静脉期碘图(C)及能谱曲线图(D)示病灶IC、NIC、Overlay值、λHU分别为2.6 mg/ml、0.80、54.2 HU、3.29
2.3 双能CT定量参数鉴别不同分化程度喉部鳞癌的效能 ROC曲线显示,动脉期及静脉期IC、NIC、Overlay值及λHU鉴别高分化与低分化鳞癌的曲线下面积(area under the curve, AUC)分别为0.86、0.75、0.79、0.87及0.79、0.70、0.77、0.85;动脉期λHU的诊断效能最高,阈值为2.45时,其诊断低分化鳞癌的敏感度及特异度分别为73.90%及96.80%。动脉期及静脉期IC、NIC、Overlay值及λHU鉴别中分化与低分化鳞癌的AUC分别0.78、0.70、0.76、0.78及0.74、0.71、0.70、0.71;动脉期λHU的诊断效能最高,当λHU阈值为2.40时,其诊断低分化喉癌的敏感度及特异度分别为73.90%及76.30%。静脉期λHU鉴别高分化与中分化鳞癌的AUC为0.70,阈值为2.45时,其诊断中分化鳞癌的敏感度及特异度分别为65.80%及71.00%,见表2。
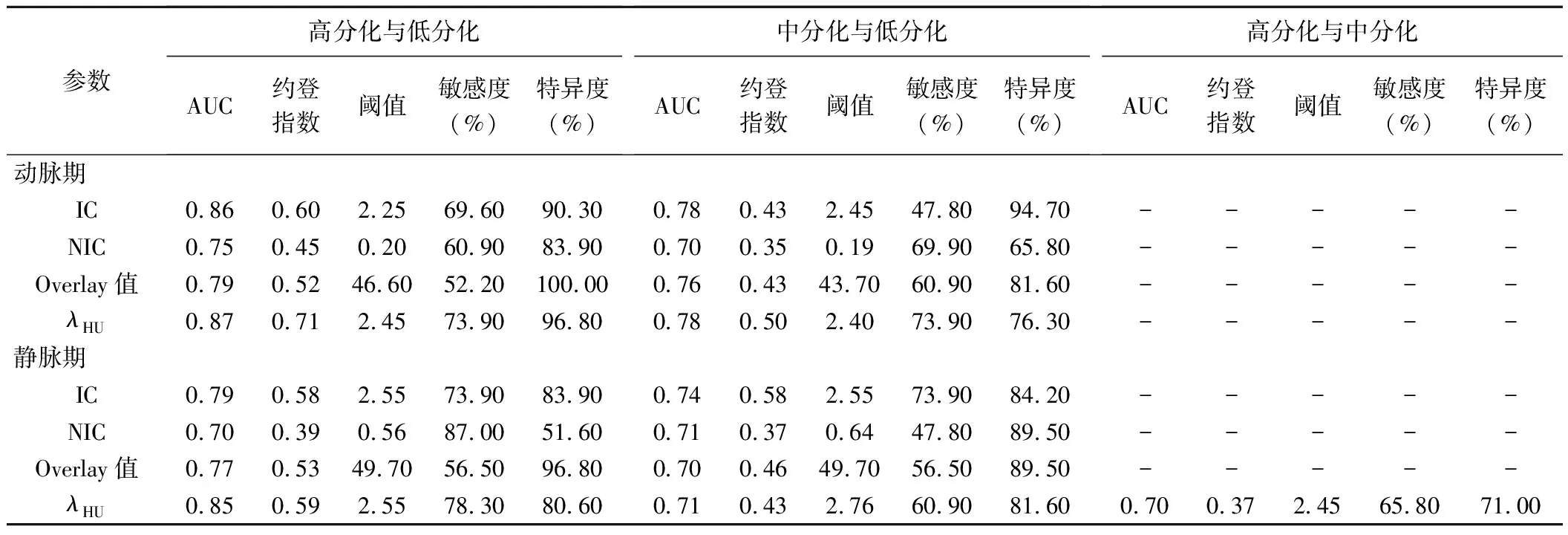
表2 双能CT各参数鉴别不同分化程度喉部鳞癌的效能
3 讨论
喉癌是头颈部最常见恶性肿瘤之一,全球每年约17.7万例新发喉癌病例及9.4万例死亡病例[8],预后与肿瘤分期、淋巴结转移情况、分化程度等密切相关。组织病理学将鳞状细胞癌分为Ⅰ级(高分化)、Ⅱ级(中分化)及Ⅲ级(低分化),中、高分化鳞癌较多,低分化鳞癌相对少见,其生物学行为及预后差异较大,故术前评估肿瘤分化程度对制定治疗方案和评估预后有重要意义[9]。双能CT图像经后处理可得到碘图及能谱曲线,以多参数定量评估病灶特征。本研究喉部鳞癌动脉期及静脉期IC、NIC、Overlay值及λHU均与其分化程度存在负相关,除动脉期NIC、Overlay值及静脉期NIC与分化程度呈弱相关外,其余均呈中等相关,肿瘤分化程度越低,各定量参数数值越大。
本组低分化鳞癌IC及Overlay值高于高分化及中分化鳞癌,中分化鳞癌高于高分化鳞癌,与既往研究[10]结果相符。不同分化程度肿瘤微血管密度不同,喉部低分化鳞癌微血管密度明显高于高、中分化鳞癌[11]。微血管密度反映肿瘤微血管侵袭性,随分化程度减低,微血管密度增大[12]。采用增强CT碘图可直接测量IC及Overlay值,IC反映不同组织的微血管密度,而Overlay值是碘的净增强值,即增强CT与虚拟平扫CT的CT值的差值,二者均可反映肿瘤血管生成、病灶血供状态及分化程度。NIC可降低对比剂剂量、对比剂流速及血液循环等对IC的影响,但本组动脉期及静脉期NIC鉴别中分化与低分化鳞癌、高分化与低分化鳞癌的AUC均小于IC,提示NIC并不能进一步提高鉴别诊断效能,与YANG等[12]的结果相符。另外,本组低分化喉鳞癌动脉期及静脉期IC、NIC、Overlay值均高于高分化及中分化鳞癌,而中、高分化鳞癌上述参数差异无统计学意义,与郭冉等[13]的结果相符,可能与二者细胞分化均相对较好、微血管密度差异不大有关。
双源CT应用两个不同能量且相互垂直的X线球管于一次扫描同时获得高能量和低能量数据,通过后处理重建获得40~190 keV单能量图像,各对应一个CT值,相比常规CT能有效避免射线硬化效应,得到更准确的CT值。不同能量水平下的CT值反映物质在不同keV下的衰减系数,能谱曲线能反映物质CT值随X射线能量改变而变化的特点,以λHU表示。本组以低分化鳞癌λHU最高,其次为中分化、高分化癌,与既往研究[10]结果相符,推测原因在于不同分化程度鳞癌细胞及细胞核异型性不同,X线衰减亦不尽相同,相同范围内碘对比剂含量越高则X线衰减越明显,λHU越大;进一步以ROC曲线评估各参数的鉴别效能,发现动脉期λHU鉴别高、低分化以及中、低分化鳞癌效能较高,提示动脉期λHU有助于鉴别低分化与中、高分化喉癌。
综上所述,双能CT定量参数对评估喉部鳞癌分化程度具有一定价值,以动脉期λHU鉴别低分化与中、高分化鳞癌的效能最高。但本研究为回顾性分析,样本量少;少数病灶较小,难免存在偏差。

