右美托咪定对原代皮层神经元铁死亡相关蛋白BECN1、PBECN1、GPX4、ACSL4 表达的影响
李遥,杨冯睿,梁峰,侯娇艳,杨艳
(南华大学衡阳医学院附属第一医院 麻醉科,湖南 衡阳 421001)
0 引言
铁死亡(FerroPtosis)是近年发现的不同于细胞凋亡以及细胞坏死的一种新的细胞死亡形式。急性脑损伤后,神经元表现出铁死亡相关的分子特征[1]。而且,铁死亡在帕金森综合征、阿尔兹海默症等神经退行性疾病的病理发展中扮演重要角色[2-3]。右美托咪定(Dexmedetomidine,Dex)是临床麻醉中常用的α2肾上腺素受体激动剂,通过抑制交感神经活动发挥镇痛、镇静作用。有研究报道Dex通过JAK2/STAT3途径抵抗神经元凋亡[4]。但Dex的神经元保护作用是否涉及铁死亡过程还未清楚。本研究采用Erastin诱导原代皮层神经元铁死亡,探讨Dex是否能够铁死亡导致的细胞活力丧失,并观察铁死亡相关蛋白BECN1、GPX4、ACSL4的表达情况。
1 资料与方法
1.1 大鼠原代皮层神经元培养。Wistar大鼠由南华大学医学研究实验中心提供。参照Sahu M P[5]等方法进行皮层原代神经元提取及培养。雌性大鼠交配受孕后独立饲养18 d用于皮层神经元提取。大鼠处死后用70%乙醇消毒,然后切开腹腔从子宫中取出胚胎,将胚胎转移到超净工作台,剪下头部并立即转移到4℃的PBS中。在解剖显微镜下分离大脑皮层部分,切成微小块,然后用0.2%(w/v)木瓜蛋白酶(P3125,Sigma)和0.004%(w/v)DNase溶液(D7073,Beyotime)于37℃消化30 min。将收集的细胞计数,然后将其接种到细胞培养瓶,接种密度为106个/mL。每72 h更换一次培养基。培养7 d后用于实验。
1.2 神经元铁死亡诱导及右美托咪定干预处理。将神原代经元细胞重新接种到孔板,继续培养5 d。铁死亡诱导剂Erastin购于Selleck公司,货号为S7242,将Erastin溶于DMSO,终浓度为50μM[6]。右美托咪定(江苏恩华制药)在Erastin处理后1 h加入,终浓度为1μM。培养48 h后进行细胞活力检测和蛋白免疫印迹分析。
1.3 细胞活力检测。将神经元细胞接种到96孔板,将MTT(M8180,Solarbio)粉末溶解在PBS中至终浓度为5 mg/mL,每孔加入20 μL该溶液。在培养箱中孵育3 h后,再加入150 μL DMSO,孵育15 min。将平板在避光的振荡器上搅拌,并测量490 nm处的吸光度。细胞活力以实验孔OD值/空白对照孔OD值表示。
1.4 蛋白免疫印迹。收集药物处理后的神经元用蛋白裂解液(P0013C,Beyotime)裂解,蛋白定量后取50μg蛋白于12%SDS-PAGE凝胶电泳分离,然后转移到PVDF膜上。用5%脱脂牛奶封闭1 h后,加入一抗(GPX4,BM5231,BOSTER;Beclin1,BA3123-2,BOSTER;P-Beclin1(Ser93),14717,CST;ACSL4,A04372-2,BOSTER;GAPDH,BM1623,BOSTER)孵育过夜。然后用二抗(HRP-mouseIgG;HRPRabbitIgG)在室温下孵育1h。最后,使用增强化学发光系统(ChemiDoxXRS,Bio-Rad)观察免疫印迹。采用ImageJ软件计算灰度值。
2 结果
2.1 Dex处理对Erastin诱导的原代皮层神经元铁死亡的影响。神经元追踪显示,相对于DMSO组,Er组在24 h神经元胞及神经突降解,神经元死亡;Dex干预后48 h内(Er+Dex组),神经元胞体和神经突虽受损,但仍维持神经元形态。细胞活力检测显示,Er组相对于DMSO组其细胞活力显著降低(P<0.001),Er+Dex组相对于Er组其细胞活力显著增高(P<0.05)(见图1)。
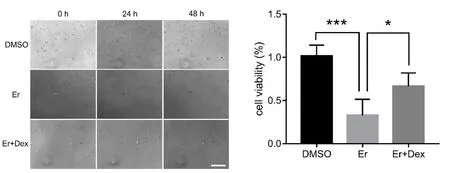
图1 原代皮层神经元追踪及细胞活力检测
2.2 铁死亡相关蛋白BECN1、PBECN1、GPX4、ACSL4表达水平。结果显示,DMSO组、Er组和Er+Dex组的ACSL4、BECN1的表达水平均无差异。而Er组相对于DMSO组GPX4表达显著降低(P<0.001),Er+Dex组相对于Er组GXP4表达上调(P<0.05)。Er组相对于DMSO组PBECN1表达显著升高(P<0.001),Er+Dex组相对于Er组GXP4表达下调(P<0.05)(见图2)。
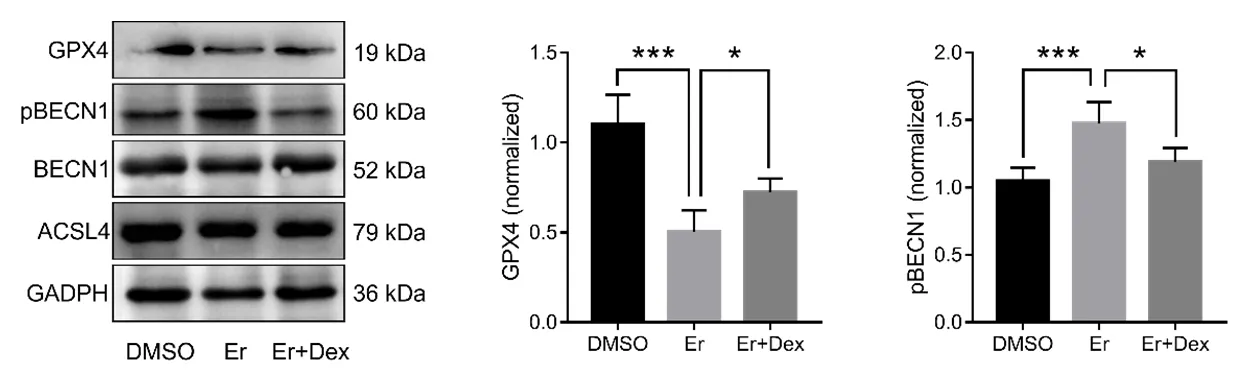
图2 铁死亡相关蛋白BECN1、PBECN1、GPX4、ACSL4的表达
3 讨论
铁死亡以其铁离子依赖的氧化应激导致细胞死亡而命名。脑损伤导致的神经元死亡不但涉及凋亡、坏死、焦亡等经典的细胞死亡途径,也涉及最新发现的铁死亡[7]。Dex作为临床麻醉常用的镇静剂,对脑缺血、创伤性脑损伤导致的神经损伤起到保护作用。LIU等[8]发现Dex通过调控miR-214表达升高抑制ROCK1水平,进一步抑制NF-κB从而发挥神经元保护作用。WANG等[9]证实通过激活AMPK信号通路抑制神经炎症,改善神经元凋亡。ZHANG等[10]发现Dex通过上调HSP70抑制创伤性脑损伤导致的神经元凋亡。本研究中,Dex处理后可改善Erastin诱导的神经元死亡。事实上,Dex也可以减轻败血症导致的心肌细胞铁死亡[11]。因此,Dex的神经保护机制可能涉及铁死亡途径。
进一步,我们检测了铁死亡相关蛋白BECN1、PBECN1、GPX4、ACSL4的表达水平。BECN1磷酸化后与膜蛋白SLC7A11结合,抑制System Xc-的形成,从而诱发铁死亡[12]。GPX4是铁死亡的关键因子,促进GPX4的表达可有效抑制铁死亡的发生[13]。ACSL4有助于铁死亡过程中脂质中间体的积累,故ACSL4 具有促进铁死亡的作用[14]。本研究中,Erastin未引起ACSL4的表达变化,而GPX4的表达降低,磷酸化的BECN1表达升高,提示Dex的抗铁死亡作用可能是通过BECN1-GPX4途径实现的[15]。本研究从铁死亡角度探讨Dex的神经保护作用,证实了Dex可通过调控铁死亡相关蛋白发挥神经保护作用,但具体机制有待进一步研究。

