茯砖茶对APOE-/-小鼠肝脂合成和氧化应激影响
张文将, 刘圆月, 范文涛, 段丽芳, 李 鑫, 刘柏炎
(1.陕西中医药大学 基础医学院,陕西 咸阳712046;2.益阳医学高等专科学校 基础医学部,湖南 益阳413000;3.湖南中医药大学 中西医结合学院,湖南 长沙410208)
非酒精性脂肪肝(NAFLD)已发展为我国第一大肝病,呈低龄化和快速增长趋势[1]。该病的发病机制尚不明确,“二次打击学说”被认为是NAFLD形成的经典假说,胰岛素抵抗和脂质代谢紊乱导致脂类物质在肝细胞内的聚集造成第一次打击;各种原因造成的氧化应激以及脂质过氧化损伤被认为是“二次打击”因素;该病持续发展有演化为肝纤维化,甚至有肝癌变、肝衰竭的风险[2-3]。
NAFLD尚无获批的特异性药物治疗,2018年非酒精性脂肪性肝病防治指南建议改善不良的生活方式,适当应用具有降脂和抗氧化的药物进行辅助治疗,并认为适度饮茶有助于NAFLD患者的康复[4]。茯砖茶善解油腻、助消化,被誉为“生命之饮”,其所富含的茶多糖及发花过程中产生的冠突散囊菌具有清除自由基的能力[5]。江南大学生物工程学院研究团队证实茯砖茶中存在类他汀的成分[6]。课题组既往实验证实茯砖茶具有降低高脂喂养载脂蛋白E敲除(APOE-/-)小鼠肝质量、肝指数、体质量、脾质量、腹部脂肪质量作用;降低APOE-/-小鼠血清中低密度脂蛋白胆固醇(LDL)、三酰甘油(TG)含量和抑制炎症因子表达的效果[7-8]。茯砖茶能否逆转脂类物质在肝脏的沉积,这在以往的研究中鲜有报道。本实验中检测肝脏HMG-CoA还原酶mRNA(HMGCR)、过氧化物酶体增殖物激活受体γ mRNA(PPAR-γ)、硬脂酰辅酶A去饱和酶1 mRNA(SCD-1)3个指标来反映小鼠肝脂合成代谢;以肝组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)来反映氧化应激损伤;肝组织丙氨转氨酶(ALT)和谷草转氨酶(AST)来反映肝细胞损伤,从而深入探讨茯砖茶对NAFLD的治疗效果。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 2月龄SPF级雄性APOE-/-小鼠55只,南京大学生物模式中心提供,品系名APOE Cas9-KO,遗传背景C57BL/6,配繁信息为-82bp/wt配B6J,动物许可证号SCXK(苏)2015-0001;2月龄雄性C57BL/6J小鼠10只,动物许可证号SYXK(湘)2016-0002,该实验通过动物伦理审查。
1.1.2 药物及试剂 2014年茯砖茶:湖南安化白沙溪茶厂提供;阿托伐他汀:辉瑞制药公司产品;Trizol Reagent: 美国invitrogen公司产品 (货号:15596026);Thermo Scientific RevertAid First Strand cDNA Synthesis Kit:美国Thermo Scientific公司产品(货号:00692424);TB GreenTMPremix Ex TaqTM:日本TaKaRa公司产品(货号:A152172A);BCA蛋白质浓度测定试剂盒:武汉博士德公司产品;MDA、GSH-PX、SOD、ALT、AST试剂盒:南京建成公司产品。
1.1.3 饲料 高脂饲料:北京华阜康公司产品(型号:H10141);普通维持饲料:湖南斯莱克景达实验动物公司产品。
1.1.4 主要仪器 高速冷冻离心机:德国Hermle公司产品;光学显微镜:日本奥林巴斯公司产品;分光光度计:日本岛津公司产品;多功能酶标仪:美国Perkinelmer公司产品;核酸蛋白质浓度测定仪:英国Bio-drop公司产品;PCR扩增仪:美国Bio-rad公司产品;荧光定量PCR仪:德国Eppendorf公司产品。
1.2 实验方法
1.2.1 药物制备 为保证药液的新鲜,每次熬制约一周的量,具体方法如下:准确称量茯砖茶20 g并充分粉碎,用无菌纱布包裹系紧放入无菌烧杯中,茶叶与无菌III级水按照1 g∶15 mL比例进行配备,加水量应没过茶包2~3 cm,充分浸泡0.5 h,武火煮开后文火煎煮30 min,煎煮药液冷却后过滤,取汁另置;药包加III级水(与药包齐平)继续煎煮,煮沸后冷却,合并两次熬制的药液并浓缩至185 mL(高浓度),取适当体积高浓度药液若干,依次稀释为中浓度和低浓度剂量,3 000g离心15 min后,去渣取上清液放入消毒广口瓶中,于4℃冰箱保存备用。参考茶吸收实验所推荐60 kg成人每日摄入量为10 g茶,即166.7 mg/(kg·d),换算小鼠每日需用量为1.44 g/(kg·d)[9],根据预实验结果设定茯砖茶高、中、低剂量(2.16、1.44、0.72 g/(kg·d))。阿托伐他汀按照10 mg/(kg·d)剂量予以灌胃,现用现配。
1.2.2 小鼠饲养 小鼠喂养于SPF级实验室,IVC独立送风隔离笼具喂养,每笼5只,室内温度(20±5)℃,室内相对湿度40%~70%,明暗交替。APOE-/-小鼠和C57小鼠分别予以等量高脂饲料和普通饲料喂养。小鼠饮用水分别为实验用III级水,自由饮水。每2 d更换一次垫料,定期对笼具和饮水瓶消毒。
1.2.3 动物分组、造模与给药 动物适应性饲养一周后,将55只2月龄雄性APOE-/-小鼠连续高脂饲料喂养3个月,另选用10只2月龄C57小鼠作为正常对照组予以普通饲料连续喂养3个月[10],3个月后随机抽取5只雄性APOE-/-小鼠进行解剖,观察各组小鼠肝脏肉眼特征,取肝脏同一部位用多聚甲醛固定后进行HE染色。确定造模成功后随机分为茯砖茶高、中、低剂量组,模型组,阿托伐他汀组,每组10只,以上各组小鼠按照10 mL/(kg·d)连续灌胃干预8周,其中模型组和空白对照组予以10 mL/(kg·d)生理盐水灌胃干预。
1.2.4 标本收集与处理 各组小鼠连续灌胃8周后禁食不禁水12 h,腹腔麻醉,摘眼球取血后离心获取血清备检,颈椎脱臼法处死动物,迅速打开小鼠腹腔放置冰上操作,用眼科剪摘除小鼠肝脏并进行称质量记录,预冷生理盐水漂洗后剪取相同部位小鼠肝叶,并用4%(质量分数)多聚甲醛固定后放入4℃冰箱以备HE染色。剪取约100 mg肝脏组织放入盛有1 mL预冷Trizol的无酶冻存管中,快速投入液氮中急速冷冻以备PCR检测;剪取部分肝脏组织放入无酶冻存管并投入液氮中以备氧化应激及肝功能检测;取材完毕,将液氮中的肝脏组织转移至-80℃冰箱,尽快进行后续实验的检测。
1.2.5 氧化应激指标测定 将肝脏组织从低温冰箱取出,冰生理盐水漂洗后用消毒眼科剪将肝组织剪碎并按m(肝组织)∶V(生理盐水)=1 g∶9 mL的比例关系加入生理盐水(全程冰上操作),自动匀浆机匀浆(每3 s间歇1次,防止产热过多)制成质量分数10%肝匀浆液,1 000g(4℃)离心15 min,取上清液加适量生理盐水稀释到合适的浓度范围备测肝组织中SOD、GSH-PX活力和MDA质量摩尔浓度,测定数值带入公式计算并进行数据分析。
1.2.6 肝功能检测 用BCA试剂盒测定10%(体积分数)肝匀浆中各组样本的浓度,根据说明书步骤进行操作,计算出各组标本ALT和AST的活力。
1.2.7 病理形态学检测 4%(质量分数)多聚甲醛固定肝组织48 h后取材,自动脱水机常规脱水后进行包埋,组织蜡块充分冷却后放入切片机中制备4μm厚度切片,摊片机上晾干后放入烤箱中70℃烤片1 h,常规HE染色、封片后观察组织形态。依据指南对NAFLD活动度积分(NAS)进行半定量分析[11]。
1.2.8 RT-qPCR检测
1)引物设计 从NCBI网站获取小鼠相应mRNA序列,引物序列信息见表1。

表1 PCR引物序列信息Table1 PCRprimersequence
2)组织总RNA的提取 采用Trizol法提取小鼠肝组织中的总RNA。研钵、研杵DEPC稀释液浸泡过夜,锡箔纸包裹后高压蒸汽灭菌(121℃、2 h)后放入烤箱中充分烤干备用。保温杯盛放液氮备用,低温冰箱取出的肝脏组织迅速投入液氮预冷的研钵中,不断倒入液氮促使肝脏组织在低温环境下充分冷冻,研杵快速研磨组织直至成粉末状,倾斜研钵以便于收集粉末,手持200μL吸头尖端,同时用吸头宽端迅速收集研钵中的组织粉末,转移至盛有1 mL Trizol的1.5 mL无RNA酶的EP管中,室温放置10 min,按照说明书步骤进行后续操作来获取总RNA。用移液器吸取2μL RNA提取液滴入核酸蛋白质浓度测定仪中检测并记录吸光度比值(A260nm/A280nm),判断RNA提取的质量。吸光度比值在1.8~2.0之间的组织进行下一步操作。
3)RNA逆转录为cDNA 配置20μL反应体系,按照说明书步骤进行操作。RNA变性:加入4μg总RNA(模板RNA),1μL引物Oligo(dT)18,加入RNase-freewater配置成每管12μL体系,打开已预热的PCR仪器,65℃条件下变性5min,完毕后迅速取出标本放置于低温冰盒中。RNA逆转录为cDNA第1链:将已变性的RNA中加入8μL混合液 (5×Reaction Buffer4 μL、RiboLock RNase Inhibitor 1 μL、10 mmol/L dNTP Mix 2 μL、RvvertAidM-MuLV逆转录酶1μL),用掌式离心机瞬时涡旋混匀后放冰盒中备用,放入PCR反应仪中进行条件设置 (42℃反应60min,70℃反应5min,4℃维持),完成RNA逆转录为cDNA第1链。
4)RT-qPCR扩增 95℃预变性2min,95℃变性15s,60℃退火1min;循环40次。
5)结果分析方法 以β-actin作为内参,各指标基因表达以2-△△Ct值进行相对定量并统计分析。
1.2.9 统计学处理 运用SPSS18.0软件对数据进行分析,结果以均数±标准差(±SD)来表示。采用单因素方差分析对多组间均数进行比较,LSD用于分析组间比满足方差齐次性的实验数据,P<0.05说明差异具有统计学意义。
2 结果与分析
2.1 肝脏肉眼观测
空白对照组小鼠肝脏大小适中、颜色暗红、边缘锐利(见图1)。模型组小鼠肝脏体积变大、色黄油腻、边缘变钝。高剂量组小鼠肝脏体积变大、颜色暗红、色稍黄。中剂量组小鼠肝脏色暗红、大小适中。低剂量组小鼠肝脏色黄油腻、体积变大,边缘钝。阿托伐他汀组小鼠肝脏色黄油腻、体积变大、边缘变钝。
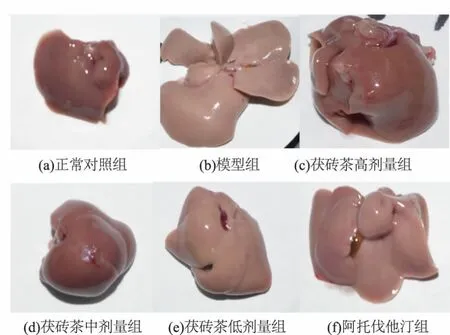
图1 不同组别小鼠肝脏肉眼观测结果Fig.1 Macroscopic changes of liver in different micegroups
2.2 肝脏显微镜观测
正常对照组低倍镜下肝小叶结构清晰,中央静脉居中,肝索呈现放射状,肝血窦清晰;高倍镜下肝细胞大小正常,核居中,胞质均质红染。模型组低倍镜下肝小叶轮廓模糊,肝索未呈现典型的放射状排列,肝血窦纹理不清;高倍镜下大量大小不等的空泡形成,细胞核偏位,胞浆淡染疏松化。茯砖茶高剂量组低倍镜下肝小叶结构完整,中央静脉居中,肝索呈放射状,肝血窦基本清晰;高倍镜下肝细胞大小基本一致,细胞核居中,大部分细胞胞浆红染,部分细胞胞浆淡染,部分细胞有少量的空泡形成。茯砖茶中剂量组低倍镜下肝小叶结构完整,中央静脉居中,肝索呈现放射状,肝血窦清晰;高倍镜下肝细胞大小基本一致,细胞核居中,胞浆红染均质,有少量小空泡形成。茯砖茶低剂量组低倍镜下肝小叶轮廓欠清晰,中央静脉居中,肝血窦纹理不清晰;高倍镜下细胞核居中,胞浆淡染疏松化,有大量小空泡形成。阿托伐他汀组低倍镜肝小叶轮廓欠清晰,中央静脉居中,肝血窦纹理不清晰;高倍镜显示细胞核偏位,胞浆淡染疏松化,有大小不等的空泡形成(见图2)。模型组NAS积分最高,各用药组NAS积分下降,其中茯砖茶高、中剂量组NAS积分最低,结果见表2。
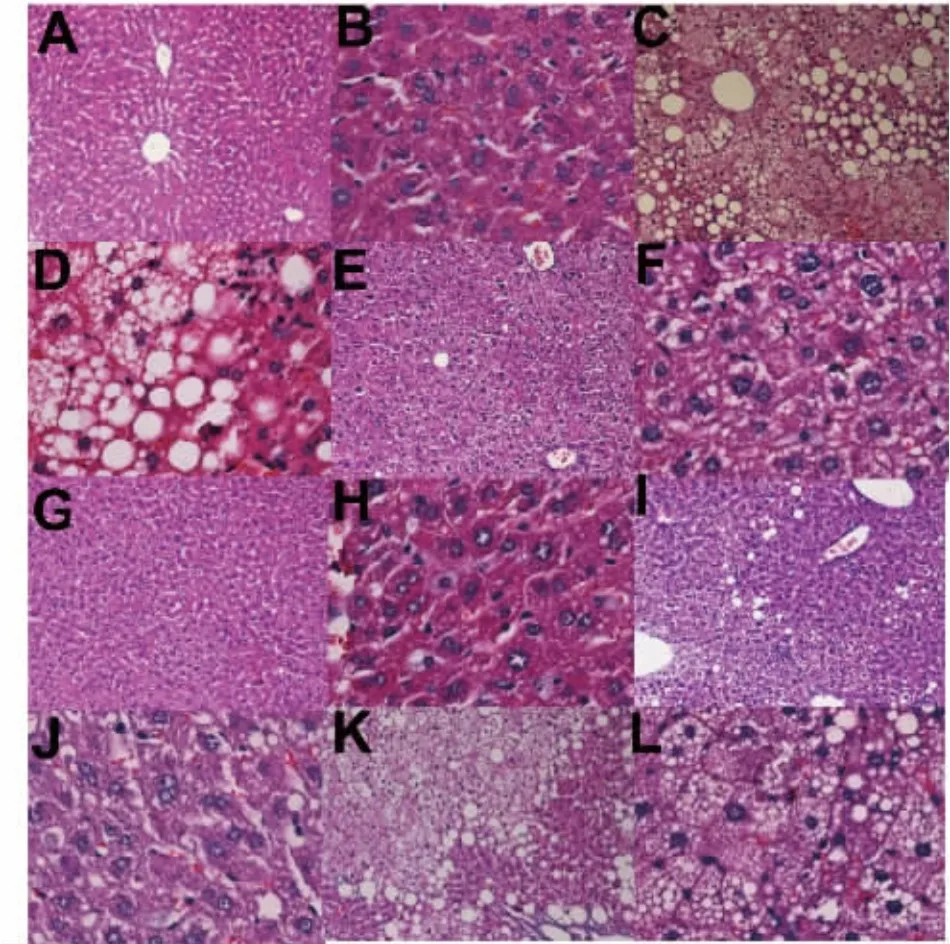
图2 不同组别小鼠肝组织镜下观图片Fig.2 Liver tissues of mice in different groups observed under microscope
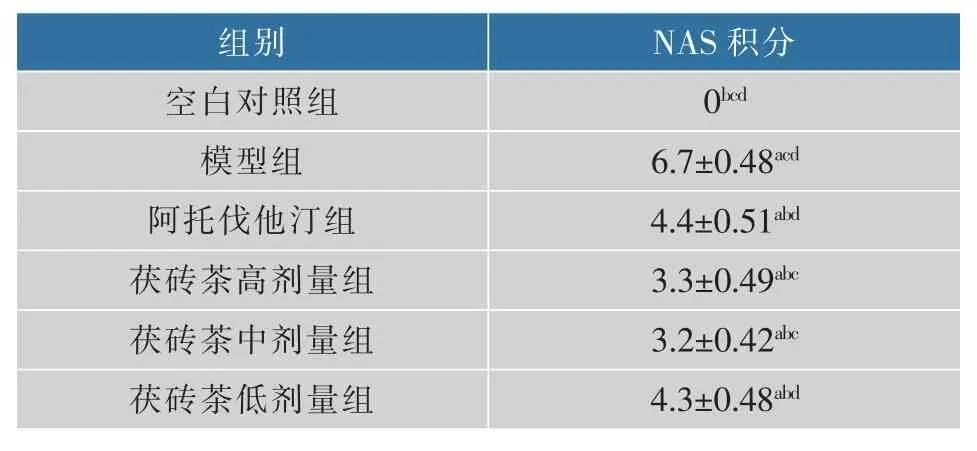
表2 NAS积分在各组间的比较Table 2 NAS integral comparisons between groups
2.3 茯砖茶对小鼠肝脏氧化应激水平的影响
与空白对照组相比,模型组小鼠肝组织MDA质量摩尔浓度较高、GSH-PX与SOD活力较低(P<0.05);与模型组相比,各用药组小鼠肝组织GSH-PX和SOD活力较高,MDA质量摩尔浓度较低,其中茯砖茶高剂量组SOD活力最高,阿托伐他汀组GSH-PX活力最高,茯砖茶中剂量组MDA质量摩尔浓度最低(P<0.05),结果见表3。
表3 肝脏氧化应激指标的比较(±SD,n=10)Table 3 Comparison of hepatic oxidative stress indexes(±SD,n=10)
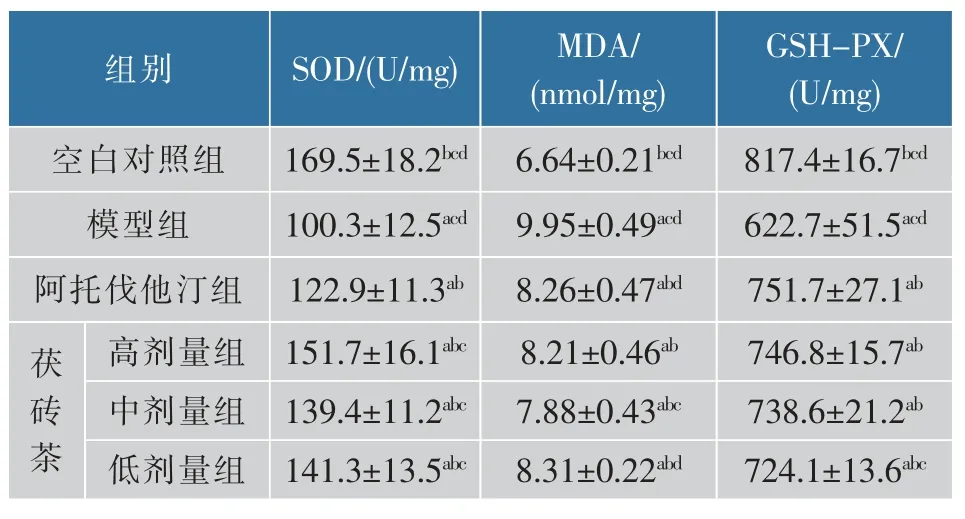
表3 肝脏氧化应激指标的比较(±SD,n=10)Table 3 Comparison of hepatic oxidative stress indexes(±SD,n=10)
?
2.4 茯砖茶对小鼠肝功能的影响
与空白对照组相比,模型组肝组织ALT、AST活力较高(P<0.05);与模型组相比,各用药组肝组织ALT、AST活力较低,其中茯砖茶中剂量组ALT、高剂量组AST活力最低(P<0.05),结果见表4。
表4 肝脏匀浆转氨酶活力的比较(±SD,n=10)Table 4 Comparison of transaminase activity in liver homogenate(±SD,n=10)
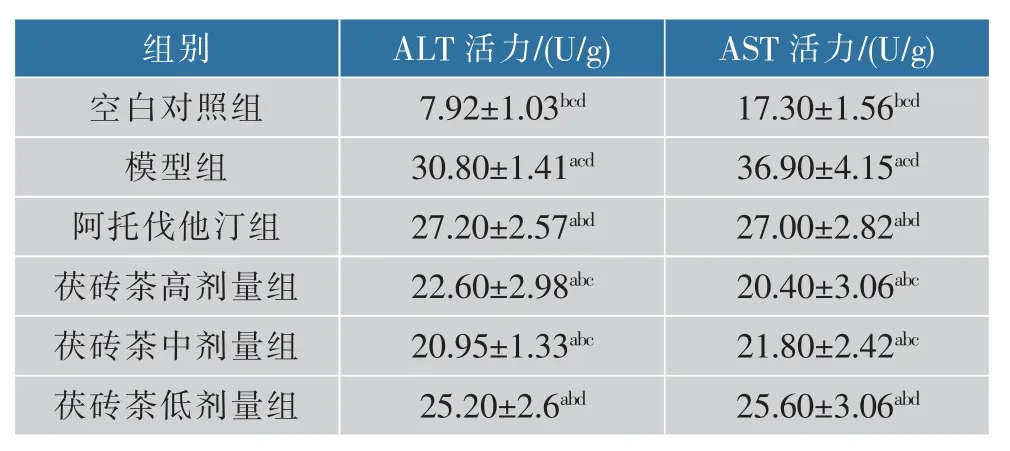
表4 肝脏匀浆转氨酶活力的比较(±SD,n=10)Table 4 Comparison of transaminase activity in liver homogenate(±SD,n=10)
?
2.5 对脂类物质合成相关指标的影响
2.5.1HMGCR基因表达 与空白对照组相比,模型组肝组织HMGCR基因表达升高(P<0.05);与模型组相比,各用药组肝组织HMGCR基因表达降低(P<0.05),其中阿托伐他汀组和茯砖茶不同剂量组之间HMGCR基因表达无差别(P>0.05),结果见表5和图3。
表5 肝脏HMGCR数据(±SD,n=10)Table 5 Liver HMGCR data(±SD,n=10)
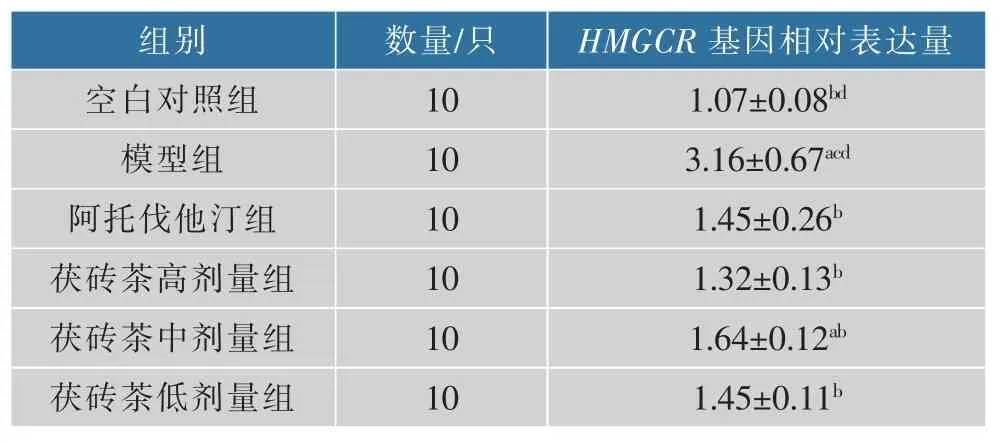
表5 肝脏HMGCR数据(±SD,n=10)Table 5 Liver HMGCR data(±SD,n=10)
?
2.5.2PPAR-γ基因表达 与空白对照组相比,模型组肝组织PPAR-γ基因表达较高(P<0.05);与模型组相比,各用药组肝组织PPAR-γ基因表达降低(P<0.05),其中茯砖茶不同剂量组PPAR-γ基因表达低于阿托伐他汀组(P<0.05),结果见表6和图4。
图4 肝脏PPAR-γ基因表达扩增曲线和溶解曲线Fig.4 Amplification curve and dissolution curve of PPAR-γgene expression in liver
表6 肝脏PPAR-γ数据(±SD,n=10)Table 6 Liver PPAR-γdata(±SD,n=10)
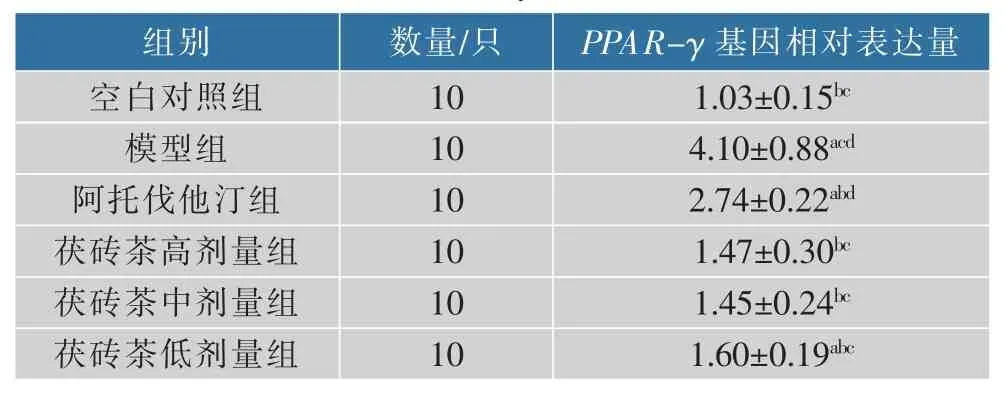
表6 肝脏PPAR-γ数据(±SD,n=10)Table 6 Liver PPAR-γdata(±SD,n=10)
?
图3 肝脏HMGCR基因表达扩增曲线和溶解曲线
Fig.3 Expression and dissolution curves of HMGCR gene in liver
2.5.3SCD-1基因表达 与模型组相比,各用药组小鼠肝脏SCD-1基因表达较低(P<0.05),阿托伐他汀组和各用药组之间的SCD-1基因表达无差别(P>0.05),茯砖茶高、中剂量组SCD-1基因表达低于茯砖茶低剂量组(P<0.05),结果见表7和图5。
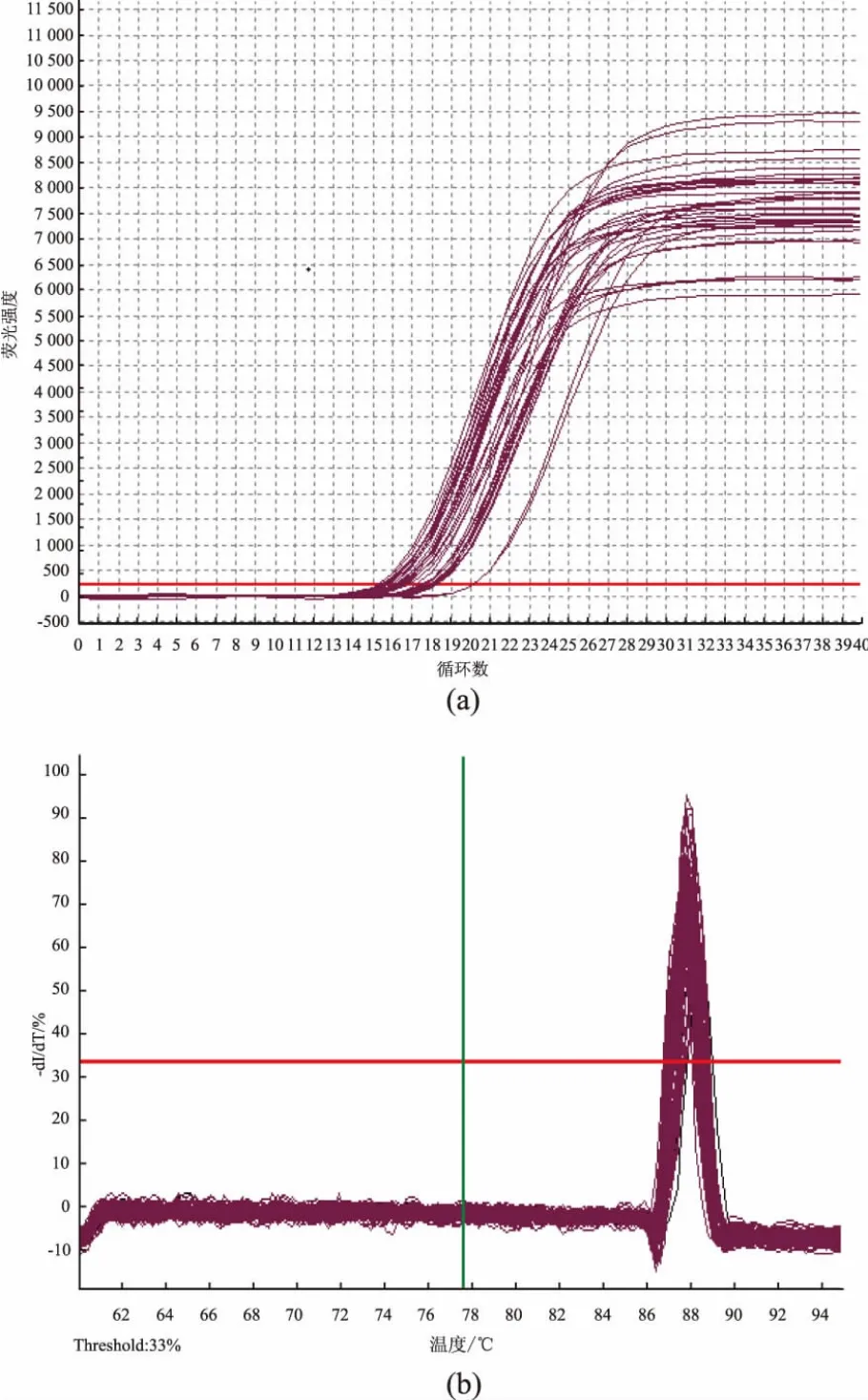
图5 肝脏SCD-1基因表达扩增曲线和溶解曲线Fig.5 Expression amplification curve and dissolution curve of liver SCD-1 gene
表7 肝脏SCD-1数据(±SD,n=10)Table 7 Liver SCD-1 data(±SD,n=10)
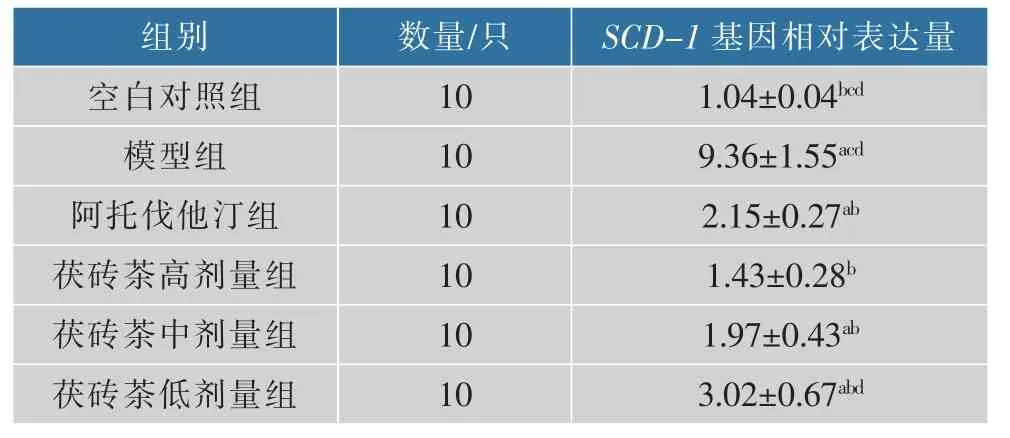
表7 肝脏SCD-1数据(±SD,n=10)Table 7 Liver SCD-1 data(±SD,n=10)
?
2.6 讨论
理想的动物模型是研究疾病至关重要的因素,APOE-/-小鼠血浆中乳糜微粒、LDL、VLDL等物质清除受损,导致肝脏有大量的脂类物质的沉积,APOE-/-小鼠可以较好地模拟人类NAFLD发生发展过程,是研究NAFLD较好的模型之一[12-13]。病理形态学显示模型组小鼠肝脏有大量脂类物质的沉积,茯砖茶高、中剂量组灌胃治疗给药起到很好的逆转脂类物质在肝脏的沉积的效果,但是茯砖茶低剂量组抑制脂类物质在肝脏沉积效果较差,说明茯砖茶必须达到一定剂量才可以有效地发挥抑制脂类物质沉积的效果。阿托伐他汀治疗性给药抑制脂类物质形成的效果差于茯砖茶高、中剂量组,说明茯砖茶是通过多种途径发挥抑制脂类物质沉积的效果。本次实验中选择了SCD-1、PPAR-γ、HMGCR3个指标来观察茯砖茶用药对肝脂合成代谢的影响。
SCD-1是脂质代谢的核心,催化酰基辅酶A底物从头合成不饱和脂肪酸的限速步骤[14]。SCD-1在肝脏和脂肪组织中表达丰富,在脂肪生成中发挥重要作用。有研究显示,SCD-1可以调控甘油三酯和胆固醇等脂类物质的合成与吸收,其异常表达将会导致脂类物质代谢紊乱,从而导致肝脂变的形成[15]。从实验结果可见,模型组小鼠由于脂类物质合成过多,导致大量SCD-1的基因表达,结合病理形态学可见SCD-1的表达和肝脏脂肪变性呈正相关。而茯砖茶不同剂量组和阿托伐他汀组小鼠用药之后可以起到很好抑制SCD-1表达的效果,从而有效地抑制脂类物质的合成与吸收,改善了脂类物质代谢紊乱。
PPAR-γ在糖脂代谢形成过程中发挥着至关重要的作用[16]。NAFLD小鼠肝脏中PPAR-γ基因和蛋白质表达升高,从而促进了NAFLD的发生,并认为血液中FFA的升高激活了PPAR-γ信号通路[17-19]。模型组小鼠肝脏PPAR-γ基因表达升高,促进了脂肪组织在肝脏的合成,而茯砖茶不同剂量组和阿托伐他汀组小鼠治疗给药可以起到很好地抑制PPAR-γ表达的效果,从而抑制脂肪组织在肝脏的沉积。
HMGCR活性对控制从头合成胆固醇有重要作用,表达上调则体内胆固醇合成增加,临床多应用他汀类药物抑制HMGCR表达来降低胆固醇,故调控HMGCR表达是维持体内胆固醇稳态的关键步骤[20]。模型组小鼠肝脏HMGCR基因表达升高,反映APOE-/-小鼠长期高脂饮食促进了胆固醇合成。阿托伐他汀组小鼠肝脏HMGCR基因表达下降,茯砖茶不同剂量组也可以抑制HMGCR的基因表达,从而达到抑制胆固醇合成效果。
氧化应激在NAFLD发生发展过程中起着至关重要的作用[21],当动物摄取外源性脂类物质过多时,便会导致肝细胞中多余的游离脂肪酸脂质过氧化,产生大量活性氧(ROS),当生成量超过机体的清除能力便会导致氧化应激损伤。大量ROS的生成导致线粒体功能受损,脂代谢障碍,肝脂变的形成[22-23]。氧化应激的持续激活有诱发肝纤维化、肝硬化的风险,针对氧化应激及炎症的治疗是延缓NAFLD进一步发展的有效措施[24-25]。本实验中结果显示模型组由于过剩的游离脂肪酸脂质过氧化,产生大量脂质过氧化产物MDA,同时消耗了SOD、GSH-PX等抗氧化酶。而茯砖茶用药组和阿托伐他汀组小鼠由于用药治疗后抑制了氧化应激,抑制了ROS的产生,改善了脂代谢障碍,减轻了肝脏脂肪变性,由此可见茯砖茶具有很好的抗氧化能力。
正常人体中AST和ALT含量极低,当各种原因破坏肝细胞之后,便会导致肝细胞膜破裂,胞浆中的酶类物质入血。因此,AST和ALT含量是反映肝细胞损伤比较敏感的指标[26]。本次实验中模型组小鼠肝脏受损程度重于用药组,说明茯砖茶和阿托伐他汀治疗性给药可以起到保护肝细胞的效果。
3 结 语
由实验结果可知,茯砖茶逆转NAFLD形成是多方面的,其可能机制为通过抑制PPAR-γ、HMGCR、SCD-1基因表达来抑制肝脏脂类物质的合成,从而减轻肝脏脂肪变性,减轻脂质过氧化所造成的肝脏氧化应激损伤,有效保护了肝细胞,防止NAFLD的进一步演化发展。NAFLD至今尚无很好的药物治疗方法,茶作为一种天然抗氧化剂,同时作为我国古老的药用本草。茯砖茶良好的临床及动物实验效果为临床实践用药提供新的思路,具有非常重要的应用价值。实验结果证实了茯砖茶在抑制脂类物质合成和抗氧化方面具有很好的效果,近年来研究表明,肠道菌群和胆汁酸代谢异常与NAFLD的形成密切相关,茯砖茶作为后发酵茶,已证实具有很好的调节肠道菌群的作用[27],但是否通过调节肠道菌群和胆汁酸的代谢还不得而知。后续实验将以“胆汁酸和肠道菌群-肠-肝轴”为主线展开茯砖茶治疗性给药对NAFLD的系统研究,以期为茯砖茶的临床应用提供科学依据。

