岩藻多糖对幽门螺杆菌感染后小鼠肠道菌群紊乱的调节作用
张雪琳 蒋晨 徐珊 田字彬
(青岛大学附属医院消化内科,山东 青岛 266003)
幽门螺杆菌(HP)是一种革兰阴性、螺旋状、鞭毛状细菌,属于变形杆菌门,在严酷的胃酸环境中具有很强的生存能力[1]。HP感染是全世界人群中比较常见的感染之一,发展中国家的患病率为70%~90%,发达国家患病率为25%~50%[2-3]。既往研究集中于HP致消化性溃疡、胃腺癌或黏膜相关淋巴组织淋巴瘤(MALT)的临床表现和相关机制的研究。近年来,HP感染与肠道菌群紊乱的相关性逐渐被关注,如实验表明HP丰度与肠道共存微生物多样性呈负相关[4-6],并且HP感染可以导致诸如变形杆菌等细菌的异常增加[7]。现有证据提示,在HP定植期间,除HP具有直接致病性外,其对于肠道微生物网络稳态的破坏也可能影响疾病的发生发展。
近年来,褐藻因其抗黏附、抗氧化、抗毒性、免疫调节、抗凝、抗感染等多种生物功能而被广泛研究。岩藻多糖是从海洋食用褐藻中提取的一种复合硫酸多糖,由岩藻糖和硫酸盐与少量的半乳糖、甘露糖、木糖以及糖醛酸等形成的聚合物[8-9],已经证实岩藻多糖具有抗炎作用[10],可刺激菌群产生含有促进健康成分的短链脂肪酸(SCFAs),以增强肠道屏障的完整性[11]。岩藻多糖干预可增加肠道粪球菌、利肯菌和丁酸球菌的丰度,提高厚壁菌门/拟杆菌门的丰度比例,防止致病菌入侵肠道黏膜[12]。但岩藻多糖作为一种功能性食品,是否也具有改善HP感染后紊乱的肠道菌群结构的作用,目前还没有明确的研究报道。本研究通过基因组测序分析,探讨岩藻多糖是否通过调控肠道菌群并参与HP感染的治疗,为从分子水平揭示岩藻多糖调节肠道菌群的机制提供数据参考。
1 材料与方法
1.1 材料
清洁级C57BL/6小鼠22只,8周龄,体质量18~22 g,购自济南朋悦实验动物繁育有限公司[许可证号:SCXK(鲁)2019 0003]。饲养条件为标准实验条件[SPF级,温度(22±2)℃,湿度(50±5)%,12-12 h昼夜周期,完全营养颗粒饲料饲养]。分析纯级别岩藻多糖来自于青岛明月海藻集团有限公司国家重点实验室。HP PMSS1标准菌株来自于青岛市市立医院。本研究获得青岛大学动物伦理委员会批准。
1.2 方法
22只小鼠按干预方式不同随机分为5组:空白对照组(A组)4只小鼠每天灌胃3 mL双蒸水,持续5周;单纯感染组(B组)每天先灌胃1×1014CFU/L的HP菌悬液3 mL,持续3周,然后再每天灌胃3 mL双蒸水,持续2周;单纯干预组(C组)每天灌胃40 g/L的岩藻多糖3 mL,持续2周,后3周每天灌胃3 mL的双蒸水;预防干预组(D组)每天灌胃40 g/L的岩藻多糖3 mL,持续2周,后3周每天灌胃浓度1×1014CFU/L的HP菌悬液3 mL;治疗干预组(E组)每天灌胃浓度1×1014CFU/L的HP菌悬液3 mL,持续3周,后2周每天灌胃40 g/L的岩藻多糖3 mL。采集实验结束当天的小鼠粪便样品。
小鼠的粪便样品进行16S rDNA菌群测序 (由北京百迈克生物科技有限公司完成,https://international.biocloud.net/zh/project/detail/324153/),使用 Illumina HiSeq 测序平台完成操作分类单位(OTU)聚类与注释,每个OTU代表一个菌种,通过OTU-Venn分析,获得肠道菌群的微生物多样性和不同微生物的丰度;利用QIIME软件生成不同分类水平的物种丰度表,再利用R语言工具绘制成样品各分类学水平的物种分布柱状图;使用Mothur(version v.1.30)软件进行α多样性分析,获得衡量肠道菌群丰度的指标Chao1和衡量物种多样性的指标Shannon指数;使用QIIME软件,通过非度量多维标定法(NMDS)对各组小鼠的肠道菌群进行β多样性分析;通过LEfSe技术分析计算各组小鼠肠道菌群中各菌类的LDA值,并绘制菌类分布柱状图,比较各组间肠道菌群菌类构成是否有差异;再利用Metastats分析各组小鼠的肠道菌群相对丰度并进行t检验,获得各组间差异较大的生物标志菌属。
2 结 果
2.1 肠道菌群OTU数量和物种分布
菌群测序和OTU聚类与注释分析结果显示,所有小鼠的粪便样本中共有肠道菌群OTU为604个,其中A组小鼠的肠道菌群的OTU为395个,B组为341个,C组为454个,D组为401个,E组为344个,同时每组小鼠肠道菌群中均含有的OTU为258个。
利用QIIME软件和R语言工具绘制成各组样品门属分类水平的物种分布柱状图(图1)。图中显示,所有小鼠肠道菌群的优势菌门主要为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、Epsilonbacteraeota、Patescibacteria、放线菌门(Actinobacteria)、脱铁杆菌门(Deferribacteres)、柔膜菌门(Tenericutes)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)等(图1a);优势菌属主要有杜氏杆菌属(Dubosiella)、Muribaculaceae、乳杆菌属(Lactobacillus)、脱硫弧菌属(Desulfovibrio)、毛螺菌科NK4A136菌(LachnospiraceaeNK4A136group)、金黄杆菌属(Chryseobacterium)、螺杆菌属(Helicobacter)、疣微菌科(Ruminococcaceae)、Ileibacterium和乳球菌属(Lactococcus)等(图1b)。
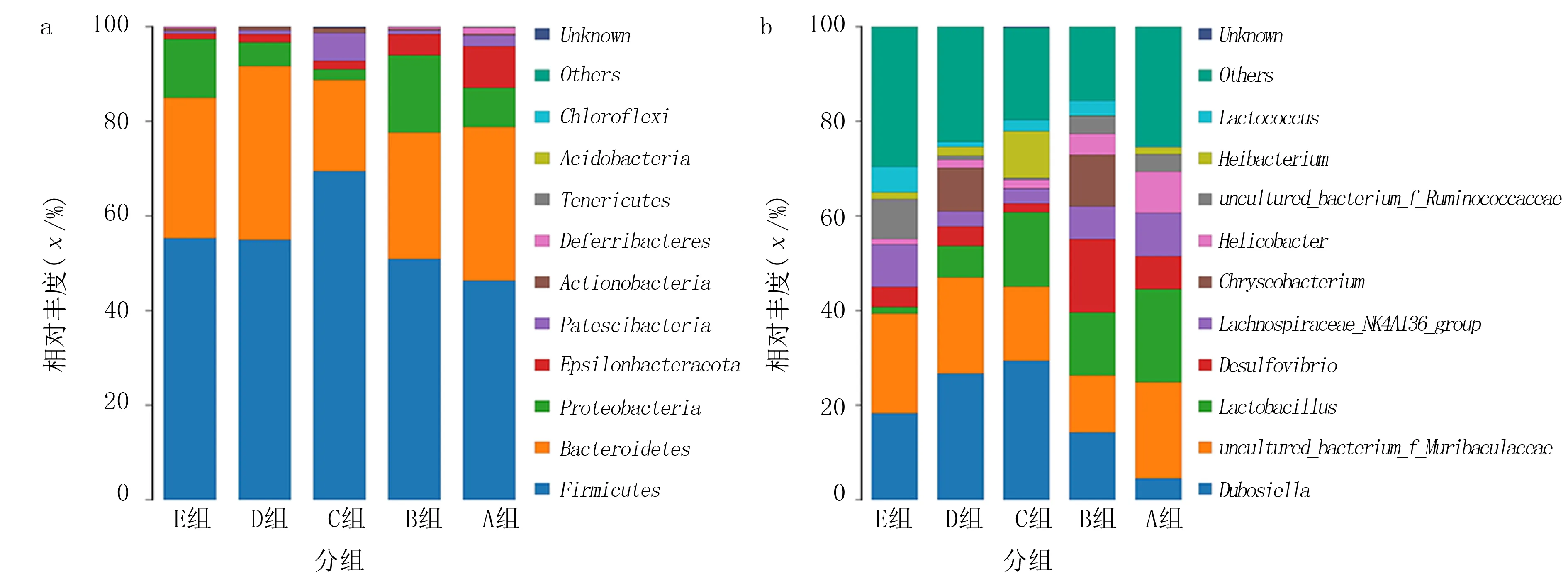
a:门水平肠道菌群分布柱状图,b:属水平肠道菌群分布柱状图,A~E分别为A~E组图1 各组小鼠门、属水平的肠道菌群分布柱状图
2.2 各组小鼠肠道菌群的α多样性分析
A~E组的小鼠肠道菌群的Chao1指数分别为334.715±28.530、249.306±42.753,369.473±89.737,281.579±78.247,268.863±23.176,组间比较差异有显著性(F=3.045,P<0.05),其中A组与B、E组比较、C组与B、E组比较,Chao1指数值均显著增高(t=-2.634~3.833,P<0.05)。各组小鼠肠道菌群的Shannon指数分别为3.503±0.415,2.825±0.482,2.744±0.933,3.025±0.722,3.368±0.112,各组之间比较均无显著差异(F=1.435,P>0.05)。
2.3 各组小鼠肠道菌群β多样性分析结果
β多样性分析结果显示,各组小鼠肠道菌群菌属构成存在显著差异(P<0.01),且结果的可靠程度高(Stress<0.2),其中A组和E组的差别最小,B、C、D组与A组比较差异有显著性(P<0.01)。见图2。图中不同颜色小圆点分别代表A~E组,点与点之间的距离表示各组小鼠肠道菌群结构之间的相似度,距离越近相似度越高。

图2 各组小鼠肠道菌群的β多样性分析结果
2.4 各组小鼠肠道菌群的LEfSe分析结果
对各组小鼠肠道菌群中相对丰度较高的菌类LDA值进行比较,同样显示各组小鼠肠道菌群菌类构成存在显著差异(LDA值>2)。LEfSe分析结果显示,A~E组小鼠肠道菌群中具有显著性差异的菌类共有67种(LDA值>2),其中A组中的肠杆菌科(Enterobacteriaceae)、理研菌属(Rikenella)、Negativibacillu属、Butyricicoccus、Ruminiclostri-dium、Negativibacillus、螺旋杆菌、Parabacteroi-des属、Alloprevotella属、乳杆菌属(Lactobacillus)、乳杆菌科(lactobacteriaceae)等19种菌类相对丰度较高;B组中的梭菌属(Clostridium)、金黄杆菌属(Chryseobacterium)、Flavobacteriales、Weeksel-laceae科等7种菌的相对丰度也较高;C组中红蝽菌科(Coriobacteriaceae)、Atopobiaceae、产粪甾醇真细菌(Eubacteriumcoprostanoligenes)、Marvinbryantia属、肠杆菌属(Enterorhabdus)、伊格尔兹氏菌(Eggerthellaceae)等16种菌类相对丰度较高;D组中芽孢杆菌科(Bacillus)、芽孢杆菌属(Bacillus)、Erysipelotrichaceae科、Faecalibaculum属、CandidatusStoquefichus、断链真杆菌属(Eubacteriumfissicatena)等14种菌类相对丰度较高;E组中梭菌目(Clostridiales)、梭菌属(Clostridia)、瘤胃菌科(Ruminococcaceae)、Parasutterella属、伯克氏菌科(Burkholderiaceae)、伯克氏菌目(Burkholderiales)、β变形菌纲(Betaproteobacteria)、γ变形菌纲(Gammaproteobacteria)、lachnoclostridium属等11种菌类LDA值较高。
2.5 各组小鼠肠道菌群的Metastats分析结果
根据Metastats分析获得各组小鼠的肠道菌群相对丰度,进行t检验后各组小鼠肠道菌群间差异较大的生物标志菌属有Bifidobacterium、Faecalibaculum、Desulfovibrio、Alistipe和Chryseobacterium。其中A组与C组、C组与D组进行比较,Bifidobacterium的相对丰度显著增高(P<0.05);C组与A、B、E组比较,Faecalibaculum的相对丰度显著增高(P<0.05);A组与C组及B组与C、D、E组比较,脱硫弧菌(Desulfovibrio)的相对丰度显著增高(P<0.05);A组与C、D组比较,泽泻属(Alistipe)的相对丰度显著增高(P<0.05);A、C组与E组比较,Chryseobacterium的相对丰度显著增高(P<0.05)。见表1。
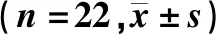
表1 各组小鼠肠道菌群中差异较大的微生物菌属相对丰度比较
3 讨 论
微生态调节在HP感染治疗中的作用愈发受到重视。随着抗HP药物治疗的普及,HP耐药率也逐年增高[13-14],因此,亟需一种经济、有效、安全且基于非抗生素的治疗方法,目前专家学者多采用益生菌作为抗生素治疗的辅助添加剂[15]。研究表明,一些益生菌可以显著降低HP感染及药物治疗不良反应的发生率,还有一些益生菌能够有效提高HP的根除率。L.gasseri是一种在抗耐克拉霉素HP感染中发挥重要作用的益生菌[16],LactobacillusacidophilusDDS-1J在体外对HP具有生长抑制的作用[17]。研究发现辅助使用Lactobacillusspecies等益生菌,HP的根除率可能会升高[18-22]。S.boulardii作为根除HP的辅助剂,效果显著[23-24]。
益生元是不可消化的食物成分,可以从水果、蔬菜、谷物和其他可食用植物中获得。它们在通过上消化道时不会被代谢或吸收,而是由结肠中的细菌发酵,以增强有益菌(如双歧杆菌和乳酸杆菌)的生长和活性[25-27]。过往的研究显示,一些辅助添加剂可作为益生元调控益生菌在肠道中的相对丰度,添加魔芋低聚糖可显著增加肠道双歧杆菌的丰度[28]。摄入黄烷醇可以增加有益的肠道细菌,如乳酸杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium),而降低致病性细菌如产气荚膜梭菌(Clostridiumperfringens)的丰度[29]。食物成分如多酚会提高益生菌如Bifidobacteriaceae等菌的相对丰度,而降低致病性细菌如大肠杆菌(E.coli)、梭状芽孢杆菌(Clostridiumperfringens)和HP的相对丰度[30]。
尽管如此,鲜有揭示益生元对HP感染后肠道菌群紊乱调节作用的研究。为研究益生元如岩藻多糖对HP感染后肠道菌群紊乱的调节作用,本研究选用C57BL/6品系小鼠感染HP,研究岩藻多糖不同干预方式对小鼠肠道菌群数量及构成的影响。本研究采用α多样性分析反映样品中的物种丰度及物种多样性,α多样性中的Chao1指数衡量物种丰度即物种数量的多少,Shannon指数用于衡量物种多样性;同时以物种分布柱状图体现样品中门属水平的物种种类和丰度组成;通过LEfSe分析比较各组间Biomarker的LDA值是否具有统计学差异;最后通过Metastats软件分析筛选出各组样品中有差异的物种。本研究中α多样性分析结果显示B组样品的生物多样性显著低于A组,提示HP感染降低了肠道菌群的生物多样性,而D组和E组生物多样性均出现不同程度的恢复,物种丰度均显著高于B组,说明HP感染前后应用岩藻多糖干预均能增加肠道生物多样性,可调整肠道菌群紊乱状况,而HP感染前预防性岩藻多糖干预对肠道生物多样性保护作用更明显。本研究Metastats分析结果提示,C组相对于A、B、E组,SCFAs粪便杆菌Faecalibacterium的相对丰度增高,说明岩藻多糖的干预会增加有益细菌如Faecalibacterium的相对丰度;C组相对于A、B组,D、E组相对于B组,Desulfovibrio相对丰度降低,说明岩藻多糖的干预会减少小鼠肠道有害菌属如Desulfovibrio相对丰度;C、D组相对于A组,Alistipe的相对丰度降低,说明岩藻多糖的干预会减少小鼠肠道有害菌属如Alistipe的相对丰度。
菌群发酵中最重要的代谢物是SCFAs[31]。对于微生物群落而言,SCFAs为微生物交叉服务,可被细菌(如还原乙酸菌、硫酸盐还原细菌和产甲烷菌)用作碳和能源[32]。SCFAs是由1~6个碳组成的饱和脂肪族有机酸,其中乙酸盐(C2)、丙酸酯(C3)和丁酸酯(C4)含量最高(95%)[33],丁酸和丙酸可以调节肠道生理和免疫功能。岩藻多糖可促进产SCFAs细菌,如Faecalibacterium的丰度,提示岩藻多糖干预可作为一种缓解HP感染后肠道菌群紊乱的辅助治疗方法。
综上所述,HP感染可致肠道生物多样性下降,通过岩藻多糖干预后,增加了肠道微生物的多样性,改善了肠道菌群结构的紊乱状况,使产SCFAs细菌的相对丰度增加,有害菌属的相对丰度降低。本研究从分子水平揭示了岩藻多糖调节肠道菌群的机制,为岩藻多糖参与HP感染的综合治疗提供了数据支持。

