高糖环境下lncRNA MEG3对人视网膜血管内皮细胞增殖和迁移的作用及其机制△
邵珺 王杨宁致 詹鹏飞
糖尿病视网膜病变(DR)是糖尿病性微血管病变中最严重的并发症之一,已成为当前全球重要的致盲眼病。目前,除了玻璃体内注射抗VEGF药物以及视网膜光凝外,临床上尚缺乏其他有效的控制 DR 发生发展的治疗方法[1-3]。长期高血糖引起的眼部微环境失衡(高糖、缺氧等因素)能够诱发关键基因,如VEGF通路相关基因,在表达水平和表观遗传学上出现异常,这是DR 病情进一步发展的重要原因[4]。因此,观察DR发展过程中关键基因表达水平的变化对深入探索DR的发病机制及其精准治疗均具有重要的意义。长链非编码RNA(lncRNA)是哺乳动物体内常见的非编码RNA,能够通过特异性碱基配对及结合,调控前体mRNA剪接、mRNA翻译以及miRNA的功能,在肿瘤发展以及心血管病变等疾病中均有报道[5]。lncRNA广泛存在于哺乳动物组织器官中,可通过微小RNA(miRNA) 应答元件(MRE)作为miRNA(另一类 22 nt 左右的非编码 RNA)的吸附物而发挥功能[6-8]。lncRNA 在眼部疾病已有报道,如青光眼、视网膜母细胞瘤等[9-10]。有报道表明lncRNA MEG3/mir223/NLRP3炎症小体信号轴可促进内皮细胞凋亡[11]。在DR发病中,lncRNA MEG3可通过 PI3k/Akt信号通路调控视网膜内皮细胞的功能[10]。然而lncRNA MEG3的具体作用机制尚未完全明确。
本研究团队曾利用miRNA 芯片和qRT-PCR进行研究发现,miR-223-3p 在 DR患者的血清和房水中水平均有升高,并通过调控下游FBXW7靶基因抑制DR新生血管生成[12],通过进一步的生物信息学预测发现,lncRNA MEG3与mir-223-3p可能存在相互作用。因此,本研究旨在探讨lncRNA MEG3在高糖环境下对人视网膜血管内皮细胞(hRECs)增殖和迁移的作用及其机制,为DR的发病机制、临床预防和治疗提供新的思路。
1 材料与方法
1.1 主要材料hRECs购自中科院上海细胞库,Hek293细胞(人胚肾293细胞;实验室自存),胎牛血清(FBS)(美国Gibco公司),DMEM培养基(美国Hyelone公司),2.5 g·L-1胰蛋白酶、乙二胺四乙酸(EDTA)消化液(凯基生物科技发展有限公司),二甲基亚砜(DMSO)(美国Amresco公司),FBXW7抗体(英国Abcam公司)。SuperRT cDNA Kit、2×Taq Master Mix及染料(北京康为世纪生物科技有限公司),伤口愈合插件(德国Ibidi公司),ECL化学发光法显色试剂盒(北京索莱宝公司)。siRNA序列由上海吉凯基因化学技术有限公司合成,lncRNA引物由吉玛生物(苏州)股份有限公司设计合成。双荧光素酶报告基因和lncRNA MEG3结合位点或野生型/突变型基因质粒及过表达质粒、miR-223-3p mimics均从上海吉凯基因化学技术有限公司订购。
1.2 方法
1.2.1 hRECs的培养hRECs接种于96孔板,细胞密度为30个·μL-1,置于含体积分数10% FBS、20 g·L-1青-链霉素溶液双抗的DMEM培养基,在37 ℃、含体积分数5%CO2培养箱中培养。将hRECs分为正常(低糖)组、高糖(对照)组、lncRNA MEG3过表达(高糖)组、lncRNA MEG3过表达对照(高糖)组、lncRNA MEG3沉默(高糖)组、lncRNA MEG3沉默对照(高糖)组、lncRNA MEG3过表达+沉默(高糖)组及lncRNA MEG3+miR-223-3p过表达组。正常(低糖)组在培养基中加入5.5 mmol·L-1葡萄糖,所有高糖组在培养基中加入25.0 mmol·L-1葡萄糖。
1.2.2 lncRNA MEG3对hRECs增殖的影响各组hRECs接种于96孔板,细胞密度为30个·μL-1,培养24 h贴壁后,每孔加入10 μL CCK-8试剂,培养箱内培养1 h,于酶标仪450 nm下测各孔光密度(D)。设置足够多的平行培养孔,连续6 d检测各组hRECs增殖情况。
1.2.3 lncRNA MEG3对hRECs愈合能力的影响将上述各组hRECs接种于培养皿,细胞密度为30个· μL-1,培养至融合度达到90%左右后,用移液枪头对细胞表面进行划痕。使用光学显微镜观察并分别在划痕后0 h、24 h 照相,使用IncuCyte ZOOM软件扫描图像并计算各组hRECs划痕相对细胞密度(RWD)。
1.2.4 lncRNA MEG3对hRECs迁移能力的影响各组hRECs置入孔径为8.0 μm的Transwell小室,小室内加入200 μL 含10×103个hRECs的无FBS培养基培养48 h。吸弃上下室培养基,用棉签擦净上室内细胞,24孔板内加入40 g·L-1多聚甲醛室温下固定30 min,吸弃多聚甲醛,PBS冲洗小室背面2遍,24孔板内加入结晶紫600 μL,室温下染色20 min,吸出后PBS冲洗小室背面2遍,光学显微镜下观察上室并照相,任意取5个视野进行hRECs计数。
1.2.5 细胞转染将lncRNA MEG3、抑制剂及miR-223-3p导入hRECs各组hRECs覆盖培养皿底部 70%左右时,吸弃完全培养基,PBS清洗 2~3 次。六孔板每孔 250 μL无血清培养基 Opti-MEM和5 μL lipo2000 配制成混合液,静置 5 min,然后再用适量的质粒和 250 μL Opti-MEM 配制成质粒混合液,静置 20 min,lipo2000 和 Opti-MEM 的混合液加入到质粒混合液中混合均匀。 在六孔板每孔加入 1.5 mL Opti-MEM 然后再加入上面配置好的混合液,放入培养箱中培养 4~6 h。
1.2.6 双荧光素酶报告基因实验观察lncRNA MEG3与miR-223-3p的相互作用RegRNA在线服务器“http://regrna2.mbc.nctu.edu.tw”以及miRcode “http://www.mircode.org/” 在线服务器被用于预测能够与lncRNA MEG3直接相互作用的miRNA,其中,miR-223-3p被预测为lncRNA MEG3的直接靶点。Hek293细胞接种于24 孔板进行培养,待细胞贴壁后将细胞分为lncRNA MEG3野生型对照组、lncRNA MEG3野生型+miR-223 mimic组、lncRNA MEG3突变型对照组、lncRNA MEG3突变型(Site 1)+miR-223 mimic组、lncRNA MEG3突变型(Site 2)+miR-223 mimic组和lncRNA MEG3突变型(Site 1+Site 2)+miR-223 mimic组。使用lipo2000完成上述质粒与miR-223 mimic对Hek293细胞的共转染,步骤同1.2.5。报告质粒构建时,lncRNA MEG3插入萤火虫荧光素酶的3’ UTR区域,而携带海肾荧光素酶基因的质粒则共同转染作为内参。Hek293细胞转染后培养24 h,加入100 μL裂解液裂解细胞15 min。采用双荧光素酶分析系统进行检测,在40 μL 荧光素酶检测试剂 II中加入10 μL细胞裂解液,吹打混匀后,检测萤火虫荧光素酶的活性(D560 nm),随后加入40 μL荧光淬灭试剂,再次读数,即为海肾荧光素酶的活性(D465 nm)。计算每组的萤光虫荧光素酶/海肾荧光素酶的信号比值,对照组比值为100%。
1.2.7 qRT-PCR检测高糖及低糖环境下hRECs中lncRNA MEG3表达水平采用RNA试剂盒 Takara提取总RNA。利用Taqman miRNA ABC纯化试剂盒提取总RNA,用逆转录酶扩增lncRNA MEG3的cDNA,SYBRgreen实时定量PCR混合物测定lncRNA MEG3在hRECs中的表达,GAPDH作为内参。lncRNA MEG3引物序列:上游引物为5’-AGCGCTTCTGAAGACCAAAC-3’、下游引物为5’-GAACACAAAGACACCCAGCA-3’,大小为20 bp。利用2-ΔΔCt计算hRECs中lncRNA MEG3 mRNA的相对表达水平。
1.2.8 实时荧光定量PCR检测高糖环境下PABPC1过表达或沉默对hRECs中lncRNA MEG3的表达水平的影响pcDNA3.1(+)-PABPC1 过表达质粒以及siPABPC1 沉默RNA由上海吉玛制药技术有限公司合成。在高糖培养基内培养hRECs至培养皿底部细胞覆盖率为60%~70%时,采用Lipo2000试剂盒 (Life Technologies, 美国) 将过表达对照(1 g·L-1)、PABPC1过表达质粒(1 g·L-1)、PABPC1沉默RNA(40 nmol·L-1)以及沉默对照(40 nmol·L-1)转染入hRECs。继续培养48 h后收集细胞,并提取总RNA,采用qRT-PCR方法测定lncRNA MEG3在hRECs内的表达水平(方法同1.2.7)。
1.2.9 Western blot检测lncRNA MEG3对FBXW7蛋白表达水平的影响待各组hRECs覆盖培养皿底部大约70%左右的时候,吸弃培养皿中的完全培养基,用 PBS 清洗 2~3 次。RIPA 裂解液与蛋白酶抑制剂按体积比1001 混合后,每孔加入适量的混合液,放置在冰上 5 min充分裂解。细胞放置在离心管中并在冰上静置 20 min,在 4 ℃下13 000 r·min-1离心 15 min,取上清。上清蛋白经过SDS-PAGE电泳后,将蛋白条带电转至PVDF膜,使用50 g·L-1脱脂奶粉封闭,分别使用兔抗人FBXW7一抗、鼠抗兔二抗完成孵育与洗涤,使用ECL 化学发光法显色试剂盒进行显色。显色后,条带使用Gelpro软件扫描黑度计算相对含量,以各样品对应的GAPDH相对含量为基准。
1.3 统计学方法采用SPSS 19.0统计学软件进行分析。高糖组与正常(低糖)组hRECs中lncRNA MEG3相对表达水平差异比较采用单因素方差分析;不同试剂或质粒转染组间细胞移行数、RWD、细胞中FBXW7蛋白相对表达量、lncRNA-MEG3荧光素酶活性和细胞中lncRNA MEG3相对表达水平差异比较均采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 不同环境下hRECs中lncRNA MEG3的表达水平以正常(低糖)组hRECs中lncRNA MEG3表达量(1.00±0.09)为基准,高糖(对照)组hRECs中lncRNA MEG3的表达量(0.49±0.05)较正常(低糖)组下降,差异有统计学意义(F=73.613,P=0.001)。
2.2 各组hRECs增殖率比较CCK-8法检测结果显示,hRECs连续培养5 d,高糖(对照)组与正常(低糖)组相比,hRECs增殖能力显著上升(F=328.044,P<0.001);lncRNA MEG3过表达(高糖)组 hRECs增殖能力显著低于lncRNA MEG3过表达对照(高糖)组(F=121.193,P<0.001);lncRNA MEG3 沉默(高糖)组hRECs增殖能力稍高于lncRNA MEG3沉默对照(高糖)组,但差异不显著(F= 0.689,P=0.453)(见表1)。
2.3 过表达或沉默lncRNA MEG3对hRECs愈合及迁移能力的影响细胞划痕实验结果发现,高糖(对照)组hRECs[RWD(98.2±9.6)%]愈合速度显著高于正常(低糖)组[RWD(30.5±4.5)%](F=85.735,P=0.005);lncRNA MEG3过表达(高糖)组hRECs[RWD(33.6±4.3)%]愈合速度显著低于lncRNA MEG3过表达对照(高糖)组[RWD(30.5±4.5)%](F=121.193,P<0.001);而lncRNA MEG3沉默(高糖)组hRECs[RWD(99.7±9.2)%]愈合速度略高于lncRNA MEG3沉默对照(高糖)组[RWD(93.6±8.8)%],但两者差异不显著(F=0.689,P=0.453)(图1A)。
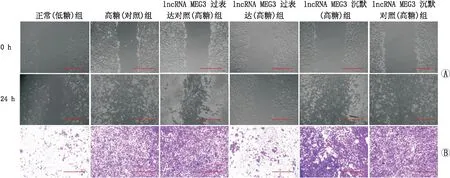
图1 过表达或沉默lncRNA MEG3对各组hRECs愈合能力及迁移能力的影响 A:愈合实验观察过表达或沉默lncRNA MEG3对hRECs愈合能力的影响;B:Transwell实验观察过表达或沉默lncRNA MEG3对hRECs迁移能力的影响。图中标尺为200 μm。
Transwell实验结果发现,高糖(对照)组hRECs[细胞迁移数(377±22)个]迁移速度显著高于正常(低糖)组[细胞迁移数(322±24)个](F=89.240,P=0.008);lncRNA MEG3过表达(高糖)组hRECs[细胞迁移数(209±18)个]迁移能力显著低于lncRNA MEG3过表达对照(高糖)组[细胞迁移数(319±36)个](F=22.407,P=0.009);而lncRNA MEG3沉默(高糖)组hRECs[细胞迁移数(497±51)个]迁移能力显著高于lncRNA MEG3沉默对照(高糖)组[细胞迁移数(352±33)个](F=17.093,P=0.014)(图1B)。
2.4 双荧光素酶报告基因实验验证lncRNA MEG3与miR-223-3p的直接作用经预测,lncRNA MEG3具有与miR-223-3p直接配对的两个潜在靶点(见图2)。lncRNA MEG3与miR-223-3p的潜在直接作用位点位于MEG3序列的301-324位(位点1)以及498-518位(位点2)。
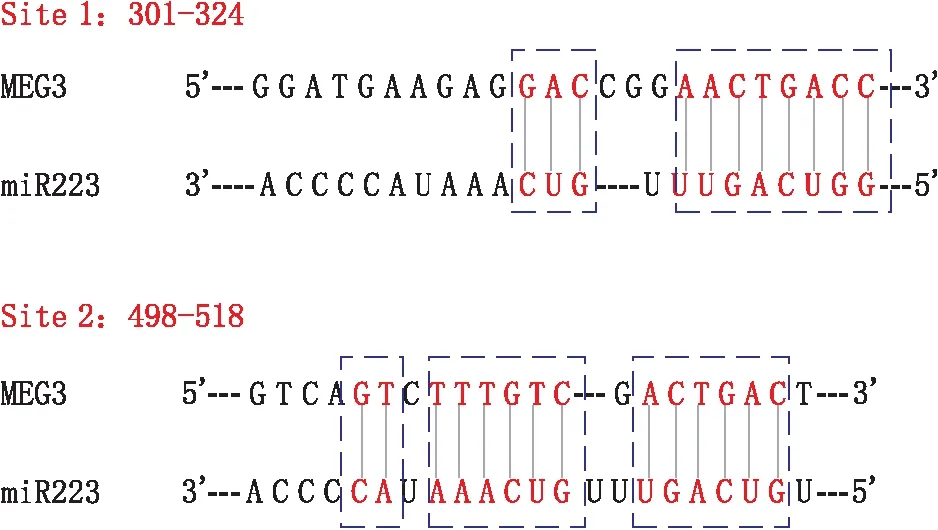
图2 lncRNA MEG3与miR-223-3p的作用位点
双荧光素酶报告基因实验检测发现,添加miR-223-3p后野生型 lncRNA MEG3的荧光素酶活性由(100.0±8.3)%降至(51.5±6.2)%(F=66.691,P=0.001),突变型 lncRNA MEG3的荧光素酶活性由(98.8±6.8)%降至(61.5±5.1)%(位点1,F=58.657,P=0.002)和(70.3±6.2)%(位点2,F=29.104,P=0.006)。而在lncRNA MEG3的双位点(位点1+位点2)突变中,荧光素酶活性由(98.8±6.8)%降至(97.8±8.3)%,差异不显著(F=0.049,P=0.836)。该结果验证了lncRNA MEG3的位点1和位点2都能够和miR-223-3p发生直接的相互作用。
2.5 miR-223-3p mimic 逆转过表达lncRNA MEG3对hRECs增殖的抑制作用当同时转染过表达lncRNA MEG3质粒和miR-223-3p后,可恢复高糖的细胞表型(见表2)。lncRNA MEG3过表达可显著抑制hRECs增殖,而共转染miR-223-3p mimic后,lncRNA MEG3过表达对hRECs增殖的抑制作用被逆转了。
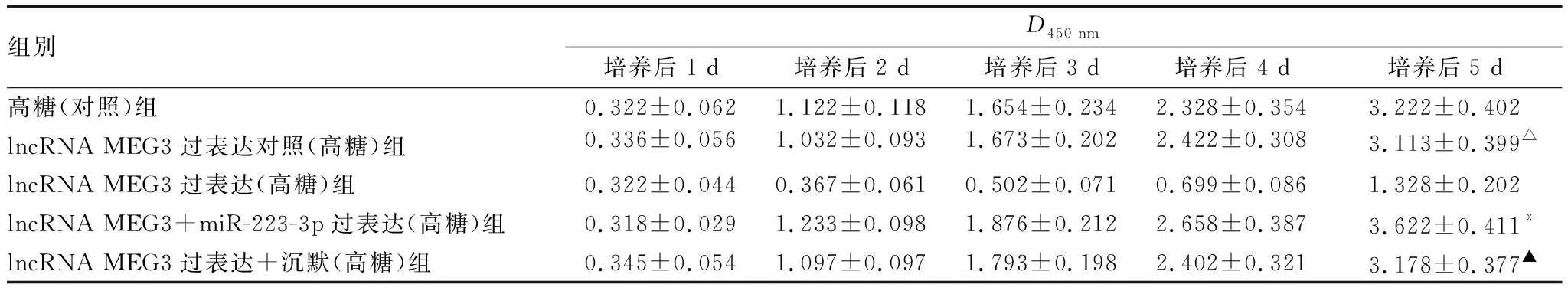
表2 CCK-8法测定miR-223-3p对过表达lncRNA MEG3后hRECs增殖的影响
2.6 miR-223-3p mimic 逆转了过表达lncRNA MEG3对hRECs细胞愈合以及迁移能力的抑制作用愈合实验结果发现,高糖(对照)组hRECs愈合能力[RWD(85.5±7.3)%]与lncRNA MEG3过表达对照(高糖)组[RWD(86.3±8.2)%]差异无统计学意义(F=0.145,P=1.553);lncRNA MEG3过表达(高糖)组hRECs愈合能力[RWD(28.9±3.6)%]显著低于lncRNA MEG3过表达对照(高糖)组(RWD(86.3±8.2)%](F=89.732,P=0.002)和lncRNA MEG3 +miR-223-3p过表达(高糖)组[RWD(87.6±9.0)%](F=110.016,P<0.001)及lncRNA MEG3过表达+沉默(高糖)组[RWD(89.5±7.5)%](F= 97.332,P=0.001)(图3A)。
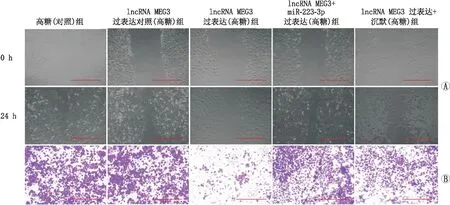
图3 共转染miR-223-3p对lncRNA MEG3过表达后hRECs愈伤以及迁移的影响 A:共转染miR-223-3p对lncRNA MEG3过表达后hRECs愈合能力的影响;B:共转染miR-223-3p对lncRNA MEG3过表达后hRECs迁移能力的影响。图中标尺为200 μm。
Transwell实验结果显示,高糖(对照)组hRECs迁移数[(385±41)个]与lncRNA MEG3过表达对照(高糖)组[细胞迁移数(352±37)个]差异无统计学意义(F=0.357,P=0.972);lncRNA MEG3过表达(高糖)组hRECs迁移数[(187±22)个]显著低于lncRNA MEG3过表达对照(高糖)组[细胞迁移数(352±37)个](F=35.725,P=0.003); lncRNA MEG3过表达(高糖)组hRECs迁移数显著低于lncRNA MEG3 +miR-223-3p过表达(高糖)组[细胞迁移数(322±34)个](F=33.338,P=0.004);而lncRNA MEG3过表达(高糖)组hRECs迁移数显著低于lncRNA MEG3过表达+沉默(高糖)组[细胞迁移数(309±28)个](F= 30.457,P=0.007)(图3B)。结果表明,lncRNA-MEG3可通过调控 miR-223-3p进一步影响hRECs的愈合和迁移能力。
2.7 lncRNA过表达对miR-223-3p下游靶点FBXW7的影响Western blot检测结果显示,正常(低糖)组hRECs中FBXW7蛋白相对表达量显著高于高糖(对照)组(F=195.226,P<0.001); lncRNA MEG3过表达(高糖)组hRECs中FBXW7蛋白相对表达量显著高于lncRNA MEG3过表达对照(高糖)组(F=185.443,P<0.001),而lncRNA MEG3+miR-223-3p过表达(高糖)组或lncRNA MEG3过表达+沉默(高糖)组中,这一趋势得以逆转(F=162.257,P<0.001;F=145.293,P<0.001)(图4)。这表明lncRNA MEG3为miR-223-3p的上游基因,可调控mir-223-3p的下游靶点并发挥作用;lncRNA MEG3、miR-223-3p以及FBXW7处于同一信号通路内。
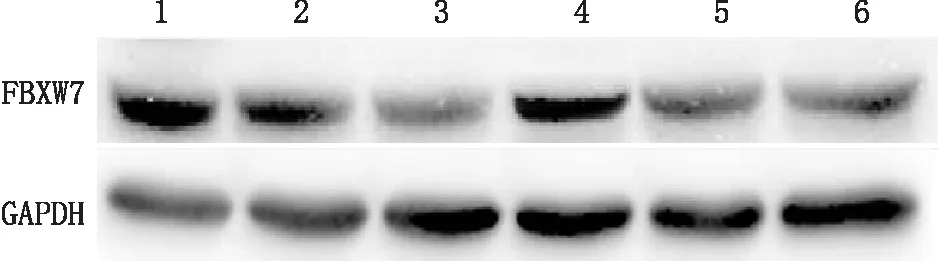
图4 Western blot检测各组hRECs内FBXW7蛋白表达 1:正常(低糖)组;2:高糖(对照)组;3:lncRNA MEG3过表达对照(高糖)组;4:lncRNA MEG3过表达(高糖)组;5:lncRNA MEG3+miR-223-3P过表达(高糖)组;6:lncRNA MEG3过表达+沉默(高糖)组。
2.8 PABPC1对hRECs中lncRNA MEG3相对表达水平的影响高糖条件下,hRECs中lncRNA MEG3的表达水平(1.00±0.05)为基准;相对于lncRNA MEG3过表达对照组(0.98±0.04),PABPC1基因的过表达则显著提升了hRECs中lncRNA MEG3的相对表达水平(1.64±0.13)(F=70.638,P=0.001);相对于lncRNA MEG3沉默对照(1.02±0.07),PABPC1基因的沉默则显著降低了hRECs中lncRNA MEG3的相对表达水平(0.49±0.03)(F=145.293,P<0.001)。这说明PABPC1可能是lncRNA MEG3的上游调控元件。
3 讨论
DR作为高致盲眼病之一,临床上尚无有效的根治方法。因此,全面了解 DR的潜在发病机制可为临床医师有效防治DR提供新的理论依据[13]。课题组曾研究发现,DR发病中,miR-223-3p的表达上调是导致细胞增殖的重要因素[12]。近年来,lncRNA被确定为新的转录和表观遗传网络的调节因子[14-15],lncRNA可以像分子“海绵”一样吸附下游miRNA而调节生物学功能[8-9]。即lncRNA可以竞争性地结合miRNA发挥作用。现有研究表明,lncRNA与一些眼部疾病及血管生成相关[10, 16]。在DR进展过程中,lncRNA-RNCR2、NEAT2、CDKN2B-AS1和PVT1均有显著变化[9]; lncRNA MALAT1通过调节 miR-125b/ve-cadherin 信号轴促进DR新生血管的生成。
本研究中,我们利用RegRNA以及miRcode等在线生物信息学预测工具预测了lncRNA MEG3和miR-223-3p存在两个潜在的结合位点,并进一步采用双荧光素酶基因报告实验进行验证,结果显示,miR-223-3p能够抑制带有野生型lncRNA MEG3序列质粒的荧光素酶活性,这说明两者是有直接结合的;而突变位点1后,荧光素酶活性显著下降,但下降幅度低于野生型,突变位点2后,荧光素酶活性下降幅度继续降低。这说明,预测的两个位点在lncRNA MEG3与miR-223-3p的结合中起重要作用,而突变位点2发挥了主要的作用。在高糖培养环境中,hREC中lncRNA MEG3表达显著低于正常低糖环境,这说明lncRNA MEG3在DR的相关生理环境中可能是受到抑制的。根据前期报道,在人主动脉内皮细胞内miR-223-3p 水平与lncRNA MEG3有一定的关系[11],而在本研究中,在高糖环境中lncRNA MEG3 过表达可以抑制hRECs的增殖能力、愈合能力以及迁移能力,但这种影响趋势能够被共转染的miR-223-3p或沉默lncRNA MEG3逆转,这说明miR-223-3p极有可能是lncRNA MEG3的直接下游靶点。此外,在前期研究中,miR-223-3p 的3’ UTR 区域被证明可以与FBXW7直接相互作用,并进一步影响 notch1通路[12,17]。因此,本研究观察了高糖环境中lncRNA MEG3过表达对FBXW7的影响,结果显示:过表达lncRNA MEG3能够显著提升hRECs中FBXW7蛋白表达水平,而共转染miR-223-3p或lncRNA MEG3后,该趋势被逆转。这进一步证实了高糖环境下lncRNA MEG3、miR-223-3p与FBXW7处于同一信号通路内。
根据前期报道,PABPC1是一种核酸结合蛋白,通过结合 RNA分子的 poly (a)尾部,参与调节途径和稳定lncRNA[18-20]。为了探索lncRNA MEG3的上游作用元件并解析高糖环境中lncRNA MEG3水平降低的分子机制,本研究利用调控PABPC1的水平来干预lncRNA MEG3,结果显示,高糖环境中,过表达PABPC1可以显著提升lncRNA MEG3在hRECs中的相对表达水平;而沉默PABPC1基因后,lncRNA MEG3相对表达水平也显著降低。这说明PABPC1极有可能是lncRNA MEG3的上游调控元件。
综上,本研究围绕hRECs展开体外细胞水平的工作,在模拟DR的高糖环境下,lncRNA MEG3被证实为miR-223-3p分子的直接上游调控元件,并通过miR-223-3p对hRECs的增殖、愈合以及迁移能力等进行抑制,同时也初步验证了lncRNA MEG3的上游调控元件可能为PABPC1。

