飞燕草素对光诱导小鼠视网膜感光细胞661W铁过载的调控作用△
傅晓颖 邓晓敏 陈倩云 彭佳媛 杜旌畅 朱彦锋 余小平
光是视觉产生和昼夜节律调节的基本要素,但过量光刺激可能导致视网膜光化学损伤(RPD)。研究证实,光诱导的氧化应激参与RPD 的始动环节[1]。在视网膜感光细胞中,铁离子作为重要的光转导酶辅助因子,能维持细胞正常代谢,而细胞内过量铁离子可通过芬顿反应产生大量活性氧(ROS),从而诱发氧化应激,加速视网膜退化或某些遗传性疾病的发生发展[2]。因此,平衡的铁代谢状态对于维持视觉功能及预防视力损伤至关重要。
年龄相关性黄斑变性(AMD)主要是由黄斑区老化及视网膜光损伤而导致的一种退行性视网膜疾病[3]。近年研究发现,AMD患者视网膜色素上皮中铁浓度增加,并继发性引起光感受器退化[4]。使用铁螯合剂可以螯合视网膜中的铁离子,减少铁诱导的氧化损伤,具有预防或治疗某些视网膜疾病的潜力[5-6]。花青素是一类具有多酚结构和强抗氧化性的天然黄酮类化合物。飞燕草素(Delphinidin)是花青素中抗氧化效应最强的代表成分,其表现出抗炎[7]、抗增殖和抗肿瘤[8]等多种生物活性。本课题组前期研究结果证实,在小鼠视网膜感光细胞661W与SD大鼠中,Delphinidin能通过调控氧化-抗氧化系统有效减轻细胞光化学损伤[9-10]。而RPD中是否存在过量铁离子,Delphinidin能否通过调节铁离子含量减少光诱导视网膜感光细胞死亡尚不清楚。故本研究以661W细胞为研究对象,以铁螯合剂DFP为阳性对照,探讨Delphinidin调节铁代谢保护光化学损伤661W细胞的可能效应与机制。
1 材料与方法
1.1 主要试剂及仪器(1)主要试剂:Delphinidin、DFP(美国Sigma公司),胎牛血清(美国Gibco公司),DMEM高糖培养基(美国Hyclone公司),CCK-8试剂盒(日本同仁公司),细胞凋亡与坏死检测试剂盒(中国碧云天公司),钙黄绿素-乙酰羟甲基酯荧光探针(Calcein-AM,英国Abcam公司),BODIPYTM 581/591 C11荧光探针(美国Thermo Fisher Scientific公司),转铁蛋白受体1(TfR1)抗体(英国Abcam公司),铁蛋白轻链(FTL)抗体、二价金属离子转运体1(DMT1)抗体、膜铁转运蛋白(Fpn)抗体(中国Proteintech公司),铁蛋白重链1(FTH1)抗体、兔二抗、鼠二抗(美国CST公司),GAPDH(中国ZSGB-BIO公司)。(2)主要仪器:CO2培养箱(美国Thermo Scientific公司);CMC-Ⅱ型细胞光照仪(自制,专利号:ZL201821939405.1);Power Wave XS2酶标仪(美国BioTek公司);IX71倒置荧光相差显微镜(日本 Olympus 公司);QuanteonTM流式细胞仪(美国ACEA Biosciences公司);电泳仪、ChemiDoc化学发光凝胶成像检测仪(美国BIO-RAD公司)。
1.2 细胞来源与培养方法661W细胞购于上海奥陆生物有限公司(源于美国俄克拉何马州大学),采用DMEM高糖培养基(含体积分数10% 胎牛血清、100 U·mL-1青霉素和100 g·L-1链霉素),置于37 ℃、含体积分数5% CO2培养箱内常规培养。
1.3 药物浓度筛选661W细胞接种于96孔培养板,每孔约为5×103个细胞,分别加入100 μL的含5 μmol·L-1、10 μmol·L-1、20 μmol·L-1、40 μmol·L-1、80 μmol·L-1、160 μmol·L-1Delphinidin或DFP的DMEM培养基培养24 h,每个浓度设3个复孔,按CCK-8试剂盒说明书步骤操作,酶标仪检测各孔450 nm的光密度(D),计算细胞活力,筛选Delphinidin和DFP的最佳作用浓度用于后续实验。
1.4 实验分组收集对数生长期的661W细胞进行分组处理,其中,(1) Control组:避光培养细胞24 h,换新培养基继续培养24 h;(2) Light组:(2000±200)lx白色荧光照射细胞24 h,换新培养基继续光照24 h;(3) Light + DFP组:(2000±200)lx白色荧光照射细胞24 h,换为含20 μmol·L-1DFP的培养基继续光照24 h;(4)Light+Delphinidin组:(2000±200)lx白色荧光照射细胞24 h,换为含5 μmol·L-1Delphinidin的培养基继续光照24 h;(5) Control+Delphinidin组:避光培养细胞24 h,换为含5 μmol·L-1Delphinidin的培养基继续培养24 h。
1.5 检测方法
1.5.1 各组661W细胞活力检测661W细胞接种于96孔培养板,每孔约为5×103个细胞,每组设3个复孔。分组处理后收集各组细胞,按CCK-8试剂盒说明书步骤操作,酶标仪检测各孔450 nm的D,计算细胞活力。
1.5.2 各组661W细胞膜受损程度661W细胞接种于96孔培养板,每孔约为5×103个细胞,每组设3个复孔。分组处理后收集各组细胞,使用细胞凋亡与坏死检测试剂盒中Hoechst染液与PI染液4 ℃孵育各组细胞30 min,倒置荧光显微镜下观察并拍照。
1.5.3 各组661W细胞铁含量测定661W细胞接种于6孔培养板,每孔约为1.5×105个细胞,每组设3个复孔。分组处理后收集各组细胞,用500 μL的1 μmol·L-1Calcein-AM荧光探针染液重悬细胞后,37 ℃避光孵育30 min,流式细胞仪FITC通道检测各组细胞平均荧光强度(MFI)。
1.5.4 各组661W细胞脂质过氧化物含量测定661W细胞接种于6孔培养板,每孔约为1.5×105个细胞,每组设3个复孔。分组处理后收集各组细胞,用500 μL的4 μmol·L-1BODIPYTM 581/591 C11荧光探针染液重悬细胞后,37 ℃避光孵育30 min,流式细胞仪FITC通道检测各组细胞MFI。
1.5.5 Western blot检测各组661 W细胞铁代谢相关蛋白表达分组处理后收集各组细胞,IP裂解液裂解细胞后,提取细胞内总蛋白并以BCA法测定蛋白浓度。每组取50 μg蛋白进行电泳,转膜、封闭后,分别加入DMT1、TfR1、FTL、FTH1、Fpn一抗稀释液摇床4 ℃孵育过夜,TBST洗膜后,加入相应二抗稀释液,再经ECL显影,ImageJ 软件分析各组细胞条带灰度值。
1.6 统计学分析采用SPSS 23.0软件进行统计学分析,计量资料均符合正态分布,以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。检验水准:α=0.05。
2 结果
2.1 Delphinidin和DFP对光损伤661W细胞的保护作用CCK-8法检测不同浓度Delphinidin和DFP对661W细胞活力的影响,结果见图1。由图1可知,Delphinidin IC50为124.7 μmol·L-1,其浓度在20 μmol·L-1以下能促进细胞生长;DFP IC50为137.2 μmol·L-1,其浓度在40 μmol·L-1以下能促进细胞生长。由此,设定Delphinidin与DFP的作用浓度分别为5 μmol·L-1和20 μmol·L-1。CCK-8法检测Delphinidin和DFP对光损伤后661W细胞活力的影响,结果显示: 与Control组相比,Light组细胞活力明显降低(P<0.05),Control + Delphinidin组细胞活力明显增加(P<0.05);与Light组相比,Light + DFP组和Light + Delphinidin组细胞活力均明显升高(均为P<0.05),表明DFP和Delphinidin可保护661W细胞减少光照损伤(表1)。
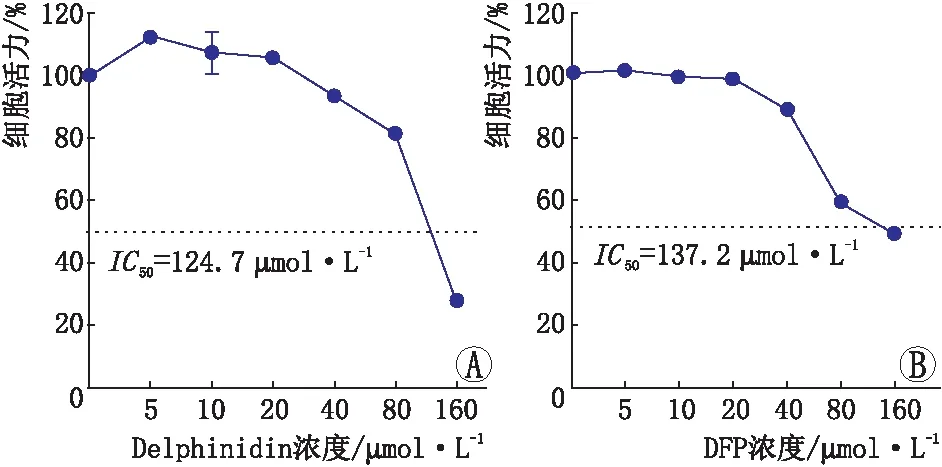
图1 Delphinidin、DFP对661W细胞的剂量-反应曲线 A:Delphinidin对661W细胞的剂量-反应曲线;B:DFP对661W细胞的剂量-反应曲线。
2.2 Delphinidin改善光损伤661W细胞的细胞膜功能Hoechst-PI染色能检测早期死亡细胞膜的通透性状态。PI无法穿透细胞膜,对于具有完整细胞膜的正常细胞或凋亡细胞不能染色;而Hoechst可穿透细胞膜,染色后凋亡细胞荧光表达明显增强。荧光显微镜下可见:Control组细胞未发生凋亡反应,细胞核呈现均匀一致的弱蓝色低荧光,Light组细胞荧光染色强度明显增强,细胞膜损伤严重,细胞死亡数量增加;与Light组相比,Light + DFP组和Light + Delphinidin组细胞荧光染色强度明显降低,细胞死亡数量减少,细胞膜受损程度降低(图2)。
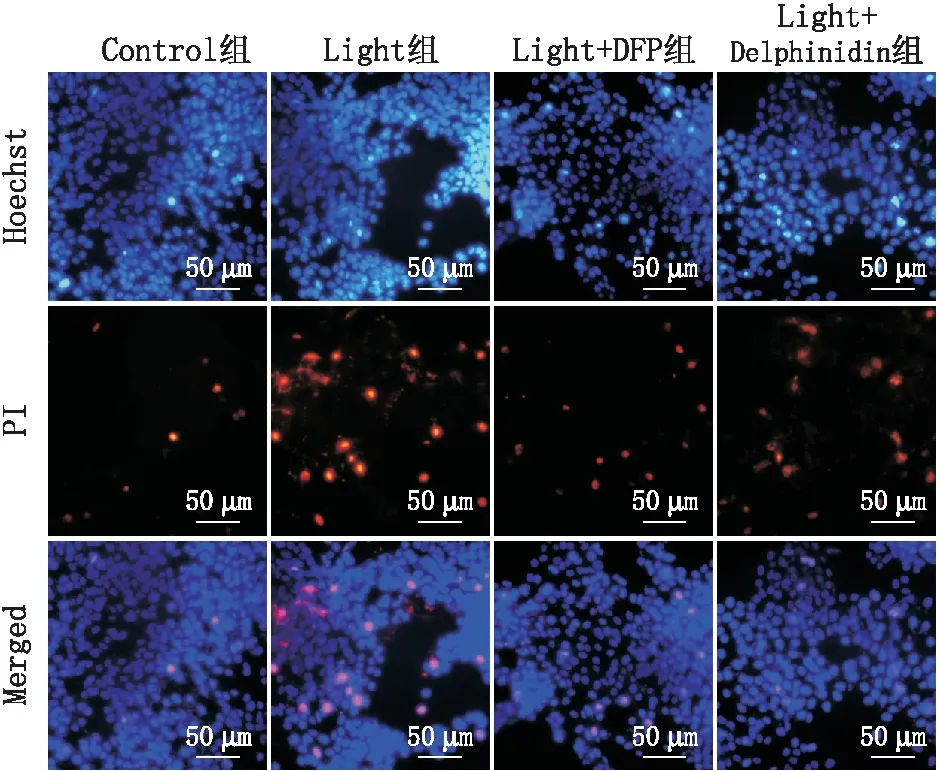
图2 各组661W细胞的Hoechst-PI双染图(×200) 正常细胞为弱红色荧光加弱蓝色荧光,凋亡细胞染色质会固缩呈亮蓝色荧光。
2.3 Delphinidin降低光损伤661W细胞铁含量Calcein-AM荧光探针能够进入细胞,结合细胞内铁离子后即被淬灭。因此,荧光信号强弱与细胞内铁含量成反比。各组661 W细胞铁含量检测结果表明:与Control组相比,Light组细胞铁含量显著增加,差异有统计学意义(P<0.05),提示Light组细胞内存在铁蓄积现象;与Control组相比,Control + Delphinidin组细胞铁含量无明显变化,差异无统计学意义(P>0.05);与Light组相比,Light + DFP组和Light + Delphinidin组细胞铁含量均明显降低,差异均有统计学意义(均为P<0.05),Delphinidin和DFP可减少光诱导的铁过载(图3和表1)。
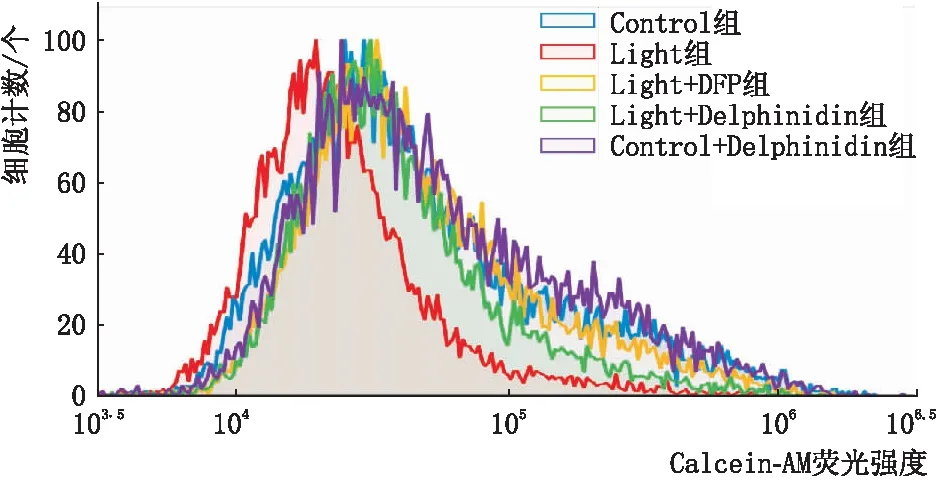
图3 各组661W细胞铁含量
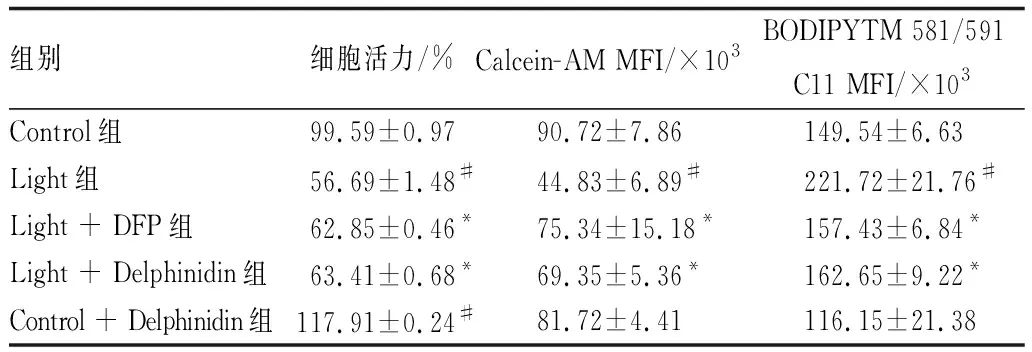
表1 各组细胞活力、Calcein-AM MFI、BODIPYTM 581/591 C11 MFI
2.4 Delphinidin减少光损伤661W细胞脂质过氧化物含量采用BODIPYTM 581/591 C11荧光探针检测细胞内脂质过氧化物水平,结果表明: 与Control组相比,Light组细胞MFI显著增加,差异有统计学意义(P<0.05),光照能诱导细胞脂质发生过氧化反应;与Control组相比,Control + Delphinidin组细胞MFI无明显变化,差异无统计学意义(P>0.05);与Light组相比,Light + DFP组和Light + Delphinidin组细胞MFI均明显降低,差异均有统计学意义(均为P<0.05),Delphinidin和DFP可减少661W细胞内脂质过氧化反应的发生(图4和表1)。
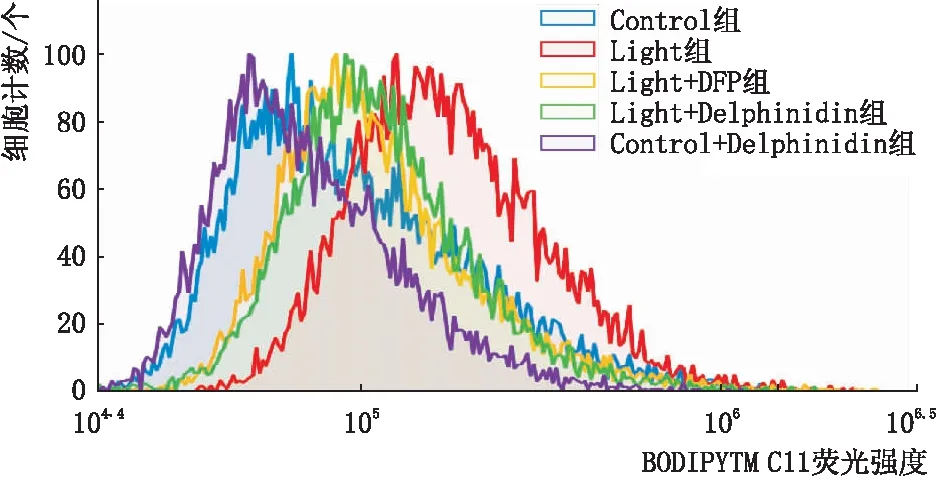
图4 各组661W细胞脂质过氧化物水平
2.5 Delphinidin对光损伤661W细胞铁代谢相关蛋白的影响Western blot检测结果表明:与Control组相比,Light组细胞DMT1、TfR1、FTL、FTH1蛋白表达水平均升高,Fpn蛋白表达水平降低,差异均有统计学意义(均为P<0.05);与Control组相比,Control+Delphinidin组细胞DMT1、TfR1和Fpn蛋白表达水平均升高,差异均有统计学意义(均为P<0.05),FTL、FTH1蛋白表达无明显变化,差异均无统计学意义(均为P>0.05);与Light组相比,Light + DFP组和Light + Delphinidin组细胞TfR1、Fpn蛋白表达水平均升高,DMT1、FTL和FTH1蛋白表达水平均降低,差异均有统计学意义(均为P<0.05)(图5和表2)。
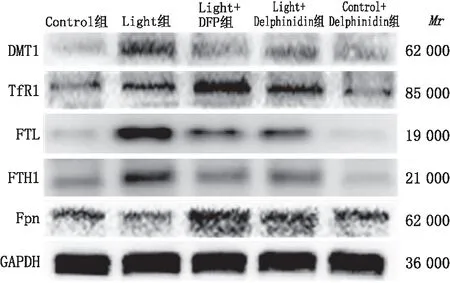
图5 各组细胞铁代谢相关蛋白表达情况

表2 各组细胞铁代谢相关蛋白表达水平
3 讨论
高强度或长时间光照会促使感光细胞线粒体生成大量ROS。ROS既是氧化产物,又可作为第二信使通过诱导应激反应或各种蛋白表达来激活不同信号通路,最终导致细胞死亡[11]。花青素存在于多种果蔬花卉中。由于Delphinidin B环上有三个羟基结构,其抗氧化能力最强[12]。本课题组前期研究证明Delphinidin可提高抗氧化酶系活性,并通过调节凋亡通路相关蛋白(iNOS、Bax、细胞色素 C、Cleaved-Caspase-3)的表达来降低光诱导的视网膜氧化应激损伤[9-10]。
因661W细胞具有视锥细胞的生化特性[13],故本研究以661W细胞建立RPD体外模型。结果显示,与Control组相比,Light组细胞活力显著降低,Hoechst-PI荧光染色强度显著增强,感光细胞的细胞膜受损明显,细胞死亡数量增加。不同浓度Delphinidin与DFP处理661W细胞24 h,结果发现,Delphinidin与DFP最佳作用浓度分别为5 μmol·L-1和20 μmol·L-1。与Light组相比,Light+DFP组与Light+Delphinidin组细胞活力均明显提高,Hoechst-PI荧光染色强度显著降低,提示Delphinidin能降低光诱导的细胞损伤,维持细胞膜完整性,减少细胞死亡。同时与Control组相比,Control + Delphinidin组细胞活力显著升高,表明5 μmol·L-1Delphinidin处理对661W细胞无毒副作用。
Daruich等[14]研究发现,视网膜脱离患者眼中铁含量随脱离时间的延长而增加,且与视力恢复不良相关。AMD患者视网膜色素上皮及Bruch膜中的铁含量增高,视网膜铁过载会加重AMD发展[15]。Imamura等[16]用2500 lx白色荧光灯照射661W细胞1 h、3 h、6 h和12 h并检测亚铁离子水平,发现光照超过6 h亚铁离子含量显著升高。本研究检测661W细胞铁含量的结果与之相似,与Control组相比,Light组细胞铁含量显著增加,视网膜存在铁蓄积现象,而与Light组相比,DFP或Delphinidin干预能明显减少661 W细胞铁含量,维护视网膜铁代谢稳态。
2012年,Dixon等[17]首次报道了铁死亡(ferroptosis)这一非凋亡性的新型细胞死亡方式。其特征是依赖铁离子的ROS积累,引起细胞氧化还原水平失衡,进而发生膜脂质过氧化反应损伤细胞膜的完整性,导致细胞死亡[18]。本课题组前期研究结果表明,Delphinidin可减少ROS含量,调节细胞抗氧化水平[9]。本研究结果证实,光照后细胞脂质过氧化物水平增多,DFP或Delphinidin能通过降低铁过载引起的脂质过氧化反应,减轻光诱导的视网膜氧化损伤。此外,其他花色苷或叶黄素也可增加抗氧化酶的表达[19-20],减少脂质过氧化物含量,保护视网膜色素上皮细胞[21]。
细胞内的铁稳态由多种调控因子参与。铁离子主要与转铁蛋白(Tf)和TfR1结合进入细胞[22-23],然后通过DMT1进入细胞质,细胞内过量铁储存于FTL和FTH1内。临床研究结果显示,AMD患者的血液中Tf和TfR1浓度均显著增加[24],AMD患者血液中铁蓄积与铁的摄取异常有关。Hadziahmetovic等[25]通过微阵列分析小鼠视网膜光损伤中铁调节基因的变化,发现TfR1和FTL基因表达上调。Imamura等[16]研究证明,在光损伤661W细胞体外模型中,TfR1和FTH1基因表达均随光照时间依赖性增加。本研究结果也发现,与Control组相比,Light组细胞DMT1、TfR1、FTL和FTH1蛋白表达水平均升高;与Light组相比,DFP或Delphinidin作用后DMT1、FTL和FTH1蛋白表达水平均降低,提示Delphinidin可以通过下调铁离子的摄取与储存,改善细胞铁过载。但DFP或Delphinidin作用后TfR1蛋白表达仍显著增加,提示Delphinidin作用后细胞内铁离子减少会促使TfR1蛋白表达代偿性增加。Fpn是目前发现的细胞内唯一的排铁蛋白。Theurl等[26]提出,铁离子可通过血管内皮中的Fpn进入视网膜,再由Müller细胞转运至光感受器细胞外段,最终从视网膜色素上皮排出,形成铁离子从光感受器到血液的循环。本研究发现,与Control组相比,Light组细胞Fpn蛋白表达水平降低,表明光照诱导视网膜铁含量升高可增加铁调素表达,从而引起血管内皮细胞Fpn的降解,限制铁离子进入视网膜。而与Light组相比,DFP或Delphinidin干预后Fpn蛋白表达水平回升,表明Delphinidin作用后细胞内铁含量降低,为增加细胞内可利用铁离子,视网膜血管内皮细胞Fpn蛋白表达升高。以上结果表明,Delphinidin能从铁的摄取、储存、利用等方面调控铁代谢相关蛋白的表达,维持661W细胞的铁稳态。
综上,Delphinidin可通过调节铁代谢相关蛋白表达,缓解光诱导的661W细胞铁过载,进而抑制脂质过氧化反应,减少视网膜氧化损伤。本研究证明RPD的发生机制中涉及视网膜感光细胞铁过载。但RPD中铁过载是否发展为铁死亡,还需从胱氨酸/谷氨酸逆向转运体途径、脂质代谢途径、铁死亡调节因子等多方面进一步探讨。本研究为黄酮类化合物预防和治疗RPD提供了新的理论依据,对探讨铁死亡在RPD中的作用机制提供一定参考。

