糖尿病视网膜病变患者发病危险因素:基于SS-OCTA检测指标的分析△
赵芳 裴超 蔡志鹏 张红
2030年,据预测全球糖尿病罹患率约为4.4%。虽然2000年估计有1.71亿糖尿病患者,但预计到2030年,其数量将增加一倍余,达到3.66亿[1]。糖尿病视网膜病变(DR)是不可逆的视力障碍和失明的主要原因,几乎35%的糖尿病患者受到其影响。DR是糖尿病导致的严重的眼部微血管并发症,由于长期高血糖的影响,视网膜血管内皮细胞受损、血-视网膜屏障遭到破坏,视网膜微小血管和神经元受到损害;眼底出现不同程度的微血管瘤、渗出、出血、静脉改变、新生血管生成等病变[2]。
光学相干断层扫描血管成像(OCTA)是近年来发展起来的一种快速而安全的评估视网膜微血管系统的新技术,具有比传统FFA更高的对比度和分辨率,能使视网膜血管系统无创可视化,并允许在毛细血管水平上精确评估血管损伤。既往我们使用OCTA时发现DR患者浅层毛细血管丛血流密度(SCP)、深层毛细血管丛血流密度(DCP)和脉络膜毛细血管的血流密度均降低。有研究发现,DR患者的脉络膜血管指数(CVI)较正常人低,且CVI与视网膜色素上皮(RPE)层厚度呈正相关,与外核层、光感受器细胞层和脉络膜厚度呈负相关[3]。超广角扫频源OCTA(SS-OCTA)是继时域OCT、普通频域 OCT之后的第三代频域OCT技术。与前两代OCT技术相比,具有扫描速度更快、图像信噪比更高、穿透深度更深的特点。SS-OCTA在成像深度上比普通频域OCT具有明显的优势,1050 nm波长光线在眼底不容易被组织吸收,在白内障、眼底出血、脉络膜疾病等的诊断中具有重要参考价值。SS-OCTA改变了我们接近脉络膜的方式,可以直接对CVI以及脉络膜毛细血管灌注进行自动测量。本研究采用二元Logistic回归分析对本院收治的120例DR及非DR(NDR)患者采集到的SS-OCTA数据进行分析研究,以便为早期DR的筛查工作提供临床依据。
1 资料与方法
1.1 一般资料收集2020年9月至2021年4月于本院就诊的2型糖尿病120例患者的临床资料,所有患者均签署知情同意书,根据患者是否合并DR,分为DR组(n=60)与NDR组(n=60)。2型糖尿病诊断标准:既往诊断为2型糖尿病或者经非同日3次静脉空腹血糖>7.0 mmol·L-1、随机血糖>11.1 mmol·L-1的首诊患者。DR诊断标准:(1)诊断为2型糖尿病;(2)符合国际眼科协会发布的DR诊断标准[4],眼底检查视网膜有典型的微血管瘤、渗出、出血、静脉串珠样改变及视网膜内微血管异常,眼底荧光血管造影显示片状无灌注区等,或发生增生性玻璃体视网膜病变。纳入标准:(1)符合2型糖尿病或DR的诊断标准;(2)年龄20~80岁;(3)视网膜各层结构清晰;(4)患者知情同意。 排除标准:(1)排除患有其他视网膜疾病者,如视网膜静脉阻塞、 视网膜动脉阻塞、高血压视网膜病变等;(2)排除屈光间质不清、核性白内障患者,排除固视、配合欠佳者;(3)排除OCT显示视网膜明显水肿、视网膜脱离者。
1.2 测量方法所有受试者均行SS-OCTA[视微影像(河南)科技有限公司,型号:VG200D]扫描,所有扫描均在滴用5 g·L-1复方托吡卡胺滴眼液和100 g·L-1去氧肾上腺素散瞳后采集图像。采用3 mm×3 mm模式进行en face和B-scan扫描,自动获得以下测量值:黄斑中心凹厚度(CMT)、视网膜外层厚度、SCP(去除大血管)、DCP、脉络膜毛细血管灌注(CPI)、CVI,采用手动分层对图像进行分层后得出RPE层、光感受器细胞层(IS/OS;即从外界膜到RPE层上界)的厚度值。所有扫描均由同一名经验丰富的操作员进行。

2 结果
2.1 一般资料两组患者临床资料对比见表1。由表1可见,DR组患者年龄高于NDR组,糖尿病病程长于NDR组,男性患者占比高于NDR组,差异均具有统计学意义(均为P<0.05);NDR组患者的IS/OS厚度、DCP、CPI、SCP(除去大血管)均高于DR组,差异均有统计学意义(均为P<0.001);DR组与NDR组患者的CMT、视网膜外层厚度、RPE层厚度、CVI相比,差异均无统计学意义(均为P>0.05)。

表1 两组患者的临床资料特征
2.2 单因素Logistic回归分析通过单因素Logistic回归对所有因素进行初筛后发现,年龄、性别、糖尿病病程、IS/OS层厚度、DCP、CPI、SCP(除去大血管)与DR发病存在相关性(均为P<0.05),CMT、视网膜外层厚度、RPE层厚度、CVI与DR发病均不相关(均为P>0.05)(表2)。

表2 DR患者单因素Logistic回归结果分析
2.3 多因素Logistic回归分析采用逐步回归法自动筛选有意义的变量。多因素Logistic回归分析结果表明,IS/OS层厚度,DCP、糖尿病病程、SCP(去除大血管)是DR发病的独立危险因素(表3)。将上述多因素分析变量引入多元回归方程,建立其预测模型为:Logit(p)=32.371-0.200×SCP(除去大血管)-0.320×DCP-0.182×(IS/OS层厚度)。

表3 DR患者多因素Logistic回归分析结果
2.4 构建ROC曲线评价Logistic回归预测模型模型系数总检验P<0.001,表明模型总体有意义,经Hosmer-Lemeshow拟合优度检验,χ2=13.066,P=0.110,说明模型预测概率与实际发生率差异无统计学意义,表明模型拟合优度较好。通常ROC曲线的AUC取值范围为0≤AUC≤1,在AUC大于0.5的情况下,AUC越接近于1说明诊断的准确性越高。一般认为0.5
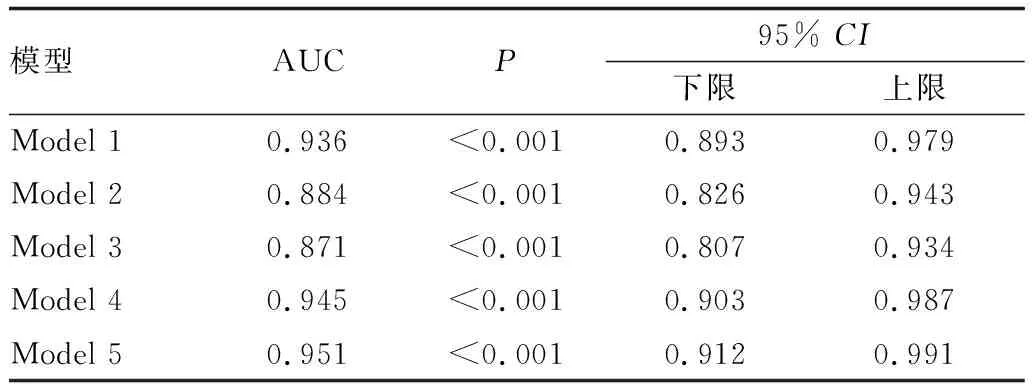
表4 Logistic回归各预测模型的ROC曲线的AUC

图1 Logistic回归各预测模型的ROC曲线
3 讨论
近年来,DR发病率逐年升高,严重影响了患者的生活质量。目前DR的发病机制尚不明确,使得临床中对DR 的认识存在局限,对其发病相关危险因素的研究可以为早期防治提供依据。本研究基于SS-OCTA检测结果,采用Logistic回归对危险因素进行分析,以期为本病临床防治提供思路。
本研究的结果中,DR组男性患者占比较NDR组高,差异具有统计学意义,这一结果与Damian等[3]的研究结果一致,考虑可能与男性嗜烟酒比例相对更高相关。本研究中DR患者的发病与较长的糖尿病病程、较大的年龄相关。Zhang等[5]研究也发现了DR患病率与较长的糖尿病病程[OR=1.06;95%CI为1.03~1.10]之间存在关联。
在本研究结果中,SCP(除去大血管)、DCP血管密度及IS/OS层厚度是早期DR发病的独立危险因素。DR是糖尿病微血管病变的长期表现,影响近50%的糖尿病患者,视网膜内血管包含两种不同的毛细血管丛,SCP位于神经纤维和神经节细胞层,而DCP位于内核层和外丛状层的外缘。本研究结果显示,DR患者的SCP(除去大血管)、DCP较NDR患者降低,Carnevali等[6]、Dimitrova等[7]基于OCTA的研究结果显示,NDR患者黄斑区视网膜SCP和DCP的血管密度显著降低。
脉络膜毛细血管为视网膜外层提供氧气和代谢交换,包括RPE层和光感受器细胞层。RPE-光感受器复合体在视网膜中具有最高的代谢需求,视网膜循环提供了约15%的光感受器内节代谢活性,当缺氧导致脉络膜循环受损时,视网膜循环外层的氧气供应增加,表明脉络膜和视网膜循环均供应光感受器细胞的代谢需求。由于脉络膜毛细血管本身不具有自动调节功能,当脉络膜循环下降时,进一步的外层毛细血管丛受损导致光感受器细胞损伤。但目前尚不清楚脉络膜改变是视网膜病变进展的原因还是结果。Nagaoka等[8]研究NDR患者的临床前改变,结果显示,与DR患者相比,NDR患眼的脉络膜黄斑中心凹血流面积显著减少,提示DR患者的早期血液循环受损可能始于黄斑中心凹脉络膜层。本研究对两组患者CPI进行卡方检验发现,DR组CPI明显小于NDR组,与Nagaoka等[8]的研究结果一致。据此我们推测,DR组患者IS/OS层变薄与CPI减少相关,脉络膜缺血使IS/OS层得不到滋养,故而IS/OS层厚度变薄。Borrelli等[9]通过对NPDR患者椭圆体区反射率的测量发现,脉络膜毛细血管灌注与IS/OS层的健康有着很强的联系,强调了视网膜外层对脉络膜营养和氧合的依赖性[10]。这也解释了本结果中DR组患者IS/OS层变薄,源于脉络膜缺氧后对IS/OS层的滋养减少。Gella等[11]和Tonade等[12]均认为,光感受器细胞层厚度的减少,可以通过光感受器细胞本身对潜在损伤性升高的葡萄糖环境产生的超氧化物和可溶性炎症因子增加来解释。
CVI是血管腔面积与脉络膜总面积的比值,是一种新的生物测量指标,正在逐渐被应用于各种眼部疾病的脉络膜结构观测中。尽管吲哚菁绿血管造影被认为是脉络膜检查的金标准,但由于具有侵入性,吲哚菁绿血管造影较少作为监测工具的优先选择[13]。有证据表明,糖尿病患者脉络膜血管的大小和密度均降低,如Ferrara等[14]研究显示,糖尿病患者Sattler层和Haller层的中间和大血管丢失,DR患者的CVI较正常人降低。本研究结果提示,DR组与NDR组CVI差异无统计学意义,结论的不同可能与测量的黄斑中心凹下脉络膜区域面积不同或不同的仪器类型CVI的算法、测量手段存在差异等有关。
本研究通过二元Logistic回归建立DR发病概率预测模型,糖尿病病程、SCP(除去大血管)、IS/OS层厚度、DCP在分析中均具有统计学意义。进入回归方程分析,采用ROC曲线法对概率预测模型进行评价,预测准确率高达95.1%,说明模型预测效果较好,能较为准确地预测DR发病率。该模型能够提供定量决策依据,这对于临床医生对患者的快速诊断及早期干预很有利,为早期筛查DR提供方便、快捷的工具。

