阿帕替尼对二线治疗失败的ⅢB期和Ⅳ期胃癌患者免疫细胞的影响
姚忠强,王斐斐,马建梅,曲凯,何婷
阿帕替尼是一种新型血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI),目前常应用于消化道肿瘤、肺癌等多种肿瘤的治疗[1]。阿帕替尼主要通过高选择性地抑制VEGFR-2酪氨酸激酶活性而抑制肿瘤的血管生成[2]。2014年在我国被批准用于晚期(ⅢB期和Ⅳ期)胃癌、胃食管结合部腺癌三线及三线以上治疗[3]。尽管对晚期胃癌患者治疗较为困难,但值得欣慰的是,国内外已经有多个研究证实阿帕替尼对晚期胃癌具有积极的治疗效果[4-5]。尽管目前的研究中报道了使用阿帕替尼引起的不同类型的药物不良反应,但目前为止关于阿帕替尼对ⅢB期和Ⅳ期胃癌患者的免疫系统的影响尚未研究。基于此,本研究探讨口服阿帕替尼对ⅢB期和Ⅳ期胃癌、胃食管结合部腺癌患者的免疫细胞的影响,并试图分析可以预测患者预后的免疫学指标。
1 资料与方法
1.1 研究对象
选取2017年1月至2019年12月在西安交通大学医学院收治并接受阿帕替尼治疗的晚期胃癌、胃食管结合部腺癌患者共42例,其中男性17例,女性25例;年龄29~66岁,中位年龄56岁;ⅢB期3例,Ⅳ期39例。纳入标准:①经细胞学或病理学诊断为晚期胃癌、胃食管结合部腺癌;②EGFR突变检测为阴性;③年龄18~70岁;④晚期(ⅢB期、Ⅳ期)胃癌、胃食管结合部腺癌二线治疗失败;⑤预计生存时间3个月以上;⑥接受阿帕替尼治疗前3 d内和治疗后1个月检测了T细胞和T细胞亚群。排除标准:①无法耐受药物治疗;②脑转移、脊髓压迫,合并严重心肾肝等重要脏器疾病;③既往接受其他VEGFR药物治疗;④无法控制的高血压(收缩压>140 mmHg,舒张压>90 mmHg)、凝血功能障碍。本研究开始前获得了西安交通大学医学院附属医院伦理委员会备案,获得患者知情同意。
1.2 临床资料收集
收集纳入研究患者的年龄、性别、免疫细胞检测(包括血清CD4+CD25+T细胞、NK细胞和T细胞亚群)、患者阿帕替尼治疗方案、既往化疗方案、肿瘤转移情况。
收集患者接受阿帕替尼治疗前3 d内和治疗1个月后的免疫细胞亚群的资料。免疫细胞亚群由西安交通大学医学院附属医院检验科采用流式细胞技术检测完成,所用抗体:CD3抗体(货号:ab135372,批号GR84367-1)、CD4抗体(货号:ab133616,批号BR136431)、CD8抗体(货号:ab237709,批号GR22460)、CD16抗体(货号:ab246222,批号GR120296-13)、CD25抗体(货号:ab10558,批号GR91934)、CD45抗体(货号:ab40763,批号GR87845)、CD56抗体(货号:ab220360,批号GR139085-1)、CD127抗体(货号:ab280355,批号GR97564-1)均购自英国Abcam试剂公司。
1.3 治疗及随访资料
患者服用甲磺酸阿帕替尼片(江苏恒瑞医药),0.85 g,餐后,1/d。患者出现疾病进展时停用药物,更换其他治疗方案。
收集患者接受治疗后1年内的随访情况,首次随访为治疗后1个月,之后每2个月复查一次。采用实体肿瘤疗效评估(Response Evaluation Criteria in Solid Tumors, RECST)1.1标准评价患者治疗情况[6],记录患者的疾病进展或疾病相关的死亡为无进展生存期(progression free survival,PFS)。同时记录药物毒副反应。
1.4 统计分析

2 结果
2.1 患者治疗前后外周血免疫细胞亚群变化
与治疗前相比,患者服用阿帕替尼1月后外周血的CD4+CD25+T细胞和CD4+CD25+CD127low/-Treg细胞比例明显升高(P<0.05),其他免疫细胞亚群比例变化差异无统计学意义,见表1。
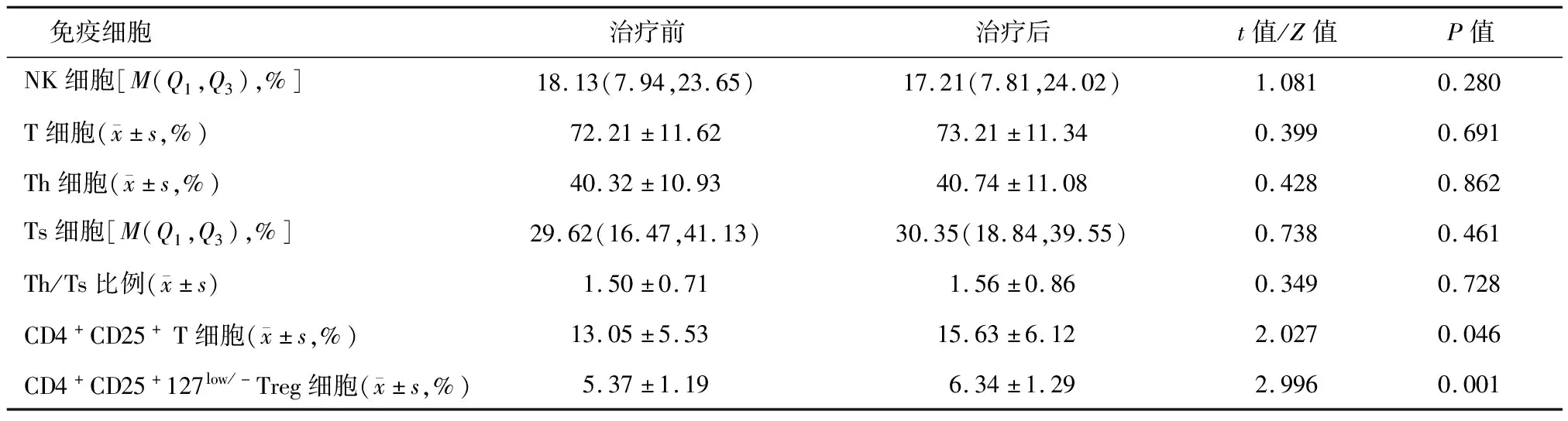
表1 42例患者阿帕替尼治疗前后免疫细胞特征
2.2 免疫细胞变化与PFS关系
患者随访满1年时,PFS共9例,使用Kaplan-Meier法分析全部患者的中位PFS为4.25个月,(图1)。
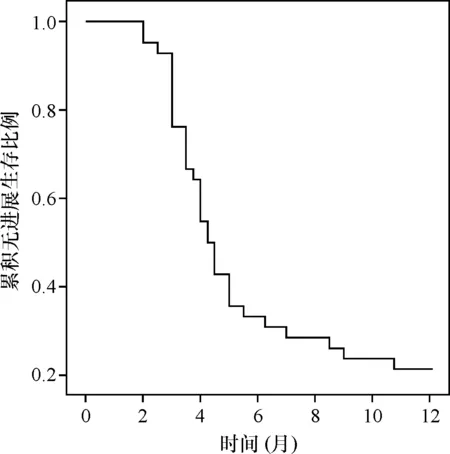
图1 阿帕替尼治疗后1年的患者PFS情况
为分析不同参数与患者PFS的关系,对患者进行了再次分组。以全部患者年龄中位数分成≥56岁组和<56岁组;根据阿帕替尼治疗1月后每一种免疫细胞上升或下降情况分为上升组和下降组。经比较可见,治疗1个月后CD4+CD25+T细胞上升组患者中位PFS优于CD4+CD25+T细胞下降组患者(P=0.000)。患者年龄、性别、胃癌分期、治疗1月后 NK细胞、T细胞、T细胞、Ts细胞、Th/Ts、CD4+CD25+127low/-Treg细胞变化造成的PFS差异,无统计学意义(P>0.05),详见表2。不同CD4+CD25+T细胞变化患者治疗后1年PFS情况见图2。
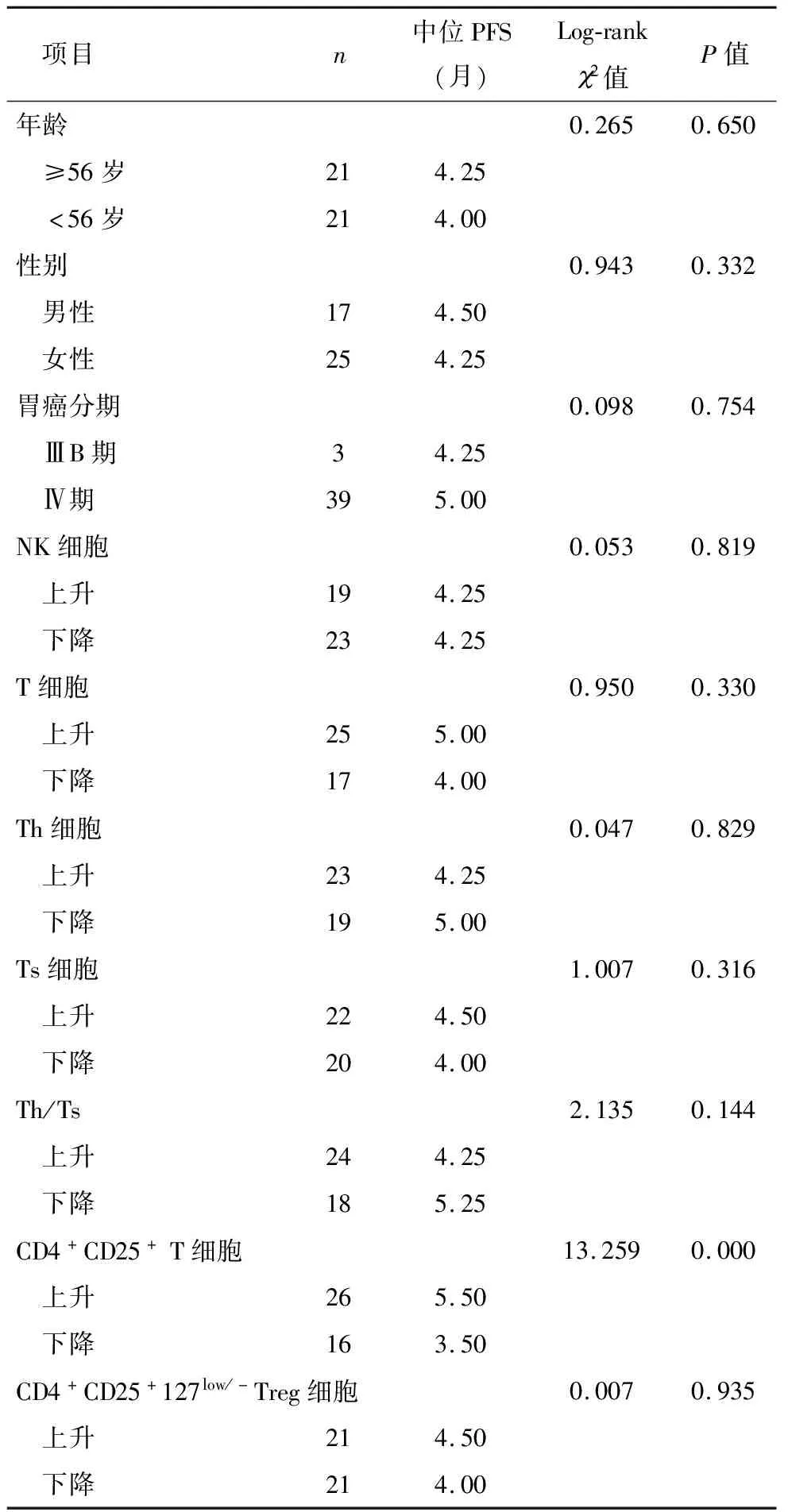
表2 患者临床资料及免疫细胞变化与PFS关系
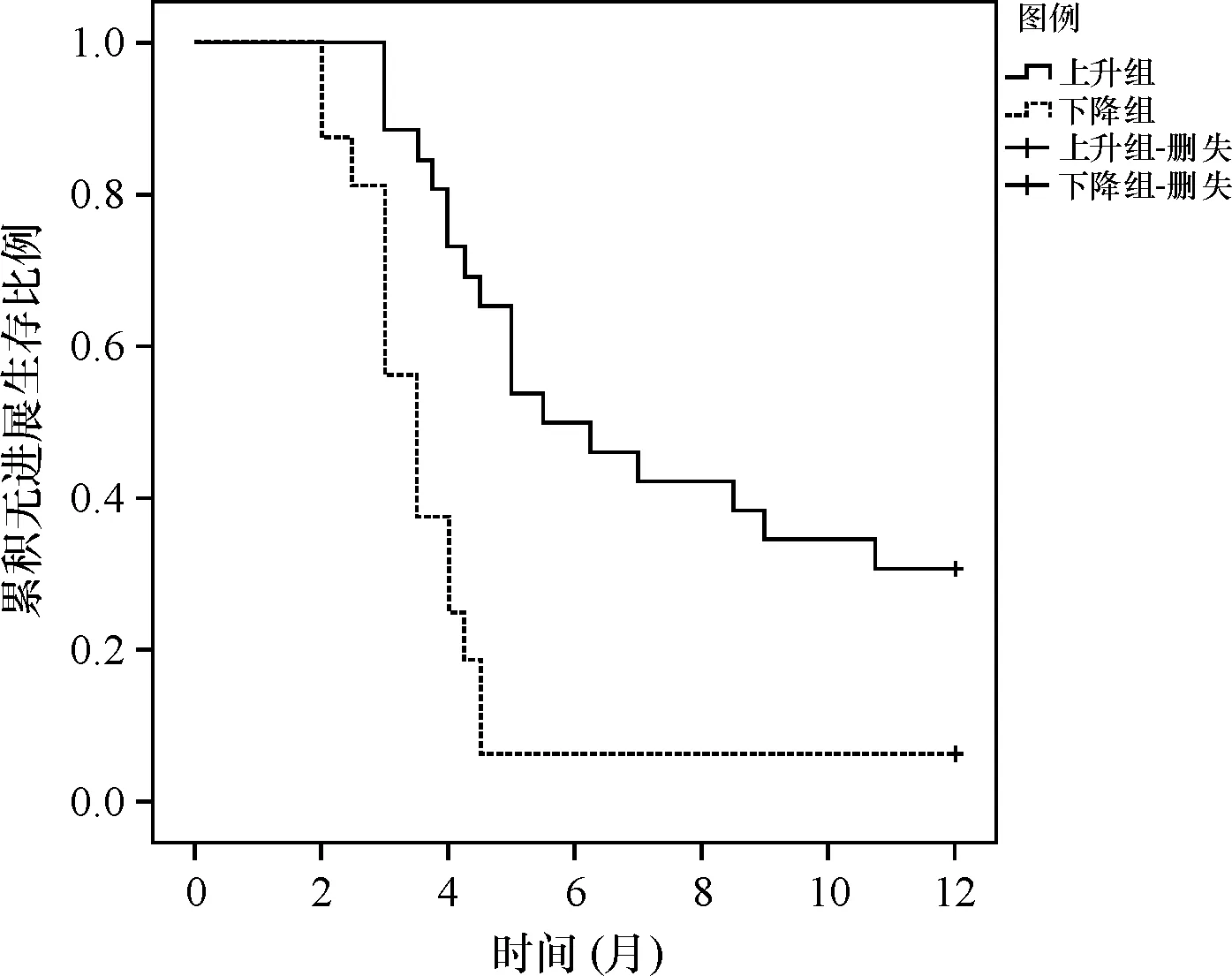
图2 不同CD4+CD25+T细胞变化患者治疗后1年PFS情况
2.3 患者的PFS影响因素
使用Cox风险比例回归分析本研究纳入的可能影响患者PFS的危险因素,结果可见仅治疗后CD4+CD25+T细胞减少是PFS的危险因素,RR=1.324(95%CI: 1.063~1.649),P=0.012,Wald值为6.279,SE为0.112,β值为0.281。
2.4 不良反应
与药物相关的不良反应依次为痤疮样皮疹20例(47.6%)、皮肤干燥15例(35.7%)、腹泻11例(26.19%)、恶心6例(14.29%)、肝功能异常1例(2.38%)。患者上述反应均能耐受,完成药物治疗。
3 讨论
ⅢB期和Ⅳ期胃癌、胃食管结合部腺癌的治疗一直缺乏有效的治疗方法[7-8]。阿帕替尼是一种通过抑制VEGF通路而降低肿瘤微血管密度和血管生成的酪氨酸激酶抑制剂[9-10]。在我国阿帕替尼最早于2014年被批准作为进展期胃癌患者的治疗药物[3]。目前关于阿帕替尼在食管癌、肺癌、肝癌、卵巢癌等其他多种肿瘤的治疗效果已被证实[11-14]。在实际临床工作中,我们发现有些患者在阿帕替尼治疗后会有很长的PFS,而有的患者病情进展很快。然而到目前为止,尚缺乏阿帕替尼使用后有效预测晚期患者预后的标志物。由于免疫细胞在肿瘤的发生和治疗过程中发挥着重要作用[15],因此,本研究探讨了阿帕替尼对ⅢB期和Ⅳ期胃癌患者免疫系统的影响,并试图分析免疫系统变化与阿帕替尼治疗后患者预后关系。
细胞免疫对肿瘤微环境的变化起到重要影响,我们重点分析了接受阿帕替尼治疗后ⅢB期和Ⅳ期胃癌、胃食管结合部腺癌患者T细胞及细胞亚群的变化。比较治疗前后1个月患者免疫细胞情况发现,使用药物治疗后患者外周血的CD4+CD25+T细胞和CD4+CD25+CD127low/-Treg细胞上升明显。CD4+CD25+T细胞是维持机体免疫反应的重要调节性T细胞,占外周CD4+T细胞的5%~10%。近年来发现CD4+CD25+T细胞在肿瘤的发生发展中起关键作用[16]。大量研究表明,CD4+CD25+T细胞在监测肿瘤方面发挥作用,如宫颈癌、胃癌等多种肿瘤患者研究中均发现了CD4+CD25+T细胞水平升高[17-18]。
然而CD4+CD25+T细胞升高不利于机体对肿瘤细胞的有效免疫应答[19]。CD4+CD25+T细胞可以抑制Vα24+NKT细胞亚群,包括Vα24+CD4-CD8-细胞、Vα24+CD4+和Vα24+CD8+,也抑制如干扰素γ、IL-4、IL-13和IL-10等细胞因子的产生,而导致肿瘤细胞的免疫应答降低[20-21]。CD4+CD25+T细胞比率升高抑制Vα24+NKT细胞的细胞毒活性,从而降低了Vα24+NKT细胞的抗肿瘤作用[22-23]。
CD4+CD25+T细胞在诱导肿瘤免疫耐受和维持肿瘤免疫自稳中起重要作用。CD4+CD25+T细胞根据来源不同可分为天然Tregs(natural Treg, nTreg)和诱导产生的Treg(inducedTreg, iTreg)[24]。天然Treg来源于胸腺细胞,可表达Foxp3表达;诱导产生的Treg是CD4+T细胞在受到特异性抗原刺激和细胞因子诱导在外周转化而成,不同程度地表达CD25,表达Foxp3不稳定[16]。CD4+CD25+CD127low/-Treg细胞被认为更能反映CD4+CD25+T细胞水平,其与肿瘤免疫逃逸等多种肿瘤免疫调控相关。我们研究发现经阿帕替尼治疗1个月后ⅢB期和Ⅳ期胃癌、胃食管结合部腺癌患者的CD4+CD25+T、CD4+CD25+CD127low/-Treg细胞出现一定程度上升,且治疗1月后外周血CD4+CD25+T细胞上升的患者的PFS更长。然而,既往有研究表明CD4+CD25+Treg细胞的高表达率与预后不良密切相关[25]。这和我们的观察结论相反,具体机制仍值得探讨。
阿帕替尼主要作用于VEGFR2受体,而抑制血管内皮生长因子刺激、抑制内皮细胞迁移,从而实现抑制新血管形成和肿瘤细胞的生长的目的。国外研究发现患者的CD4+T细胞可产生大量的VEGF,这些VEGF可能诱导VEGFR过表达,从而提高阿帕替尼的疗效[26]。这一现象可能表明阿帕替尼具有诱导机体产生适应性免疫的作用。一项研究发现,临床上可使用小剂量化疗药物来减少Treg介导的免疫抑制。阿帕替尼可降低Treg介导的免疫抑制作用,使患者获得良好的治疗效果。收集阿帕替尼治疗后药物不良反应可见,患者主要以皮肤反应和消化道反应为主,但都不影响患者继续使用药物治疗。
综上所述,CD4+CD25+T细胞对接受阿帕替尼治疗的二线治疗失败的ⅢB期和Ⅳ期胃癌、胃食管结合部腺癌患者具有重要意义。治疗1个月时CD4+CD25+T细胞计数上升是阿帕替尼治疗后PFS延长的有利因素。当然本研究纳入患者数量有限,今后仍需要进一步多中心大样本研究,此外对免疫细胞的动态随访和检测也是今后值得研究的方向。

