肿瘤微环境在胰腺癌中的预后分析
戴云蕊,洪坤巧,陈军
肿瘤微环境(tumor microenvironment,TME)是肿瘤所处的细胞环境。它由免疫细胞、间充质细胞、内皮细胞以及炎症介质和细胞外基质(extracellular matrix,ECM)组成。在TME中,免疫细胞和基质细胞是非肿瘤成分的两种主要类型,并被认为对肿瘤的诊断和预后评估具有重要意义[1]。
胰腺癌(pancreatic adenocarcinom,PAAD)是常见的消化系统恶性肿瘤之一,起病隐匿,进展迅速,预后极差,其5年总生存率仅为8%[2-3]。据统计,2018年全球PAAD新发病例数超过45万,其中死亡病例超过43万[4]。PAAD的特征是癌细胞周围发生剧烈的间质增生反应。此外,由于复杂的TME和高组织液压力,PAAD大多对放化疗耐受,这给治疗带来了重大的挑战[5]。TME中各种成分与肿瘤细胞之间的相互作用抑制了机体逃避免疫细胞凋亡的免疫反应,导致肿瘤的发生、转移和免疫逃逸。因此,肿瘤微环境是决定胰腺癌预后的重要因素之一。但是,肿瘤微环境如何控制胰腺癌的发生、进展及预后的机制尚不十分清楚。本文旨在分析PAAD微环境中具有预后价值的基因,以期为进一步研究提供新的方向。
1 资料与方法
1.1 数据库
自癌症基因组图谱(TCGA)(http://portal.gdc.cancer.gov/projects)下载PAAD患者的基因表达谱和临床资料,采用log2(x+1)转换,并在UCSC(https://xenabrowser.net/datapages/)将其处理到Xena存储库。通过将ESTIMATE算法(https://bioinformatics.mdanderson.org/public-software/estimate/)应用于下载的数据库来计算免疫评分和基质评分。
1.2 差异表达基因(differentially expressed genes,DEGs)分析
使用limma包对每个芯片数据集进行差异分析,选择阈值为|log2FC|>1且FDR<0.05。
1.3 DEGs富集分析
采用DAVID数据库(https://david-d.ncifcrf.gov/summary.jsp)进行DEG功能富集分析,以确定基因肿瘤学(gene oncology,GO)特征,包括生物学过程(biological processes,BP)、分子功能(molecular functions,MF)和细胞成分(cellular components,CC)。FDR<0.05。
1.4 总体生存曲线
制作Kaplan-Meier图以说明患者的总生存(overall survival,OS)与DEGs的基因表达水平之间的关系。采用单因素Cox回归分析筛选出与生存显著相关的DEGs,采用对数秩检验进行验证,以P<0.05为差异具有统计学意义,OS的单位为d。
2 结果
2.1 患者的临床病理特征
从TCGA数据库下载了在2001年至2013年间进行初步病理诊断的179例PAAD患者的基因表达谱和临床信息。其中,男性99例(55.3%),女性80例(44.7%)。82例患者(45.8%)小于65岁,97例患者(54.2%)大于等于65岁。组织学分级G1 31例(17.3%),G2 96例(53.6%),G3 48例(26.8%),G4 2例(1.1%),GX 2例(1.1%)。病理诊断为胰腺导管腺癌的患者为147例(82.1%),其他患者为32例(17.9%),包括胶质癌、未分化癌等。表1显示了PAAD临床病理特征。
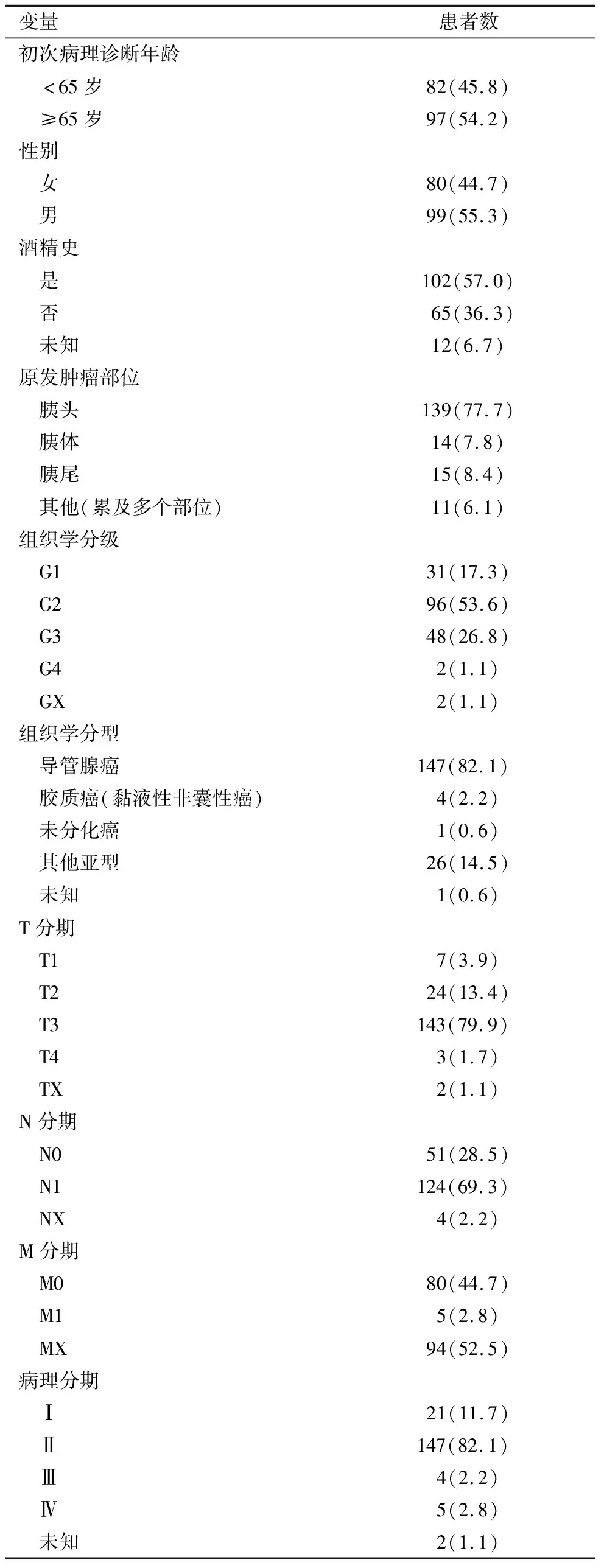
表1 179例PAAD TCGA资料的临床病理特征[n(%)]
2.2 免疫评分、基质评分与PAAD组织学分级显著相关
因为GX为未知等级,统计时将其舍去。G4只有2个样本,所以和G3期合并进行分析。根据ESTIMATE算法,免疫评分从-1 843.32到2 179.19,基质评分从-1 559.87到3 037.78(图1A、B)。G2的平均免疫评分在3组中最高,其次是G3&G4、G1(图1A,P=0.032 2)。同样,基质评分从高到低依次是G2>G3&G4>G1(图1B,P=0.015 3),表明免疫评分和基质评分在PAAD组织学分级的相关性中均有意义。为了找出总生存与免疫评分和基质评分的潜在相关性,根据免疫评分将PAAD病例分为两组:免疫评分较高的140例,免疫评分较低的有39例,筛选条件为log2FC:1,FDR:0.05;同样,根据基质评分将PAAD病例分为两组:基质评分较高的137例,基质评分较低的有42例,筛选条件为log2FC:1,FDR:0.05。Kaplan-Meier生存曲线(图1C)显示,免疫评分低分组的中位生存期比高分组长(607 dvs461 d,对数秩检验,P=0.036 9)。一致的是,与具有高基质评分的患者相比,低基质评分的患者也显示出更长的中位生存期(图1D,664 dvs421 d,对数秩检验,P=0.216 1),尽管在统计学上没有统计意义。
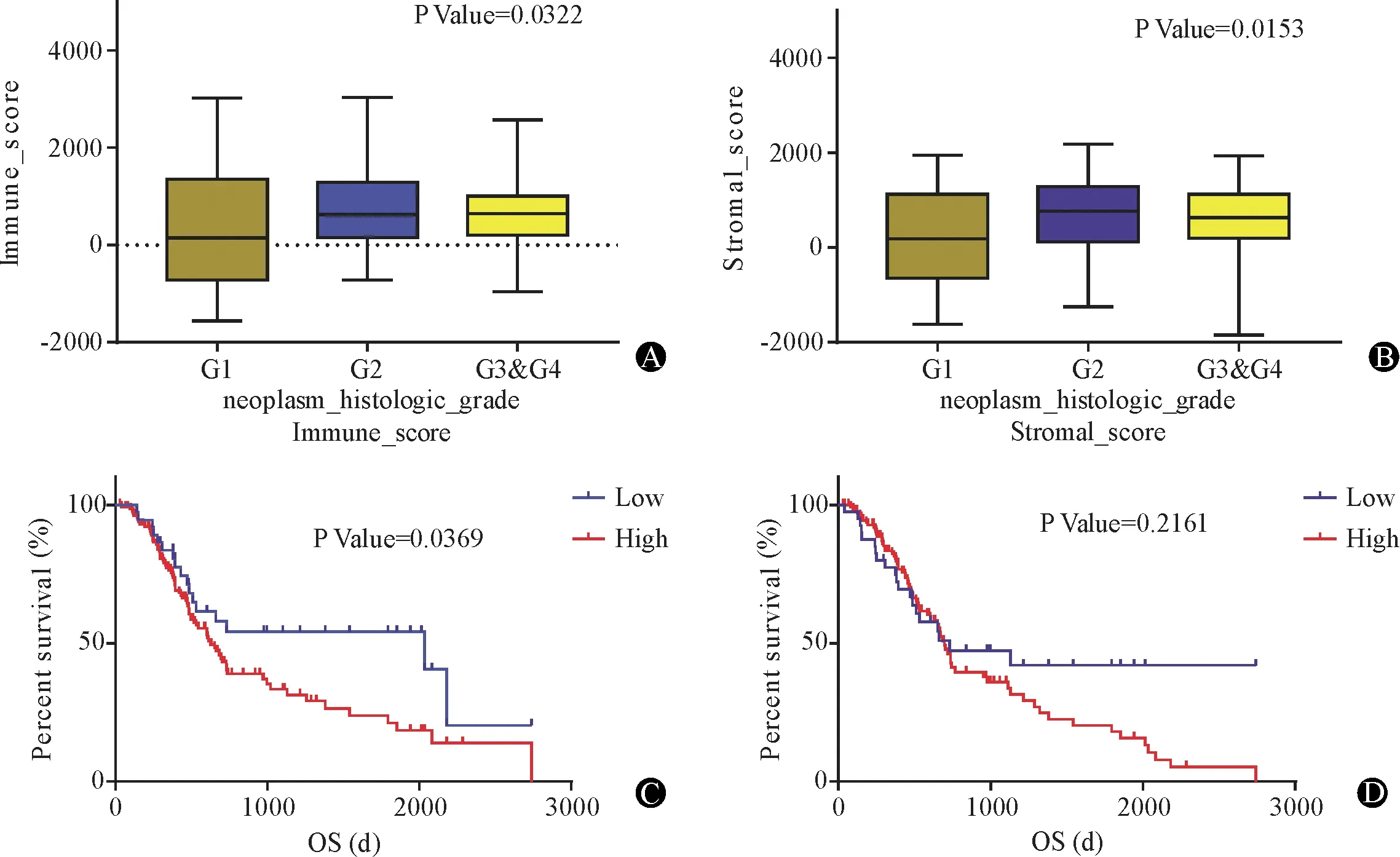
图1 免疫评分和基质评分与PAAD组织学分级及其生存率相关 A:PAAD组织学分级的免疫评分分布(n=179);B:PAAD组织学分级的基质评分分布(n=179);C:免疫评分高低的Kaplan-Meier生存曲线;D:基质评分高低组的Kaplan-Meier生存曲线
2.3 PAAD基因表达谱与免疫评分和基质评分的比较
为了探讨总体基因表达谱与免疫评分和基质评分的相关性,分析了从TCGA数据库检索到的所有PAAD病例。韦恩图(图2A、B)显示高分组中47个基因通常被上调,而低分组722个基因通常被下调。为了进一步探讨DEGs的潜在功能影响,对高免疫/基质评分组中上调的47个基因进行了的功能富集分析,确定的Top GO内容包括细胞外基质、免疫和炎症反应、趋化因子活性等(图2C-E)。

图2 PAAD基因表达谱与免疫评分和基质评分的比较 韦恩图显示在免疫和基质评分中通常上调(A)和下调(B)的DEGs 数量,筛选条件严格限制到log2FC绝对值≥1.5。基因功能富集分析(C、D、E)排名前10个GO节点
2.4 个体DEG的表达与总生存期的相关性
为了探索单个DEG在总体生存中的潜在作用,绘制了Kaplan-Meier生存曲线。在高免疫/基质评分组中上调的47个DEG中,总共31个DEG在对数秩检验中显示可显著预测较差的总体存活率(P<0.05),见表2。其中LOC389332、ZDHHC8P1、WNK4、TLE6和DDC与肿瘤关系密切,见图3。

图3 LOC389332、ZDHHC8P1、WNK4、TLE6和DDC的Kaplan-Meier生存曲线 从高(红线)和低(蓝线)基因表达组的比较中提取选定的DEG,绘制Kaplan-Meier生存曲线,N为例数

表2 高评分组中具有重要OS预测因子的差异表达基因(DEG)
3 讨论
恶性实体肿瘤组织由肿瘤细胞、肿瘤相关的正常上皮、血管细胞、免疫细胞和基质细胞组成。Yoshihara等[6]设计了一种名为ESTIMATE的算法,通过分析免疫和基质细胞的特定基因表达特征来计算免疫和基质评分以预测非肿瘤细胞的浸润,对肿瘤免疫和基质成分进行定量分析。随后该算法已被应用于多种恶性肿瘤,证实了这种基于大数据算法的有效性,并可用于预测癌症患者的生存时间。
本研究旨在从TCGA数据库中获得与PAAD预后相关的肿瘤微环境基因。首先,根据ESTIMATE算法的免疫/基质评分,发现PAAD组织学分级中G2的两个评分均较高。与高免疫评分/基质评分的患者相比,低免疫评分/基质评分组中位总生存期更长。这与先前的研究稍有不同[7],考虑原因可能是免疫评分高低组的标准不同。之前的研究免疫细胞评分是根据肿瘤中心和浸润边缘免疫细胞(CD3+和CD8+)的数量,通过组织芯片、免疫组织化学和数字分析对0~4级标本进行评分来确定,分为低、中、高三组。本研究根据从TCGA数据库获得的免疫/基质评分的正负,并将其分为高低组,可以大致预测肿瘤的组织分级,具有一定的临床意义。
随后,分析了在免疫和基质评分均上调的47个差异基因功能富集分析,发现其参与了肿瘤微环境,包括细胞外基质、免疫和炎症反应、趋化因子活性等,进一步验证了免疫调节在PAAD微环境中的重要作用,这与先前的报道一致[8-9]。细胞外基质作为重要成分,不仅充当组织的支架,而且提供指导细胞生长、存活、迁移和分化并调节免疫功能的关键生化线索,进一步调节组织发育和体内平衡,一旦失衡将会促进肿瘤进展。与肿瘤相关的细胞外基质不仅是肿瘤的基本特征,而且对其组织病理学也有一定影响。PAAD的生物学如侵袭性、免疫原性以及明显的基质增生可以阻止效应T细胞的浸润,促进免疫抑制的微环境,与肿瘤进展和不良的疾病预后有关[10]。
接下来,分析这些DEG的OS,以确定与PAAD患者预后相关的基因列表。最终确定31个DEG与PAAD患者不良预后显著相关。在这些基因中我们发现LOC389332、ZDHHC8P1、WNK4、TLE6、DDC与肿瘤关系密切。LOC389332是从人类基因组5号染色体转录而来的723 bp的基因内lncRNA,目前研究表明LOC389332是肾透明细胞癌、早期胃癌潜在的诊断与预后生物标志物[11-12]。lncRNAs表达谱作为潜在的癌症预后生物标志物在癌症的发生和转移中起着关键作用,许多lncRNAs被发现与PAAD进展与预后有关,例如LOC389641在胰腺癌组织中显著增加,触发了上皮细胞-间充质细胞转化,引起癌细胞侵袭[13]。LOC389332可能与PAAD预后有关,需进一步研究。此外,本研究中的ZDHHC8P1也属于lncRNA。有学者发现,ZDHHC8P1是影响结直肠癌总体生存的独立预后因素,在直肠癌中升高,与直肠癌进展呈正相关,且在患者中ZDHHC8P1的表达水平与miR-34a的表达水平呈负相关。从机制上讲,miR-34a被认为是ZDHHC8P1的一个重要功能靶点[14]。PAAD最重要的癌基因之一是MYC基因,由各种原因导致的MYC过表达可以导致许多致癌过程的激活,例如细胞增殖和侵袭。而miRNA可以通过靶向mRNA转录物来调节MYC基因的表达[15]。据报道,miR-34a在胰腺癌细胞和组织中表达减少,可以调节MYC的表达,进而抑制PAAD的增殖和侵袭,并可用于PAAD的预测和治疗[16]。同样,PAAD患者ZDHHC8P1表达水平与miR-34a之间的相关性值得在未来进行深入研究。
WNK是一个新型的丝氨酸/苏氨酸蛋白激酶家族,其在肿瘤发展中的作用主要是刺激肿瘤细胞增殖。WNK1、WNK2分别与结肠癌、前列腺癌及神经胶质瘤和脑膜瘤发病有关[17],WNK3与神经胶质瘤发病有关[18]。而WNK4已报道当其上调时可促进髓母细胞瘤细胞增殖和提高对顺铂治疗的耐药性,与预后不良有关[19],但在PAAD方面尚未见报道,可能是潜在的生物标志物,需进一步研究。
TLE蛋白是一种全局转录辅助抑制因子,在多种组织中参与维持干/祖细胞状态和抑制分化的机制,与肿瘤的发生发展有关。有学者分析了胰腺不同发育阶段TLE1-TLE6的差异表达,结果显示在整个发育阶段,TLE5和TLE6的表达水平都很高,而TLE1、2、3、4在胰腺发育过程中呈动态表达[20],TLE蛋白在胰腺中的异常表达可能与PAAD有关。在胶质母细胞瘤中,FOXG1和TLE1表达升高,并与较差的总生存期有关,且FOXG1和TLE1在脑肿瘤起始细胞中共表达形成复合物,导致癌细胞的持续增殖[21]。此外,来自小鼠模型的研究显示TLE6基因的过度活跃,会导致结直肠癌的进展更为迅速[22]。
多巴脱羧酶(dopa decarboxylase, DDC)又称色氨酸脱羧酶,左旋DDC催化左旋多巴脱羧生成多巴胺和5-羟色氨酸生成5-羟色胺。DDC主要在神经系统和周围组织(包括肝脏、肾脏和胰腺)中表达,但其生理作用尚不清楚[23]。DDC被认为是各类癌症的潜在新生物标记物,但在PAAD发生中的作用有待评估。有研究表明,在原发性肠癌、肝脏和脾脏转移性肿瘤中DDC的表达增加,这可能与肿瘤的发生有关[24]。另有学者指出,DDC在胃癌的腹膜转移中也有过表达,可作为胃癌腹膜转移标志物[25]。此外,一项使用高灵敏度定量实时RT-PCR方法来检测前列腺癌患者DDC mRNA水平的研究表明,与良性前列腺增生相比,前列腺癌组织DDC在mRNA水平上过表达,且DDC的高表达水平与更具侵袭性的前列腺肿瘤及不良预后有关[26]。
无可否认,本研究仍然存在一些局限性。首先,所有数据均从公共数据库中检索,因而需要外部验证我们的发现。其次,观察到的上调或下调的基因可能不是推动PAAD侵袭性生物学发展的真正原因,因此还需进一步对这些基因进行机理研究。
综上所述,本研究通过基于ESTIMAT算法的基质和免疫评分,对TCGA数据库进行功能富集分析,从PAAD微环境中提取了具有预后价值的基因,如LOC389332、ZDHHC8P1、WNK4、TLE6、DDC,这些基因的进一步研究可能是有价值的,有助于理解PAAD和微环境之间的相互作用,提供潜在的治疗靶点。

