中药肝毒性的物质基础与作用机制研究进展
李芝奇,范琦琦,陈美琳,李朝峰,王昭懿,冯 丹,钟鑫悦,郭思敏,赵崇军,林瑞超
中药肝毒性的物质基础与作用机制研究进展
李芝奇,范琦琦,陈美琳,李朝峰,王昭懿,冯 丹,钟鑫悦,郭思敏,赵崇军*,林瑞超*
北京中医药大学 中药品质评价北京市重点实验室,北京 102488
近年来,中药引起的肝损伤报道时有发生,已成为临床上药物性肝损伤的重要病因之一。大多数中药的成分复杂,其产生疗效/毒性的物质基础与对应的临床症状和毒性作用及其机制不明确。目前中药肝毒性的研究策略简单地遵循传统毒理学的基本原则,导致中药毒性被夸大或错误的解释。对中药肝毒性物质基础分类及可能的毒性机制进行综述,旨在整理中药致肝损伤危险因素的分类、机制和靶点,以进一步指导中药的安全应用。根据中药所含成分的化学结构,中药中潜在的毒性成分可分为生物碱类、糖苷类、萜类和内酯类、蒽醌类。根据中药诱导肝损伤过程中药物代谢是否被激活或肝细胞是否受到直接攻击,高危物质可分为代谢激活型、非代谢激活型和混合型。此外,从脂肪代谢,细胞色素P450(CYP450)、线粒体功能、氧化损伤、细胞凋亡、内质网应激和特异质反应等角度总结了中药诱导肝毒性的潜在机制,并提出了毒性成分所涉及的靶点,主要包括代谢酶、核受体、转运体和信号通路。通过对中药诱导肝损伤(traditional Chinese medicine-induced liver injury,TILI)危险信号的回顾和总结,讨论了中药肝毒性研究中存在的问题,以期为中药肝毒性的研究提供新的视角,有助于对中药致肝毒性的多成分、多靶点、多效应特点进行综合分析,为肝脏毒性中药的毒性研究及临床合理应用提供重要的理论支持和科学建议。
中药肝毒性;物质基础;作用机制;靶点;中药诱导肝损伤
中医药作为中华民族的传统瑰宝,在中国已经有几千年的临床实践,形成了自己独特的理论体系,在预防和治疗疾病方面有着卓越的声誉,对人类健康做出了巨大的贡献。近年来,随着中医药的产业化和国际化,中医以其独特的疗效被越来越多的人接受,在保障亚洲及其他民族和地区人民健康发挥了不可替代的作用。除此之外,中药作为膳食补充剂在欧洲和美国也越来越广泛[1],造成这种现象的原因在于人们都认为来自天然产物的中药是安全的、有效的,对于长期健康几乎没有任何的并发症[2]。然而,由中药引起的不良事件,尤其是中药诱导肝损伤(traditional Chinese medicine- induced liver injury,TILI)的事件发生率也有所上升。许多临床报告表明,中药可能导致机体不同组织器官出现损伤反应。这一切很大程度上源于人们对部分中药的药理和毒性作用认识不足或不全面。
肝脏是参与重要分子代谢、内源性和外源性化合物的解毒和排泄的主要器官,以保护身体各项机能的正常运行和免受有害物质的侵害。在该过程中,长期接触外源性生物制剂及其代谢物会导致肝脏损伤发生的概率明显增加[3]。据世界卫生组织估计,全世界约有140万人死于肝病。2012—2014年,中国308家医疗中心发生的TILI事件约占药物诱导肝损伤(drug-induced liver injury,DILI)总量的26.81%,2004—2013年美国8个转诊中心中发生TILI的比例从7%上升到20%。临床上,中药可引起机体出现急性、亚急性和慢性肝损伤。此外,TILI具有与DILI非常相似或者相同的肝损伤影像,而且TILI表现为多变的非特异性体征和症状。基于临床特征,中药可能导致肝细胞凋亡、胆汁瘀积、混合和肝血管损伤[4],同时伴随着全身无力、胃肠道症状(如腹胀、腹痛或胀满)或典型的肝炎症状。因此,临床上仅通过病史和身体检查对TILI进行早期鉴别和诊断是非常困难的。少数情况下,中药不合理使用甚至能够引起急性肝衰竭或死亡。由于其潜在的肝脏毒性,监管机构已经强制部分临床应用多年的中药退出市场或对其使用范围和规范进行了限制,这完全超出了临床前研究中的预期结果。因此,TILI作为独立DILI的危险因素,严重阻碍了中药临床应用和新药开发,而探索中药中各种成分对肝脏的综合作用一直是亟需解决的难题。一方面,中药复方作为临床常用形式,其所含复杂化学成分之间的相互作用,不同化学成分作用靶点、层次、途径不同的特点,造成研究和确认中药肝毒性物质基础和作用靶点非常困难。另一方面,在临床和日常生活中,中药不合理使用,尤其是大剂量使用中药,甚至误用假冒伪劣中药而引起的中毒事件也较多,特别是何首乌和雷公藤的肝毒性已经引起了社会对中药安全性的广泛关注[5],因此对中药致肝损伤的危险信号进行完整而系统评估是十分必要的。然而,以往大多数中药毒性相关实验和报道缺乏中医药理论的指导,中药肝脏毒性结论不准确。此外,中药的疗效和毒性一般取决于其物质基础,因此中药毒性成分的澄清是中药安全性评价的前提。同时,中药成分的复杂性决定了中药诱导毒性的作用机制展现出多样性,中药所含的不同结构物质在一定程度上可能对不同器官、组织、细胞和分子显示不同的毒性作用,涉及不同的信号通路和多个靶标,如代谢酶、核受体、转运体等信号分子都可能参与中药诱导的肝损伤[6]。基于此,本文通过收集和总结近些年的研究进展,重点讨论了中药诱导肝损伤的具体危险成分的分类、机制和靶点及挑战,以期有助于揭示中药肝损伤的危险信号,进一步完善中药安全性评估(图1)。最后,提出了肝毒性中药毒理学研究中存在的问题,并根据中医理论的指导,提出了开展肝毒性研究的新思路和新策略,旨在为中药肝毒性损伤的发生和肝毒性中药的临床合理应用提供科学依据。
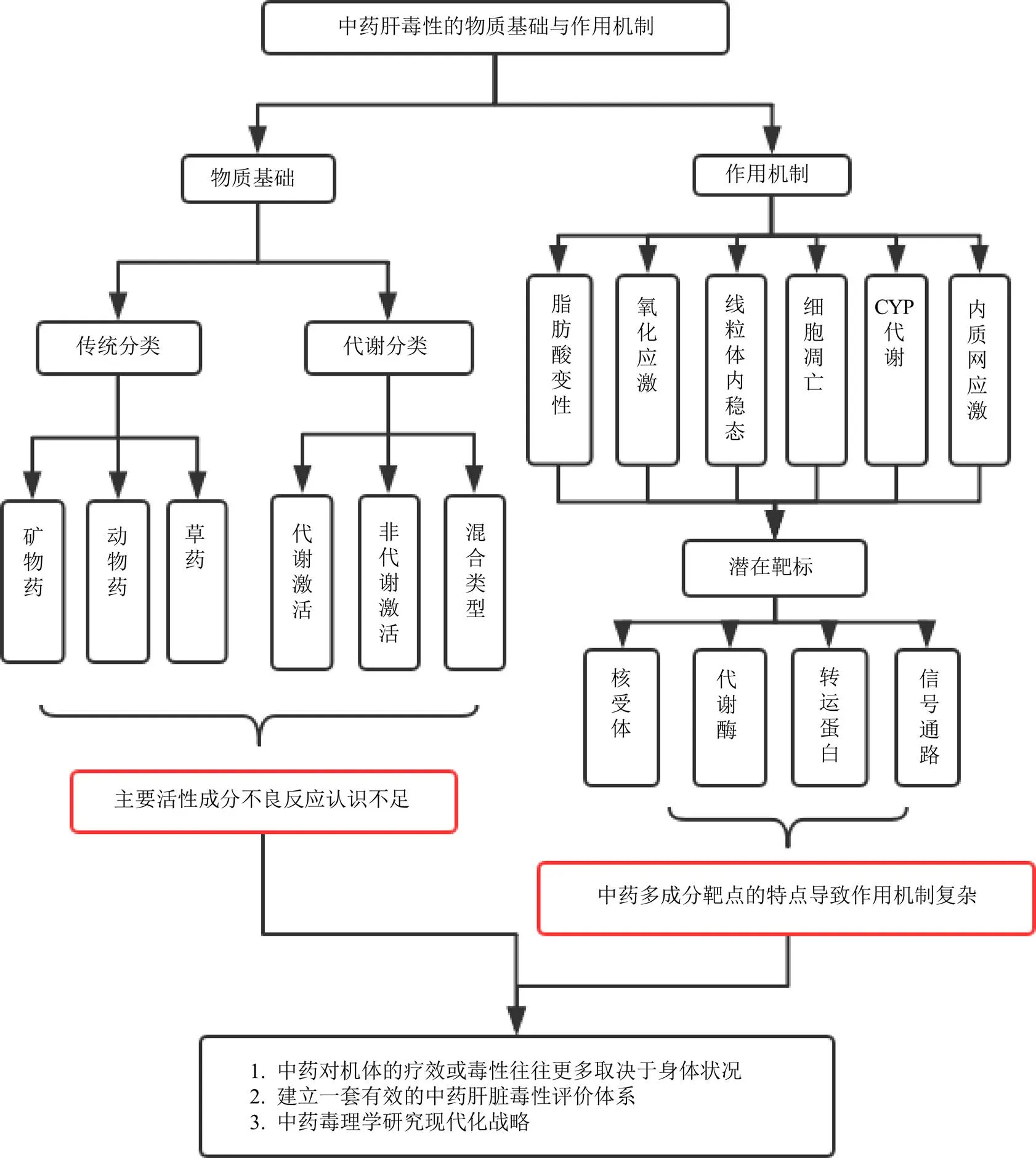
图1 中药肝毒性物质基础与作用机制
1 中药肝脏毒性的物质基础研究
毒性中药的使用是中医药的一大特色。肝毒性中药具有的药理活性或治疗作用促进了其在临床治疗中的广泛应用。中药所含的活性成分是决定中药药理和毒性作用的关键,而大多数情况下,中药所含的活性成分一直是中药肝脏毒性不良反应的主要物质基础,因此,对主要活性成分不良反应的认识不足很容易忽略其潜在的肝脏毒性。如雷公藤在治疗类风湿性关节炎和系统性红斑狼疮方面具有明确的临床效果,雷藤甲素(主要毒性物质)是大多数雷公藤属植物所含的主要活性物质,与此相似,许多毒苷类化合物(强心苷、甾体皂苷、三萜皂苷、生氰苷类)、生物碱类化合物也对肝脏功能具有显著生理影响,在临床被广泛用于治疗多种肝脏疾病。因此,明确中药的主要肝毒性物质更有利于阐明中药致肝损害的机制。此外,不合理使用中药,尤其是滥用药物很容易导致这些主要的活性化学成分在体内积累,进而对机体造成严重的不良后果。因此,这些中药具有较小的剂量和时间窗,而且长时间服用或者在不同的生理状态下极可能引起肝损伤反应。最终TILI被认为是一种导致临床应用和临床前实验失败的主要原因。同时,中药复杂化学成分对机体的多层次、多靶点和多途径的多重作用特征进一步阻碍了对TILI的系统表征和理解。因此,有必要对众多的肝毒性中药进行简单、准确的分类,既有助于全面了解中医药知识,又能促进低毒性、高效率的新型中药的研究与开发。
1.1 传统分类
中药主要包括3大类:草药、动物药和矿物。中药含有多种有毒有效成分。根据化学结构的不同,TILI的毒性物质基础一般包括生物碱、苷类、二萜类和内酯类、蒽醌类、植物毒蛋白和重金属。动物药作为中药中特殊的一部分,有毒蛋白和糖苷是它们的主要有毒成分。矿物药中的主要毒性成分为重金属,如砷、汞、铅等。这一分类主要是基于中药毒性的物质基础,可以帮助研究其潜在的肝脏毒性和毒性机制。由于中药中植物药占很大比例,因此,本文主要讨论植物药中所含主要化学毒性物质基础和潜在的毒性机制。
中药所含的化学成分比较复杂,TILI的毒性成分往往是其有效成分。如从大黄、决明子等药用植物中分离得到的蒽醌类化合物[7-8],从雷公藤中分离出来的雷公藤甲素在临床前和临床治疗疾病治疗中均表现极强的药效或者治疗作用,同时对机体也表现出一定的肝损伤作用[9-10]。中药所含的化合物种类结构与临床TILI的发生密切相关,生物碱和糖苷类化合物引起的肝损伤发生率明显高于其他成分引起的肝损伤发生率。许多中药生物碱对肝脏有明显的毒性作用,如雷公藤中的雷公藤碱、千里光和款冬花中的吡咯里西定生物碱都是常见的肝毒性成分之一[11],而且生物碱对肝脏的毒性可能因其性质的不同而不同[12],最常见的特征有肝充血和坏死。糖苷类成分主要包括强心苷、皂苷和黄酮类糖苷。长期使用从牛蒡子中提取的总皂苷会引起明显的肝损伤[13]。苦参中的黄酮苷类化合物可刺激胃肠道,引起肝脏损伤,从而引起恶心、呕吐、黄疸和其他症状[14]。中药中的二萜化合物主要以树脂、内酯或糖苷的形式存在。雷公藤和牛蒡子中所含的二萜类化合物对肝脏具有较强的急性毒性和损伤作用[15-16]。近些年研究报道发现蒽醌类化合物是何首乌中主要的肝毒性成分[17]。此外,某些中药中的植物毒性蛋白也会导致肝损伤,如苍耳子对肝脏和肾脏的损害与苍耳子中所含的毒性蛋白物质有关,蓖麻精中的蓖麻毒素和相思子中的相思豆毒蛋白可以阻断蛋白质或DNA的合成导致肝细胞坏死。
1.2 代谢分类
大多数中药中的具有肝毒性的化学成分通过肝脏代谢过程会发生变化,而化合物的原型成分及其代谢成分都可能是TILI的危险因素。根据代谢活化过程是否参与了中药诱导的肝损伤,研究者尝试将肝毒性物质分为代谢激活、非代谢激活和混合类型。代谢激活指的是不活跃中药成分通过肝脏代谢酶进行转化后生成了反应性代谢中间体,细胞中的生物大分子如蛋白质或核酸与其产生共价反应,药物代谢酶被这些中间体共价修饰引起不可逆的抑制,产生严重的药物-药物相互作用或抗原-抗体反应,进而诱导肝毒性。该过程均是由细胞色素P450(CYP450)酶系统介导的。在正常情况下,中草药黄药子中的黄独素B不具有毒性,但是在细胞色素CYP3A酶的催化作用下,黄独素B结构中由呋喃环代谢生成的活性中间体(开环顺烯二醛)与半胱氨酸、乙酰半胱氨酸、谷胱甘肽(glutathione,GSH)生成相应的代谢产物而引起肝损伤,见图2[18]。大黄素通过代谢活化形成的活泼环氧化亲电反应性代谢物能与胞内GSH共价结合成大黄素-GSH加成物,进而影响肝脏的正常功能[19]。与此相似,川楝子中的川楝子素[20]、黄樟醚中的亚甲氧基苯基和烯丙基苯的亚结构[21]经过CYP450代谢后形成活性中间体,并与GSH形成加成物,进而引发肝毒性。毒性临床实践表明,何首乌水提液对基因多态性人群的CYP1A2或CYP2E1活性有抑制作用[22]。与此相反,非代谢激活的TILI主要是由于其原型成分直接攻击肝细胞,对不同靶点(细胞器、酶等)的直接损伤作用,该过程不依赖CYPs代谢过程。雷公藤甲素可直接攻击人肝L02细胞线粒体,通过靶向线粒体动力相关蛋白(dynamin-related protein 1,Drp1)介导的线粒体功能障碍和线粒体分裂相关的线粒体自噬,从而引起能量代谢障碍[23]。Drp1在千里光碱诱导线粒体介导的原发性肝细胞凋亡中也发挥重要作用[24]。这些肝毒性危险因素影响肝脏中药物代谢酶的表达水平,从而引起肝毒性积聚。一些中药成分可以也直接作用于药物转运体。从肝脏分泌到胆汁的黄药子通过抑制肝脏转运多药耐药相关蛋白2(multidrug resistance protein 2,MRP2)表达水平而导致肝脏损伤[25]。中药中的某些危险成分也可通过免疫介导诱导引起肝损伤。刀豆蛋白A可诱导免疫介导的肝损伤[26],该过程主要是通过抑制免疫系统和调节自噬来产生的[27-28]。
中药化学成分复杂,TILI的发生往往涉及多种成分之间及成分与机体之间的多种毒性途径。在大多数情况下,肝毒性中药中同时含有代谢和非代谢激活的结构物质,这种混合型中药的肝毒性显著增强。一方面,TILI的危险成分可能直接攻击没有CYPs代谢的靶点。例如,在雷公藤诱导的肝损伤过程中,脂质过氧化、免疫损伤、肝细胞凋亡和P450代谢异常都得到了证实[29-30]。另一方面,中药中的化学成分可能与各种酶系统相互作用,如CYP450酶和葡萄糖醛酸转移酶,进而引起肝脏损伤[31]。实验结果显示何首乌提取物对多种代谢酶均有抑制作用,包括CYP3A4、CYP2C19、CYP2E1和UGT1A1[32]。重楼皂苷可降低大鼠、和葡萄糖醛酸转移酶(uridine diphosphoglucuronosyl transferases,)mRNA水平[33]。
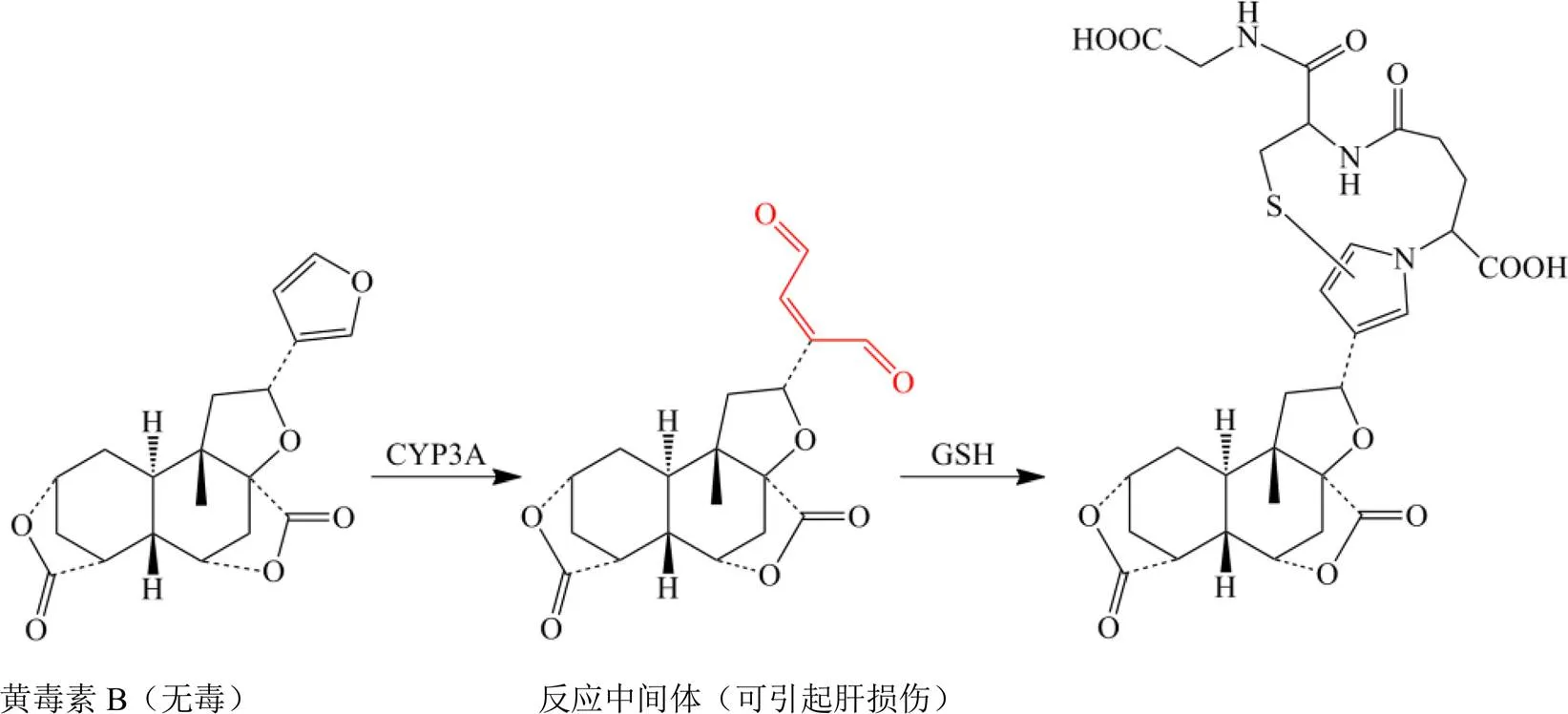
图2 黄药子中黄毒素B的肝毒性机制
2 中药诱导肝脏毒性及其潜在作用机制
DILI是药物不良反应的一个分支,是临床治疗或临床前测试期间药物直接或间接对肝脏组织的不良反应,如脂肪肝、肝纤维化、肝硬化、肝炎、肝坏死和急性肝衰竭等。DILI/TILI在临床上往往缺乏特殊的诊断症状,为TILI潜在毒性机制的研究及临床治疗带来极大困难。众所周知,TILI的发生与中药所含的原型物质及其代谢产物对肝细胞或个体遗传因子的毒性有关。截止到目前,机体内中药所含的各风险成分和肝组织之间存在的复杂的相互作用机制还没有得到充分的研究。近些年的研究报道发现脂肪酸变性、线粒体能量供应障碍、氧化应激、炎症、内质网应激和细胞吞噬等可能在TILI中发挥重要作用。
2.1 脂肪酸变性
越来越多研究表明,肝脏脂肪变性是TILI的主要原因,脂肪肝也是中药肝毒性引起的最常见的临床症状之一。正常脂肪酸代谢是防止肝脏氧化和向机体提供三磷酸腺苷(adenosine triphosphate,ATP)的重要保证[34-35]。然而,大量摄入大黄会引发脂肪酸代谢紊乱,从而引起肝损伤。研究人员根据实验推测,一是大黄可能阻碍了脂肪酸代谢过程中羟基脂肪酸向醛类脂肪酸的转化,导致脂肪酸在体内氧化紊乱和积累;另一方面,酰基肉碱是组织中不可缺少的辅酶,是脂肪酸代谢所必需的物质,它能够激活长链脂肪酸运输到线粒体中,促进脂肪酸氧化。但实验数据显示,大黄素能够促进人肝细胞HL-7702血清中乙酰肉碱水平显著升高,进而能够解释大黄素的肝毒性可能涉及到脂肪酸代谢紊乱[36]。
学生在学习过程中,对知识的掌握和理解不够灵活,只会按照教师讲解的内容去实验,或者按照课本上的介绍去完成项目的要求。由于实际参与的项目有限,思路不够灵活,眼界不够开阔,远远达不到实际项目对人才需求的标准[2]。同时,在传统教学过程当中,以教授知识和技能为主,学生追求高分数,而忽视了灵活应用知识的能力,创新意识淡薄,不注重发挥学生的创新意识。
2.2 氧化应激
氧化应激是指机体氧化和抗氧化能力失衡,从而导致氧化、中性粒细胞的炎症性浸润、蛋白酶的分泌增加、大量氧化中间体的产生。体内自由基氧化损伤已成为中药肝毒性的重要因素。雷公藤甲素能够诱导HepG2细胞中活性氧(reactive oxygen species,ROS)生成,抑制抗氧化剂GSH,进而证实氧化应激损伤的发生[37]。柴胡总皂苷可诱导肝脏中氧化应激反应相关的丙二醛(malondialdehyde,MDA)含量增加,降低谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,而柴胡皂苷a可降低L02细胞超氧化物歧化酶(superoxide dismutase,SOD)活性、上调MDA以及乳酸脱氢酶含量、破坏细胞膜等过程[38]。吡咯里西啶类生物碱(pyrrolizidine alkaloid,PAs)可引起谷胱甘肽S转移酶A1(recombinant glutathione stransferase alpha 1,GSTA1)和谷胱甘肽过氧化物酶1(recombinant glutathione peroxidase,GPX1)的改变,这表明PAs的肝毒性与谷胱甘肽代谢中毒性的干扰有关[39]。从麻黄中提取的麻黄碱诱导人肝星状细胞氧化应激介导的线粒体自噬[40]。此外,氧化应激引起的肝细胞坏死可能是杜鹃花水提物主要的肝脏毒性终点[41]。
2.3 线粒体内稳态
肝细胞内丰富的线粒体是细胞分化、细胞生长和周期、信号传递和凋亡的重要细胞器。线粒体稳态在细胞能量代谢中起着重要作用。线粒体作为能量供应的主要来源,对维持肝细胞脂肪代谢和内稳态具有重要作用,同时也是某些肝毒性药物的重要毒性靶点[42]。大多数情况下,药物诱导线粒体功能紊乱的研究主要是报道了药物对不同线粒体参数的急性效果,比如膜电位和渗透性、氧气消耗、呼吸链中不同复合体以及脂肪酸氧化通量的影响等[43-44]。中药诱导线粒体损伤的机制主要表现在2个方面:结构损伤和功能紊乱。如大黄中的蒽醌能够引起细胞周期阻滞、线粒体膜电位去极化和线粒体呼吸链复合体抑制功能,进而损害线粒体功能,最终导致肝毒性[45]。芦荟大黄素通过阻断HL-7702细胞有丝分裂诱导细胞凋亡,使线粒体膜电位去极化,导致线粒体功能障碍[46]。与此同时,HL-7702细胞的活性呈剂量和时间相关性下降。进一步研究表明芦荟-大黄素触发了线粒体介导的ROS生成,也导致了Fas水平的升高。这使得聚(ADP-核糖)聚合酶(poly ADP-ribose polymerase,PARP)裂解,导致肝细胞凋亡和肝损伤[47]。大黄素主要能够阻碍细胞内ATP的合成,尤其是线粒体呼吸链,进而通过氧化磷酸化途径损害线粒体功能[48-49]。此外,大黄素能够导致一定程度的肝细胞线粒体功能障碍,ROS水平升高,线粒体膜电位(mitochondrial membrane potential,MMP)降低,引起肝脏损伤[50-51]。乌梅子水提液中含有的埃莫二胺、金针松和埃莫定能够诱导线粒体肿胀、线粒体通透性转变开放,线粒体电位显著降低[52]。如前所述,Drp1介导的线粒体碎裂是千里光碱[53]和雷公藤甲素致肝损伤的一种新机制。雷公藤甲素通过抑制线粒体呼吸链来诱导肝脏损伤,也可能涉及Drp1相关的线粒体功能障碍和线粒体自噬[54]。线粒体自噬涉及到有选择性地将受损的或者死亡的线粒体隔离[55],因此,它在线粒体质量调节以及量化控制中发挥着重要作用[56]。线粒体自噬是一个多步、进化、保守的过程,它是由多个基因调节的线粒体分裂[57]。
2.4 细胞凋亡
细胞凋亡有3种主要途径,包括线粒体凋亡途径、内质网途径和死亡受体途径。越来越多的中药安全性研究表明,细胞过度凋亡可能是肝损伤的重要机制。柴胡中的柴胡皂苷A能够通过线粒体途径诱导肝星状细胞凋亡[58],同样的成分也可能涉及多种细胞凋亡机制。比如肝细胞中Fas死亡受体通路的激活也参与了柴胡皂苷D诱导的肝毒性[59]。与此相似的是,重楼中的重楼皂苷VI也是通过ROS介导的线粒体凋亡途径和Fas死亡依赖途径诱导肝细胞凋亡[60]。甘遂中提取的巨大戟醇可通过调节肝细胞线粒体凋亡途径引起细胞毒性[61]。PAs类化合物,如从紫菀中分离的山冈橐吾碱和从千里光中分离的千里光碱,可诱导小鼠肝细胞Caspase-3的激活和Bcl-xL蛋白(apoptosis regulator Bcl-x,Bcl-xL)的减少,从而导致线粒体介导的细胞凋亡[62-63]。一定浓度的何首乌醋酸乙酯和二氯甲烷提取物能够显著影响HepG2细胞数量、核区域、线粒体质量、线粒体膜电位,进而说明何首乌的肝毒性可能与线粒体介导的细胞凋亡有关[64-65]。
2.5 CYPs代谢
药物诱导的特异型肝损伤一般与药物代谢酶的免疫异常和遗传多态性有关,分别定义为免疫特异性肝损伤和代谢特异性肝损伤。药物或活性代谢物与内源性蛋白共价结合形成抗原免疫复合物,当发生急性炎症刺激或肝细胞被破坏时,自身免疫系统识别抗原免疫复合物并最终导致免疫特异性肝损伤。因此,免疫介导的肝损伤可视为一种免疫反应。无论是天然化学品还是合成化学品都是人体的外来产物,需要代谢降解过程才能消除。肝脏是药物代谢的重要器官,因此往往是大多数毒性中药的首要靶器官。代谢特异性肝损害主要是由于基因变异导致代谢酶活性的丧失或降低,进而药物和代谢产物在体内积累。CYPs是由基因调控的一系列酶,大多数都参与中药成分的代谢活化,CYP450酶与中药诱导肝毒性的关系已被逐渐揭示。目前,特发性肝损伤相关研究主要集中于何首乌肝毒性[66-68]。计算系统毒理学分析预测分析发现通过CYP450、精氨酸和脯氨酸代谢、色氨酸代谢、视黄醇代谢、亚油酸代谢对外援物质的代谢对人肝细胞代谢有类似作用,也可引起肝毒性。何首乌可诱发能量代谢、氨基酸代谢和脂质代谢紊乱。所有这些代谢紊乱最终会导致肝细胞死亡[69]。突变可能降低了药物代谢酶活性,抑制了何首乌的代谢,最终导致急性肝损伤[22]。通过抑制P450酶5个亚型的表达,可以降低何首乌的酶活性,导致肝毒性成分在肝脏内的积累,进而对肝脏组织造成不同程度的损伤[22]。何首乌水提液致肝毒性的临床研究已检测出CYP1A2或CYP2E1在遗传多态性人群中的低活性[70]。何首乌醋酸乙酯提取物中主要含有微量的蒽醌苷(大黄素-8--葡萄糖苷)和二苯乙烯类化合物;氯仿提取物中主要含有蒽醌类(大黄素- 8--葡萄糖苷和大黄素);残留提取物中既不含蒽醌类也不含二苯乙烯类化合物。醋酸乙酯提取物可能在何首乌特异型肝毒性的发病机制中起主要作用,而不是氯仿或残留提取物。另外,雷公藤多酚对大鼠肝微粒体中的CYPs,包括CYP450亚型3A、2C9、2C19和2E1具有显著的抑制作用[71]。在P450酶敲除小鼠中,雷公藤甲素的清除率明显降低,而在肝脏中的分布明显增加,提示雷公藤的肝毒性与P450酶代谢能力下降有关。此外,黄樟素具有抑制CYP1A2的作用[72]。在肝毒性诱导过程中,由薯蓣代谢活化产生的亲电中间体是由CYP450介导的[73]。在CYP3A4高表达的HepG2或L02细胞中,黄毒素B可诱导比野生型细胞更强的肝毒性[74]。此外,药物引起的特异型肝损伤被认为与炎症应激有关。如炎症应激增强了大黄素诱导的肝损伤,这与特异的DILI有关[75]。
2.6 内质网应激
内质网(endoplasmic reticulum,ER)是蛋白质合成、折叠和运输的细胞器,内质网稳态在肝细胞(ER含量丰富的主要细胞类型)中至关重要[76]。不同病理状态下扰动这些过程能够引起ER应激,该过程往往伴随着展开蛋白质标志物响应的诱导表达,包括内切核糖核酸酶肌醇需要酶1(Inositol- requiring enzyme 1,IRE1)、激活内质网膜蛋白激酶(PRK-like ER kinase,PERK)、活化转录因子6(activating transcription factor 6,ATF6)、葡萄糖调节蛋白78(lucose-regulated protein 78,GRP78/Bip)以及C/EBP同源性蛋白(C/EBP homology protein,CHOP)[77]。当急性或慢性肝病过程中出现持续或未解决的内质网应激时,可能导致肝细胞功能障碍和死亡[78]。蛇床子中提取的香豆素类化合物蛇床子素能够抑制L02细胞增殖,增强内质网应激相关蛋白 [GRP78/Bip、CHOP、Caspase-4、肌醇必需酶1α(inositol-requiring enzyme 1α,IRE1α)、PERK、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、磷酸化JNK(p-JNK)、转录激活子4(transcriptional activator 4,ATF4)] 的表达水平,进而引起细胞出现明显的凋亡过程[79]。从苦参或山豆根提取的氧化苦参碱能够增强体外L02细胞中内质网应激标志物(GRP78/Bip、CHOP、Caspase-4)蛋白以及其相应mRNA的表达水平,同时它还能够增强内质网传感因子(IREI、ATF6、PERK)的表达。此外,使用内质网抑制剂能够减缓氧化苦参碱对细胞的毒性作用[80]。补骨脂中的一种黄酮类化合物补骨脂二氢黄酮可通过激活HepG2细胞的ROS-线粒体融合素基因2(mitofusin 2,Mfn2)-蛋白激酶B(protein kinase B,Akt)通路诱导细胞凋亡,该通路与内质网应激有关[81]。另外本课题组发现重楼粗提物能够影响斑马鱼成鱼和SD大鼠肝脏中内质网应激相关蛋白的表达,意味着其肝毒性与内质网应激过程相关[82]。
2.7 其他
鉴于中药具有多成分、多靶点、多途径的特点,除了上述的肝毒性机制外,还应该关注TILI的其他相应毒性机制。如给药时间和给药次数能够影响其代谢和血药浓度,从而导致药物积累和药物引起的肝脏损伤[83]。此外,性别[84]、不同人群的生理状态,尤其是老年人或肝脏功能不全的患者,都是在TILI研究中必须考虑的影响因素。
3 药物潜在的靶标
肝脏是人体最重要的药物代谢器官。中药的肝脏代谢过程可以激活胆红素、胆固醇、胆汁等肝脏代谢途径。因此,这些代谢途径涉及到的核受体、代谢酶、转运体和信号分子就成为了TILI的重要靶点。这些靶点的揭示将对中药肝毒性的理解和控制起到重要作用。
3.1 核受体
3.2 代谢酶
随着药物代谢新方法和新技术的出现,中药代谢与代谢酶之间的关系逐渐被揭示。CYP450功能研究能够预测中药对肝脏的毒性和功效作用[93]。抑制CYP450酶被证明是DILI的早期指标。吴茱萸次碱被CYP450转化为高活性的代谢物,共价结合到酶本身的催化位点,从而导致基于机制的抑制[94]。此外,如前所述的黄毒素B在高表达CYP3A4的HepG2细胞中诱导的细胞毒性可能涉及到CYP3A4的活化。何首乌诱导的肝毒性可能与抑制CYP1A2或CYP2E1的活性相关。雷公藤多苷诱导的肝损伤与CYP450亚型3A、2C9、2C19和2E1蛋白水平降低有关等。
3.3 转运蛋白
药物转运体是药动学的关键元素,它在药物的吸收、分布、代谢、排泄和药物相互作用等方面起着重要作用。药物转运体根据转运方向不同可分为2类:摄入转运蛋白(有机阴离子转运体多肽,有机阳离子转运体和寡肽转运体)和外排转运蛋白[乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)、肺阻力蛋白质(单体)和P-糖蛋白]。摄入转运体主要是负责传输基质进入细胞,在细胞内底物浓度增加。外排转运蛋白主要依赖ATP的释放,泵出基质细胞,减少细胞内基质的浓度。此外,在人类肝脏中存在代谢酶和转运体之间的协同调节。如CYP450家族(CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4)和转运;OAT-c、多药耐药相关蛋白2(multidrug resistance-associated protein,MRP2)、MRP3和肿瘤多药耐药性1(multidrug resistance 1,MDR1)的广泛联系涉及到病人肝脏的药物代谢[95]。何首乌诱导肝毒性的主要原因可能在于其能显著抑制大鼠有机阴离子转运肽1A1(organic anion transport peptide 1A1,OATP1A1)、有机阴离子转运肽1B2(organic anion transport peptide 1B2,OATP1B2)、MRP2[96]。雷公藤甲素通过增加肝脏内摄入转运蛋白OATPs和外排转运蛋白P-糖蛋白和MRP2的表达来诱导肝毒性[97]。
3.4 信号通路
信号通路包括一系列跨细胞膜向细胞传递细胞外分子信号的酶反应通路,可能涉及多种信号分子,包括激素、生长因子、细胞因子、神经递质、核转录因子、蛋白激酶等小分子化合物。其中,蛋白激酶和转录因子参与了中药致肝损伤的拮抗或促进作用。核因子红细胞2相关因子2(nuclear factor E2-related factor 2,Nrf2)调节细胞氧化应激,是维持细胞内氧化还原稳态的中心调控因子。Nrf2信号的激活可以保护机体免受雷公藤红素诱导的肝毒性[98]。Nrf2还有助于保护野百合诱导的大鼠肝损伤[99]。川楝素诱导小鼠和人正常肝L02细胞的肝毒性也可以通过Nrf2激活来减轻。核因子κB(nuclear factor kappa-B,NF-κB)调节许多基因的表达对细胞凋亡、炎症和各种自身免疫性疾病的调节至关重要[100]。黄芩素通过缓解NF-κB介导的肝脏炎症来达到防止黄毒素B诱导肝损伤[101]。槲皮素通过NF-κB途径来恢复Th17/Treg平衡。进而缓解雷公藤甲素诱导的肝脏损伤[102]。蛋白激酶催化蛋白质的磷酸化,是神经信号在细胞内传递的终点。氧化苦参碱诱导的小鼠肝毒性可能与JNK信号通路激活有关[103]。
4 中药肝毒性研究的新思路
中医药临床使用是在中医药理论的基础上,根据病人的临床症候进行使用的。中药成分的复杂性、中药不同结构成分之间的相互作用以及不同化学成分与机体靶器官的相互作用造成了中药多靶点、多途径、多效应、多层次的作用特点。基于此,笔者提出了未来中药肝毒性评价的一些观点。
4.1 中药对机体的疗效或毒性与身体状况
2000多年前,中医学经典《素问·六元正纪大论》提出了“有故无殒,亦无陨”的说法,强调的就是中药的使用要针对病因治疗,使用合理情况下,即使用峻(毒药)治疗亦不致机体产生明显的副作用。但当发生严重不良事件或死亡时,相应的中药配伍使用就不应该是“有故”,而应当属于临床使用禁忌症了。该理论首先特别表明,在特定的病理状态下,中药的合理使用在临床上对于肝脏疾病具有极强的治疗和保护作用。甘草的主要成分甘草酸被广泛的用来治疗肝脏疾病,如乙型肝炎、慢性肝炎、胆汁瘀积、肝纤维化等[104]。动物实验表明甘草酸对于蛋氨酸和胆碱缺乏饲料引起的非脂肪性肝炎具有极强的保护效果[105]。然而,甘草中主要活性物质2-羟基查耳酮能够增加脂质超载肝细胞中的氧气消耗,ATP产生、线粒体膜电位、整体和线粒体活性氧的产生、炎症因子和Caspase-9的产生,减少SOD1的表达,表明2-羟基查耳酮在一定浓度下能够引起肝细胞损伤,它的毒性可能与ROS产生过量和SOD1产生不足有关,进而能够引起凋亡、炎症和细胞功能失常。然而,该化合物对正常细胞的毒性作用确实非常有限[106]。同样,使用毒性中药是中医药理论的特色,即使是有毒的中药也可以用来治疗某些疾病,甚至包括肝损伤。此外,现代中医已经表明,毒性和功效的物质基础往往是肝毒性中药的相同组成部分。机体生理状态、物物理状态和剂量在生物体内产生功效和毒性转化的主要因素,而且这2种不同的作用方式之间在一定程度上可以通过一种非线性的方式进行转换[107-108]。
因此,在临床实践和临床前研究中进行中药肝毒性安全性评价研究中应重视机体的整体性、证候和疗效/毒性的统一等,开发和应用一种人类适用于人类疾病研究的动物模型,发现内在易感性、生物微环境以及健康和病变模型中毒性作用模式的差异,以便更好地解释“生理状态-功效/毒性综合征”。此外,需要额外的研究聚焦于中药诱导有效性和毒性之间转化的潜在机制,探讨适用于这些中药的确切的临床综合征或物理/病理条件,以保证服用这些中药的时候不会产生肝毒性。
4.2 基于中药品质评价体系的中药安全性评价
中药是在中医理论指导下预防、诊断和治疗疾病的一类物质。因此,不能脱离中医整体观和辨证论治的概念,单独对中药肝脏毒性进行安全性评价。遗憾的是,人们对中药的研究越来越多地忽略了中药的传统特性,而仅仅考虑到现代毒理学方法。这些方法最大的优势在于它能够指出外源性药物的潜在毒性作用[109],但是这些研究结果容易夸大甚至错误地认识中药的毒性,不利于临床药物对特定疾病的治疗。此外,中医药理论中提到的毒性往往被认为是药物的自然属性之一,在某些情况下也可以转化为疗效。综上所述,在中医药理论指导下建立一套有效的中药肝脏毒性评价体系是亟待解决的科学问题之一。
近期,本课题组更倾向基于物质基础来建立一个“综合征-物质基础-毒性-有效性”的中药品质评价体系来探讨中药潜在肝毒性,以特定药物进行安全性评价。首先应该首先确定其适应症和主要物质基础。然后选择一种合理的肝脏病或其他疾病的动物模型进行毒性/药理学研究,描述这种物质基础在机体不同生理状态下可能的分子毒性、活性机制及其“结构-剂量-时间-功效-毒理”相关性。此外,还可以描述该药物与其他中药配伍使用或者加工炮制对已建立的“结构-剂量-时间-毒理-功效”关系的变化以及功效-毒性变化的规律。这些研究的所有数据都有助于针对不同病例中可能出现的不良反应进行综合分析、标准化剂量和临床合理用药。总之,在充分考虑综合中医理论(病症结合、配伍禁忌和炮制减毒等)的基础上,利用这种基于中药整体品质评价体系的中药安全性评价系统就能够实现在不同条件下建立和使用合理的评价模型。
4.3 肝毒性中药毒理学研究现代化策略
传统的中药毒理学研究主要集中在化学成分、药物/毒性作用和可能的机制等方面,而很少关功效、剂量和时间、构效关系之间可能存在的关系以及对临界点的探索。为了检测中药可能的肝脏毒性,常规研究中的给药剂量往往比短期内实际给药剂量要大得多,以便能够提供更多的机体响应信息,这种方式能够避免由于长期低剂量给药而造成的机体耐受度增强的现象出现,但是其往往会导致临床前肝毒性评价不准确。事实上,大部分有毒中药在极低的剂量下就能够诱导肝脏毒性,而不出现明显的急性器官损伤。因此,这些研究的结果往往不能监测早期适应/不良反应和物质基础诱导的生物分子层次变化,而这些对于一个完整的真实的毒性机制评价是非常重要的。因此,不难发现传统的中药毒性研究在毒性鉴定方面确实取得了良好的效果,但在早期毒性预测、分子毒理学研究以及“剂量-时间-毒理-功效”关系的发展等方面存在明显不足。
近年来,21世纪毒性检测策略为研究中药的有效性和毒性提供了一个新的视角,这种策略基于特定的毒性通路,重点关注量化的量效关系、量效评估和临界点的计算,通过在低水平接触或在人体接触水平的靶测试,进而倡导相关不良结果途径的发展。此外,在新一代风险评估(next generation risk assessment,NGRA)的暴露框架中,采用分层方法来描述药物/毒物诱导的细胞反应途径,有助于理解适应症/不良反应临界点的相关性。因此,基于这种新的毒性试验策略的中药毒性研究,不仅有助于系统和精确地阐述相关的分子毒性机制,而且还将提高这些毒性中药潜在的肝脏毒性识别和科学的临床应用。
5 结语
几千年来,中医药与疾病预防、治疗或健康维护等生活方面的联系日益加强,中医药学者通过长期对医学实践中收集和总结的中医临床用药经验进行总结,进而形成了科学和有效的中医药理论体系。然而,某些中药的滥用和误用常引起肝损伤。近些年,TILI是毒性中药引起的主要不良反应之一。TILI发生率的增加引起了全世界越来越多的关注,阻碍了中医药的现代化和国际化。但是中药安全性评价的数据严重缺乏,中医药安全性评价的重要性日益突出,中药毒性风险评估也逐步成为中药研究中一个重要而有趣的领域。中药多成分、多靶点、多途径、多层次的特点以及TILI具体诊断指标缺乏造成TILI的评价十分困难。近年来,随着对中药安全性评价需求的不断增加,越来越多的研究者开始过度使用现代毒理学方法进行中药肝毒性研究,该方法确实产生了大量的毒性数据。这些数据往往与传统药物的临床使用理论出现悖论或矛盾结论。造成这种现象的主要原因在于:中药的肝毒性不是单一因素引起的,而是多种相互作用机制共同作用的结果。中药在临床应用中往往是复方或者多味药组合使用,来自复杂药物成分之间以及药物与机体之间的相互作用不可预测。中药临床可通过药物加工、合理配伍、正确煎煮、对症用药等多种方法有效降低中药诱导的肝毒性。选择高质量的药材对于改善重金属残留或环境污染引起的药物质量问题,避免导致无效或肝毒性是十分必要的。阐明上述机制有助于了解中药致肝损伤的细胞内过程,从而进一步降低和控制肝毒性。然而,即便现在大量研究学者针对中药的毒性成分和可能涉及的毒性机制进行了大量的筛选和评价研究,但是迄今仍缺乏系统的审查和分阶段的总结。
因此,在未来应选用合适的统一的评价模型、利用合理的评价技术与方法、基于大数据分析的统计分析甚至预测的方法,构建不同中药/不同结构类化合物的构-毒关系,阐释相似结构化合物的靶点和作用机制,搭建中药肝毒性成分筛选和评价的应用平台,形成完整而系统的肝毒性评价体系是发展的必然趋势,对澄清中药中的肝毒性成分对降低和控制其毒性有相当大的益处,基于此,本文在系统反思了前人中药毒性研究中存在的问题后,强调基于中药物质基础进行中药安全性评价的重要性,提出了一个中药品质评价体系。综合考虑上述问题,将毒性物质基础、毒性/活性及其机制联合起来对中药的安全性进行系统评价,旨在提供这些中药清晰的毒性特征,为建立和完善中药致肝损害评价体系奠定基础,为TILI提供防控策略。
利益冲突 所有作者均声明不存在利益冲突
[1] de Boer Y S, Sherker A H. Herbal and dietary supplement-induced liver injury [J]., 2017, 21(1): 135-149.
[2] Ekor M. The growing use of herbal medicines: Issues relating to adverse reactions and challenges in monitoring safety [J]., 2014, 4: 177.
[3] Byeon J H, Kil J H, Ahn Y C,. Systematic review of published data on herb induced liver injury [J]., 2019, 233: 190-196.
[4] Shen T, Liu Y X, Shang J,. Incidence and etiology of drug-induced liver injury in mainland China [J]., 2019, 156(8): 2230-2241.e11.
[5] Li H L, Wang X B, Liu Y,. Hepatoprotection and hepatotoxicity of Heshouwu, a Chinese medicinal herb: Context of the paradoxical effect [J]., 2017, 108(Pt B): 407-418.
[6] 宋培放, 潘秋莎, 杨凌. 药物性肝损伤生物标志物[J].世界中医药, 2020, 15(23): 3553-3560.
[7] Dong X, Fu J, Yin X B,. Induction of apoptosis in HepaRG cell line by aloe-emodin through generation of reactive oxygen species and the mitochondrial pathway [J]., 2017, 42(2): 685-696.
[8] Mohammed A, Ibrahim M A, Tajuddeen N,. Antidiabetic potential of anthraquinones: A review [J]., 2020, 34(3): 486-504.
[9] Noel P, von Hoff D D, Saluja A K,. Triptolide and its derivatives as cancer therapies [J]., 2019, 40(5): 327-341.
[10] Xi C, Peng S J, Wu Z P,. Toxicity of triptolide and the molecular mechanisms involved [J]., 2017, 90: 531-541.
[11] Cheng X Y, Liao M, Diao X P,. Screening and identification of metabolites of two kinds of main active ingredients and hepatotoxic pyrrolizidine alkaloids in rat after lavageextract by UHPLC-Q-TOF- MS mass spectrometry [J]., 2018, 32(2): e4047.
[12] Li X X, Du F Y, Liu H X,. Investigation of the active components inleading to its acute hepatotoxicty and nephrotoxicity [J]., 2015, 162: 238-243.
[13] Yang F, Liang Y, Xu L,. Exploration in the cascade working mechanisms of liver injury induced by total saponins extracted from[J]., 2016, 83: 1048-1056.
[14] Wang L P, Lu J Y, Sun W,. Hepatotoxicity induced bySophorae tonkinensis in mice and increased serum cholinesterase as a potential supplemental biomarker for liver injury [J]., 2017, 69(4): 193-202.
[15] Qu L, Qu F, Jia Z X,. Integrated targeted sphingolipidomics and transcriptomics reveal abnormal sphingolipid metabolism as a novel mechanism of the hepatotoxicity and nephrotoxicity of triptolide [J]., 2015, 170: 28-38.
[16] Wang J M, Liang Q N, Ji L L,. Gender-related difference in liver injury induced byL. rhizome in mice [J]., 2011, 30(9): 1333-1341.
[17] Yu Q, Jiang L L, Luo N,. Enhanced absorption and inhibited metabolism of emodin by 2, 3, 5, 4- tetrahydroxystilbene-2--β--glucopyranoside: Possible mechanisms for-induced liver injury [J]., 2017, 15(6): 451-457.
[18] Li W W, Lin D J, Gao H Y,. Metabolic activation of furan moiety makes diosbulbin B hepatotoxic [J]., 2016, 90(4): 863-872.
[19] 杨倩, 李晓宇, 赵新妹, 等. 含何首乌的中成药不良反应系统分析 [J]. 中草药, 2017, 48(9): 1878-1887.
[20] 纪彩. 基于毒理基因组学的川楝子肝毒性研究 [D]. 杭州: 浙江大学, 2015.
[21] 严建业, 王元清, 王炜, 等. 细辛中马兜铃酸A与黄樟醚的炮制减毒方法研究 [J]. 中草药, 2015, 46(2): 216-220.
[22] Li D K, Chen J, Ge Z Z,. Hepatotoxicity in rats induced by aqueous extract of polygoni multiflori radix, root ofrelated to the activity inhibition of CYP1A2 or CYP2E1 [J]., 2017, 2017: 9456785.
[23] Hasnat M, Yuan Z Q, Naveed M,. Drp1-associated mitochondrial dysfunction and mitochondrial autophagy: A novel mechanism in triptolide-induced hepatotoxicity [J]., 2019, 35(3): 267-280.
[24] Yang X, Wang H, Ni H M,. Inhibition of Drp1 protects against senecionine-induced mitochondria- mediated apoptosis in primary hepatocytes and in mice [J]., 2017, 12: 264-273.
[25] Qu X Y, Tao L N, Zhang S X,. The role of Ntcp, Oatp2, Bsep and Mrp2 in liver injury induced byL. and diosbulbin B in mice [J]., 2017, 51: 16-22.
[26] Wang T T, Men R T, Hu M X,. Protective effects of(pomegranate) peel extract on concanavalin A-induced autoimmune hepatitis in mice [J]., 2018, 100: 213-220.
[27] Feng Q, Yao J C, Zhou G,. Quantitative proteomic analysis reveals that arctigenin alleviates concanavalin A-induced hepatitis through suppressing immune system and regulating autophagy [J]., 2018, 9: 1881.
[28] Zhou Y Q, Weng X F, Dou R,. Betulin fromameliorates concanavalin A-induced and T cell-mediated autoimmune hepatitis in mice [J]., 2017, 38(2): 201-210.
[29] Jin J, Sun X Z, Zhao Z X,. Activation of the farnesoid X receptor attenuates triptolide-induced liver toxicity [J]., 2015, 22(10): 894-901.
[30] Wang X Z, Xue R F, Zhang S Y,. Activation of natural killer T cells contributes to triptolide-induced liver injury in mice [J]., 2018, 39(12): 1847-1854.
[31] Congiu M, Mashford M L, Slavin J L,. Coordinate regulation of metabolic enzymes and transporters by nuclear transcription factors in human liver disease [J]., 2009, 24(6): 1038-1044.
[32] Zhang M, Lin L F, Lin H M,. Interpretation the hepatotoxicity based on pharmacokinetics investigated through oral administrated different extraction parts ofon rats [J]., 2018, 9: 505.
[33] Man S, Qiu P, Li J,. Global metabolic profiling for the study ofsaponins-induced hepatotoxicity in rats [J]., 2017, 32(1): 99-108.
[34] 余雪, 李敏谦, 郭姣. 内脏脂肪指数与糖脂代谢病的相关性研究 [J]. 世界中医药, 2019, 14(1): 29-32.
[35] Schönfeld P, Wojtczak L. Short- and medium-chain fatty acids in energy metabolism: The cellular perspective [J]., 2016, 57(6): 943-954.
[36] Liu X Y, Liu Y Q, Cheng M C,. Metabolomic responses of human hepatocytes to emodin, aristolochic acid, and triptolide: Chemicals purified from traditional Chinese medicines [J]., 2015, 29(11): 533-543.
[37] Cao L J, Hou Z Y, Li H D,. The ethanol extract of licorice () protects against triptolide-induced oxidative stress through activation of Nrf2 [J]., 2017, 2017: 2752389.
[38] Li X Y, Li X, Lu J X,. Saikosaponins induced hepatotoxicity in mice via lipid metabolism dysregulation and oxidative stress: A proteomic study [J]., 2017, 17(1): 219.
[39] Yan X M, Kang H, Feng J,. Identification of toxic pyrrolizidine alkaloids and their common hepatotoxicity mechanism [J]., 2016, 17(3): 318.
[40] Lee A Y, Jang Y, Hong S H,. Ephedrine-induced mitophagy via oxidative stress in human hepatic stellate cells [J]., 2017, 42(4): 461-473.
[41] Xiao R M, Wang J J, Chen J Y,. Effects of arecoline on hepatic cytochrome P450 activity and oxidative stress [J]., 2014, 39(4): 609-614.
[42] Pan Y X, Luo Z, Zhuo M Q,. Oxidative stress and mitochondrial dysfunction mediated Cd-induced hepatic lipid accumulation in zebrafish[J]., 2018, 199: 12-20.
[43] Nadanaciva S, Will Y. Investigating mitochondrial dysfunction to increase drug safety in the pharmaceutical industry [J]., 2011, 12(6): 774-782.
[44] Porceddu M, Buron N, Rustin P,.assessment of mitochondrial toxicity to predict drug-induced liver injury [A] //. [M]. New York: Springer New York, 2018: 283-300.
[45] Yang X W, Zhang Y H, Liu Y,. Emodin induces liver injury by inhibiting the key enzymes of FADH/NADPH transport in rat liver [J].(Camb), 2018, 7(5): 888-896.
[46] Dong X, Fu J, Yin X B,. Induction of apoptosis in HepaRG cell line by aloe-emodin through generation of reactive oxygen species and the mitochondrial pathway [J]., 2017, 42(2): 685-696.
[47] Dong X, Fu J, Yin X B,.-emodin induces apoptosis in human liver HL-7702 cells through fas death pathway and the mitochondrial pathway by generating reactive oxygen species [J]., 2017, 31(6): 927-936.
[48] Liu L, Zou J, Liu X,. Inhibition of ATP-induced macrophage death by emodin via antagonizing P2X7 receptor [J]., 2010, 640(1/2/3): 15-19.
[49] Lin L F, Liu Y L, Fu S,. Inhibition of mitochondrial complex function—the hepatotoxicity mechanism of emodin based on quantitative proteomic analyses [J]., 2019, 8(3): 263.
[50] Chen X H, Han Y T, Ye J L,.extract Haishengsu inhibits tumor activity via a mitochondrial‑mediated apoptotic pathway [J]., 2018, 17(5): 6828-6834.
[51] 杨晓伟, 张银环, 段飞鹏, 等. 基于Lable-free蛋白质组学技术研究大黄素致大鼠肝损伤作用机制[J]. 世界中医药, 2019, 14(2): 320-325.
[52] Cai Q, Wei J, Zhao W,. Toxicity ofon rat liver mitochondria: The role of oxidative stress and mitochondrial permeability transition [J]., 2014, 19(12): 21168-21182.
[53] Yang X, Wang H, Ni H M,. Inhibition of Drp1 protects against senecionine-induced mitochondria- mediated apoptosis in primary hepatocytes and in mice [J]., 2017, 12: 264-273.
[54] Hasnat M, Yuan Z Q, Naveed M,. Drp1-associated mitochondrial dysfunction and mitochondrial autophagy: A novel mechanism in triptolide-induced hepatotoxicity [J]., 2019, 35(3): 267-280.
[55] Hirota Y, Kang D, Kanki T. The physiological role of mitophagy: New insights into phosphorylation events [J]., 2012, 2012: 354914.
[56] Ney P A. Mitochondrial autophagy: Origins, significance, and role of BNIP3and NIX [J]., 2015, 1853(10 Pt B): 2775-2783.
[57] Ding W X, Yin X M. Mitophagy: mechanisms, pathophysiological roles, and analysis [J]., 2012, 393(7): 547-564.
[58] Chen C H, Chen M F, Huang S J,. Saikosaponin a induces apoptosis through mitochondria-dependent pathway in hepatic stellate cells [J]., 2017, 45(2): 351-368.
[59] Zhang F, Chen L, Jin H,. Activation of Fas death receptor pathway and Bid in hepatocytes is involved in saikosaponin D induction of hepatotoxicity [J]., 2016, 41: 8-13.
[60] Liu Y, Dong X, Wang W P,. Molecular mechanisms of apoptosis in HepaRG cell line induced by polyphyllin VI via the fas death pathway and mitochondrial- dependent pathway [J].(Basel), 2018, 10(5): E201.
[61] Yan X J, Zhang L, Cao Y D,. An ingenol derived frominduces hepatocyte cytotoxicity by triggering G0/G1cell cycle arrest and regulating the mitochondrial apoptosis pathway[J]., 2016, 21(6): E813.
[62] Ji L L, Chen Y, Liu T,. Involvement of Bcl-xL degradation and mitochondrial-mediated apoptotic pathway in pyrrolizidine alkaloids-induced apoptosis in hepatocytes [J]., 2008, 231(3): 393-400.
[63] Yang X, Wang H, Ni H M,. Inhibition of Drp1 protects against senecionine-induced mitochondria- mediated apoptosis in primary hepatocytes and in mice [J]., 2017, 12: 264-273.
[64] 马喆, 赵珺睿, 董冉冉, 等. 基于高内涵分析技术的何首乌提取物及其主要成分肝毒性研究 [J]. 中草药, 2016, 47(22): 4021-4029.
[65] 徐虎军, 王丽平, 欧莉, 等. “有故无陨”法则下基于线粒体能量代谢途径的制首乌肝毒性机制研究 [J]. 中药药理与临床, 2019, 35(3): 82-87.
[66] Gao D, Pang J Y, Zhang C,.attenuates idiosyncratic liver injury induced by[J]., 2016, 7: 386.
[67] Li C Y, Tu C, Gao D,. Metabolomic study on idiosyncratic liver injury induced by different extracts ofin rats integrated with pattern recognition and enriched pathways analysis [J]., 2016, 7: 483.
[68] Meng Y K, Li C Y, Li R Y,.-stilbene glucoside ininduces immunological idiosyncratic hepatotoxicity in LPS-treated rats by suppressing PPAR-γ [J]., 2017, 38(10): 1340-1352.
[69] Wang Y Y, Li J, Wu Z R,. Insights into the molecular mechanisms ofThunb-induced liver injury: A computational systems toxicology approach [J]., 2017, 38(5): 719-732.
[70] 王文静, 李娅琳. 生何首乌、制何首乌对大鼠肝微粒体CYP450的影响 [J]. 现代中医药, 2014, 34(2): 76-79.
[71] Lu Y, Xie T, Zhang Y,. Triptolide induces hepatotoxicity via inhibition of CYP450s in rat liver microsomes [J]., 2017, 17(1): 15.
[72] Yang A H, Zhang L, Zhi D X,. Identification and analysis of the reactive metabolites related to the hepatotoxicity of safrole [J]., 2018, 48(11): 1164-1172.
[73] Lin D, Li W, Peng Y,. Role of metabolic activation in 8-epidiosbulbin E acetate-induced liver injury: Mechanism of action of the hepatotoxic furanoid [J]., 2016, 29(3): 359-366.
[74] Jiang J Z, Yang B H, Ji L L,. Metabolic-induced cytotoxicity of diosbulbin B in CYP3A4-expressing cells [J]., 2017, 38: 59-66.
[75] Tu C, Gao D, Li X F,. Inflammatory stress potentiates emodin-induced liver injury in rats [J]., 2015, 6: 233.
[76] Han C Y, Lim S W, Koo J H,. PHLDA3 overexpression in hepatocytes by endoplasmic reticulum stress via IRE1-Xbp1s pathway expedites liver injury [J]., 2016, 65(8): 1377-1388.
[77] Ron D, Walter P. Signal integration in the endoplasmicunfolded protein response [J]., 2007, 8(7): 519-529.
[78] Ozcan L, Tabas I. Role of endoplasmic reticulum stress in metabolic disease and other disorders [J]., 2012, 63: 317-328.
[79] Shen Z, Chen J, Lu H. Osthole induced apoptosis in human normal liver cells by regulating cell proliferation and endoplasmic reticulum stress [J]., 2019, 34(6): 768-776.
[80] Gu L L, Shen Z L, Li Y L,. Oxymatrine causes hepatotoxicity by promoting the phosphorylation of JNK and induction of endoplasmic reticulum stress mediated by ROS in L02 cells [J]., 2018, 41(5): 401-412.
[81] Yang Y, Tang X, Hao F,. Bavachin induces apoptosis through mitochondrial regulated ER stress pathway in HepG2 cells [J]., 2018, 41(2): 198-207.
[82] Jia Z, Zhao C, Wang M,. Hepatotoxicity assessment ofin adult zebrafish through proteomes and metabolome [J]., 2020, 121: 109558.
[83] Yang L, Yu Y L, Cheng L Y,. The accumulation of psoralen contributes to its hepatotoxicity revealed by pharmacokinetic and toxicokinetic study after repeated administration [J]., 2020, 5(13): 7307-7315.
[84] Mennecozzi M, Landesmann B, Palosaari T,. Sex differences in liver toxicity-do female and male human primary hepatocytes react differently to toxicants? [J]., 2015, doi: 10.1371/journal.pone. 0122786.
[85] Chen Y K, Tang Y, Guo C X,. Nuclear receptors in the multidrug resistance through the regulation of drug-metabolizing enzymes and drug transporters [J]., 2012, 83(8): 1112-1126.
[86] Xu C S, Huang M, Bi H C. PXR- and CAR-mediated herbal effect on human diseases [J]., 2016, 1859(9): 1121-1129.
[87] Shehu A I, Lu J, Wang P C,. Pregnane X receptor activation potentiates ritonavir hepatotoxicity [J]., 2019, 129(7): 2898-2903.
[88] 陆伟, 钱飞亚, 冯哲, 等. 对乙酰氨基酚调控孕烷X受体诱导肝损伤 [J]. 国际药学研究杂志, 2018, 45(2): 112-118.
[89] Wang L, Li F, Lu J,. The Chinese herbal medicineactivates pregnane X receptor [J]., 2010, 38(12): 2226-2231.
[90] 张照研, 王宇光, 黄小燕, 等. 何首乌6种成分对人孕烷X受体介导的CYP3A4的调控作用 [J]. 中国中药杂志, 2018, 43(20): 4104-4110.
[91] Jin J, Sun X Z, Zhao Z X,. Activation of the farnesoid X receptor attenuates triptolide-induced liver toxicity [J]., 2015, 22(10): 894-901.
[92] Xu C, Luo M Y, Jiang H D,. Involvement of CAR and PXR in the transcriptional regulation of CYP2B6 gene expression by ingredients from herbal medicines [J]., 2015, 45(9): 773-781.
[93] 魏舒婷, 刘元乾, 黄坚, 等. 吴茱萸化学成分、药效及肝毒性的研究进展 [J]. 世界中医药, 2020, 15(23): 3580-3585.
[94] Zhang F L, He X, Zhai Y R,. Mechanism-based inhibition of CYPs and RMs-induced hepatoxicity by rutaecarpine [J]., 2015, 45(11): 978-989.
[95] Congiu M, Mashford M L, Slavin J L,. Coordinate regulation of metabolic enzymes and transporters by nuclear transcription factors in human liver disease [J]., 2009, 24(6): 1038-1044.
[96] 李红品, 朱虹宇, 高兴, 等. 基于特异质大鼠胆红素相关转运体功能抑制探讨首乌藤肝损伤机制[J]. 中国中药杂志, 2017, 42(18): 3591-3595.
[97] Hou Z Y, Chen L, Fang P F,. Mechanisms of triptolide-induced hepatotoxicity and protective effect of combined use of isoliquiritigenin: Possible roles of Nrf2 and hepatic transporters [J]., 2018, 9: 226.
[98] Li J, Shen F H, Guan C W,. Activation of Nrf2 protects against triptolide-induced hepatotoxicity [J]., 2014, 9(7): e100685.
[99] Jing X, Zhang J, Huang Z,. The involvement of Nrf2 antioxidant signalling pathway in the protection of monocrotaline-induced hepatic sinusoidal obstruction syndrome in rats by (+)-catechin hydrate [J]., 2018, 52(4): 402-414.
[100]Jin Y, Huang Z L, Li L,. Quercetin attenuates toosendanin-induced hepatotoxicity through inducing the Nrf2/GCL/GSH antioxidant signaling pathway [J]., 2019, 40(1): 75-85.
[101] Niu C W, Sheng Y C, Yang R,. Scutellarin protects against the liver injury induced by diosbulbin B in mice and its mechanism [J]., 2015, 164: 301-308.
[102]Wei C B, Tao K, Jiang R,. Quercetin protects mouse liver against triptolide-induced hepatic injury by restoring Th17/Treg balance through Tim-3 and TLR4-MyD88-NF- κB pathway [J]., 2017, 53: 73-82.
[103]Lu H, Zhang L, Gu L L,. Oxymatrine induces liver injury through JNK signalling pathway mediated by TNF-α[J]., 2016, 119(4): 405-411.
[104]Li J Y, Cao H Y, Liu P,. Glycyrrhizic acid in the treatment of liver diseases: Literature review [J]., 2014, 2014: 872139.
[105]Yan T T, Wang H, Cao L J,. Glycyrrhizin alleviates nonalcoholic steatohepatitis via modulating bile acids and meta-inflammation [J]., 2018, 46(9): 1310-1319.
[106]Qian Y, Yang Y, Wang K,. 2-hydroxychalcone induced cytotoxicity via oxidative stress in the lipid- loaded Hepg2 cells [J]., 2019, 10: 1390.
[107]Ruan L Y, Li M H, Xing Y X,. Hepatotoxicity and hepatoprotection ofThund. as two sides of the same biological coin [J]., 2019, 230: 81-94.
[108]马红红, 魏桂林, 潘秋莎, 等. 中药人源性毒性评判的科学基础、策略与技术关键点[J]. 世界中医药, 2020, 15(23): 3568-3573.
[109]Jiang L L, Zhao D S, Fan Y X,. Detection of emodin derived glutathione adduct in normal rats administered with large dosage of[J]., 2017, 8: 446.
Material basis for liver toxicity of traditional Chinese medicine and research progress on its mechanism
LI Zhi-qi, FAN Qi-qi, CHEN Mei-lin, LI Chao-feng, WANG Zhao-yi, FENG Dan, ZHONG Xin-yue, GUO Si-min, ZHAO Chong-jun, LIN Rui-chao
Beijing Key Laboratory for Quality Evaluation of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
In recent years, the adverse effects on the liver system or TCM-induced hepatotoxicity have been reported frequently, TCM has become an important clinical cause of drug-induced liver injury (DILI). Generally, the ingredients of TCM with typical therapeutic or toxic effects are complex and unclear, resulting in the uncertainty of specific material basis for efficacy/toxicity, specific clinical symptoms and toxic mechanisms. However, the strategies adopted for TCM-induced hepatotoxicity research mainly refer to the basic principles of conventional toxicology, causing exaggerative or incorrect interpretations in the toxicity of TCM. This review highlights the basic classification of hepatotoxic substances in TCM and the possible toxicity mechanism, aiming to summarizethe classification, mechanisms and targets of the risk components in TCM-induced liver injury (TILI) with view to guiding clinical rational use. According to the different chemical structures, the risk ingredients mainly include alkaloids, glycosides, terpenoids and lactones, and anthraquinones. According to whether the drug metabolism is activated or whether the liver cells are directly attacked in the process of TCM-induced liver injury, the potential poisonous components can be classified into metabolic activation, non-metabolic activation, and mixed types. In addition, this review summarizes the potential mechanism of TCM-induced hepatotoxicity from the aspects of fat metabolism, cytochrome P450 (CYP450), mitochondrial function, oxidative damage, apoptosis, endoplasmic reticulum stress and idiosyncratic reaction, and put forward the targets involved in the TILI, including metabolic enzymes, nuclear receptors, transporter and signaling pathways. Our periodic review and summary on the risk signals of TCM-induced liver injury must be beneficial to the integrated analysis on the multi-component, multi-target, and multi-effect characteristics of TCM-induced hepatotoxicity. In this review, we also present the existing problems in toxicity studies for TCM and provide new perspectives for research on the potential TILI. We hope that this study can offer important theoretical support and scientific advice for the toxicity study and clinical rational use of TCM with hepatotoxicity.
TCM-induced liver injury; material basis; mechanisms; targets; TCM-induced liver injury
R28
A
0253 - 2670(2021)13 - 4082 - 14
10.7501/j.issn.0253-2670.2021.13.032
2021-02-25
北京中医药大学新教师科研启动基金项目(2020-JYB-XJSJJ-009)
李芝奇(1998—),女,博士研究生,主要研究方向为中药安全性评价及主要活性/毒性物质基础筛选。Tel: 15011227511 E-mail: lizhiqi1998@126.com
赵崇军(1988—),男,助理研究员,主要研究方向为中药安全性评价及主要活性/毒性物质基础筛选。Tel: 15301127325 E-mail: 1014256537@qq.com
林瑞超(1954—),教授,主要研究方向为中药品质评价。E-mail: linrch307@sina.com
[责任编辑 王文倩]