海拔高度对蒙古黄芪主要药效成分积累及其关键酶基因表达量影响研究
吴 培,孙 卓, 2*,杨利民, 2*,韩 梅, 2
海拔高度对蒙古黄芪主要药效成分积累及其关键酶基因表达量影响研究
吴 培1,孙 卓1, 2*,杨利民1, 2*,韩 梅1, 2
1. 吉林农业大学 中药材学院,吉林 长春 130118 2. 省部共建生态恢复与生态系统管理国家重点实验室,吉林 长春 130118
研究不同海拔高度与蒙古黄芪var.主要药效成分含量及其关键酶基因表达量之间的关系。采用HPLC法检测黄芪根中黄芪甲苷与毛蕊异黄酮葡萄糖苷的含量,采用实时荧光定量PCR法检测黄芪甲苷生物合成过程中关键酶基因乙酰辅酶A乙酰基转移酶[AACT,acetoacetyl-co zyme A (CoA) thiolase]、3-羟基-3-甲基戊二酰辅酶A合酶(HMG-CoA synthase,HMGS)、3-羟基-3-甲基戊二酰辅酶A还原酶[3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase,HMGR]、异戊二烯焦磷酸异构酶(iso-pentenyl diphosphate isomerase,IDI)、法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPS)、鲨烯合酶(squalene synthase,SS)、鲨烯环氧酶(squalene epoxidase,SE)、环阿尔庭烷合酶(cycloartenol synthase,CAS)基因的表达量。4个样地中样地HQ-2(内蒙呼和浩特可可以力更镇)中黄芪甲苷含量、毛蕊异黄酮葡萄糖苷含量及总皂苷含量普遍高于其他样地;相关性分析表明,海拔高度对黄芪总皂苷合成的影响较大,、和基因在黄芪总皂苷的合成过程中起主要作用,海拔高度有利于、和基因的表达,海拔高度对黄芪皂苷合成途径中关键酶基因具有一定的调控作用。在处于海拔1730 m左右的地区种植蒙古黄芪有利于其药效成分的积累。
蒙古黄芪;基因表达;总皂苷;海拔高度
蒙古黄芪(Fisch.) Bunge var.(Bge.) Hsiao.为豆科多年生草本植物,属药食兼用资源种,其主产区为我国山西、甘肃、内蒙古等地[1]。随着人民生活水平的改善和医疗保健水平的提高,黄芪的市场需求量持续增加,野生资源无法满足市场需求,因此自20世纪70年代中后期,黄芪药材主要来源于人工栽培[2]。但目前蒙古黄芪的人工栽培普遍存在质量不稳,产量偏低等问题,严重制约了黄芪产业的可持续健康发展。
生态因素是影响药材质量形成的关键因素之一,包括气候、土壤、海拔等生态因子[3]。其中,海拔高度对道地药材的成分积累存在一定影响[4]。研究发现,随栽培地海拔的升高,同一生长年限的黄芩中黄酮类成分含量呈现明显的上升趋势,且有显著性差异[5]。王寅秀等[6]研究发现,海拔100~800 m内的人参多糖含量与海拔高度呈正相关,海拔950~1450 m人参多糖含量与海拔高度呈负相关;胡明勋等[7]研究发现海拔影响恒山野生蒙古黄芪药材黄酮成分含量。目前,关于不同海拔高度与蒙古黄芪皂苷类、黄酮类成分含量及其关键酶基因表达量之间的关系鲜有报道,因此,本研究从质量和分子层面探究海拔与蒙古黄芪之间的关系,旨在确定蒙古黄芪的适宜栽培区域,为提高黄芪品质提供科学依据和理论参考。
1 自然概况与材料
1.1 自然概况
内蒙古呼和浩特地区平均海拔1050 m,属西北大陆性气候。四季分明,昼夜温差较大,夏无酷暑,冬无严寒,全年平均气温在8 ℃左右。最冷月气温−12.7~−16.1 ℃;最热月平均气温17~22.9 ℃。平均年较差为34.4~35.7 ℃,平均日较差为13.5~13.7 ℃。极端最高气温38.5 ℃,最低−41.5 ℃。日照时间年均1 600 h。土壤以沙壤土为主。
1.2 材料
1.2.1 样品的采集与处理 于2018年10月21日在内蒙古呼和浩特地区4个样地采集同一生育时期蒙古黄芪样品116份。采用五点采样法采集黄芪样品,将样品低温条件下运输,带回实验室后小心清洗,冷冻保存。将剩余样品烘干至恒定质量,粉碎并过100目筛,以便后续实验。所有样品由吉林农业大学杨利民教授鉴定为蒙古黄芪(Fisch.) Bunge var.(Bge.) Hsiao.,样地信息见表1。
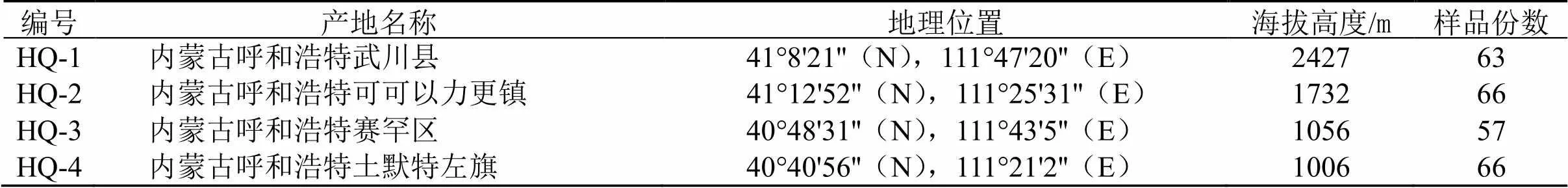
表1 样地信息
1.2.2 试剂 百泰克植物多糖多酚总RNA提取试剂盒,百泰克反转录试剂盒(北京百泰克生物有限公司),SYBR Premix Ex Taq TM II试剂盒(DRR081A)(日本TaKaRa有限公司),黄芪甲苷对照品购于上海源叶生物科技有限公司,质量分数>98%;毛蕊异黄酮葡萄糖苷对照品(质量分数>98%,批号20633-67-4)购于大北京索莱宝公司,乙腈,甲醇为色谱纯,乙醇以及其他试剂均为分析纯,蒸馏水。
1.2.3 仪器 AUY220电子天平;GZX-9070MBE电热鼓风干燥箱;DL-820E智能超声波清洗器(上海之信仪器有限公司);Agilent1260高效液相色谱仪(Agilent,美国);依利特ODS柱(250 mm×4.6 mm,5 μm);ProFlex™梯度PCR扩增仪(Applied Biosystems,美国);Mx3000P实时荧光定量PCR仪(Agilent公司,美国);NanoDrop 2000核酸/蛋白定量仪(Thermo公司,美国);DYY-8C型电泳仪(北京六一电泳厂);Tanon Gis-2010凝胶成像系统[天能科技(上海)有限公司];电热恒温水浴锅(北京市永光明医疗仪器有限公司);高速离心机(美国Thermo公司);高速万能打粉机(天津泰斯特仪器有限公司)。
2 方法
2.1 蒙古黄芪黄芪甲苷含量的测定
2.1.1 对照品溶液的制备 精确称量黄芪甲苷对照品2.46 mg置于10 mL量瓶中,加少量甲醇溶解,定容,摇匀,即得对照品溶液。
2.1.2 供试品溶液的制备 精确称量蒙古黄芪根部样品1.00 g,加入15 mL甲醇超声提取30 min,提取3次,合并滤液,用蒸发皿在水浴锅中65 ℃下蒸发溶剂,加入甲醇溶解,随后将提取物离心,定容至1 mL,选择0.22 μm微孔滤膜滤过上清液。
2.1.3 色谱条件[8]Agilent 1260型高效液相色谱仪UV检测器;色谱柱:依利特Hypersil ODS(250 mm×4.6 mm,5 μm)柱;乙腈-水(32∶64)等度洗脱;体积流量1.0 mL/min;检测波长203 nm;柱温30 ℃;进样量10 μL;检测时间30 min。
2.1.4 标准曲线绘制 精密吸取黄芪甲苷对照品溶液 1、2、4、6、8、10 μL 注入液相色谱仪,按照“2.1.3”项下色谱条件进行测定,以黄芪甲苷峰面积为横坐标(),质量分数为纵坐标(),绘制线性回归方程,=449.1-1.001 2,²=0.994。记录色谱图(图1),并计算黄芪甲苷质量分数。
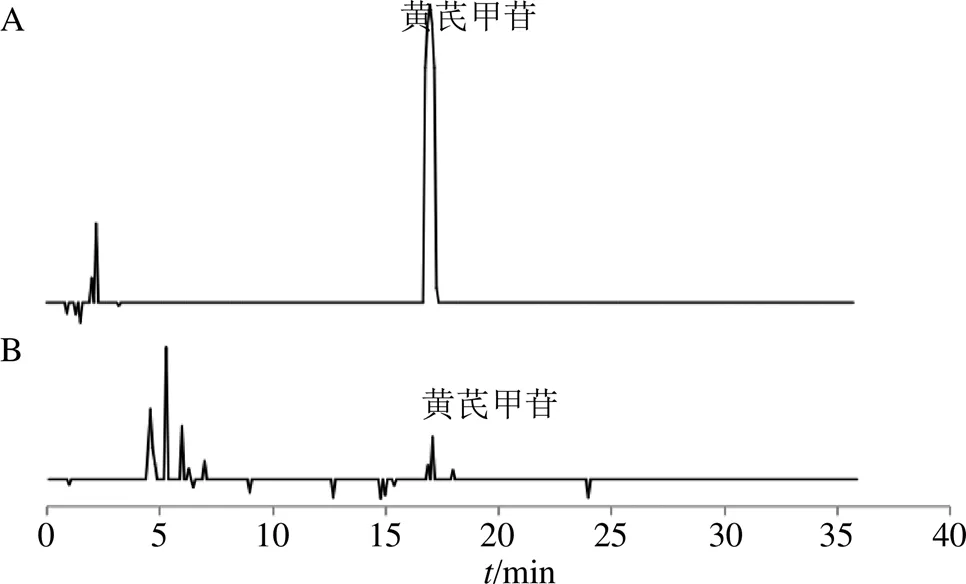
图1 黄芪甲苷对照品 (A) 和蒙古黄芪(B) 样品的高效液相色谱图
2.1.5 精密度试验 吸取黄芪甲苷对照品溶液,在“2.1.3”项色谱条件下重复进样6次,每次进样10 μL,计算黄芪甲苷峰面积的RSD值为1.72%,说明实验仪器的精密度较好。
2.1.6 重复性试验 取蒙古黄芪粉(HQ-1)1.0 g,按照“2.1.2”项平行制备6份供试品溶液,在“2.1.3”项色谱条件下进行分析,计算黄芪甲苷质量分数的RSD值为1.94%,说明本实验的重复性较好。
2.1.7 稳定性试验 取同一份药材样品(HQ-1),按照“2.1.2”项的方法制备供试品溶液,在室温下分别于 0、2、4、6、8、12、24 h内进行测定,以峰面积为指标计算黄芪甲苷的RSD值为1.88%,说明供试品溶液能在24 h内保持稳定。
2.1.8 加样回收率试验 取同一批(HQ-1)黄芪样品6份,每份样品1.0 g,加入黄芪甲苷对照品甲醇溶液1 mL,室温挥干,按照“2.1.2”项制备供试品溶液,测定,加样回收率为97.6%,RSD值小于3%。
2.2 蒙古黄芪毛蕊异黄酮葡萄糖苷含量测定
2.2.1 对照品溶液的制备 精确称量毛蕊异黄酮葡萄糖苷对照品2.37 mg,置于10 mL量瓶中,加少量甲醇溶解,定容,摇匀,即得对照品溶液。
2.2.2 供试品溶液的制备 以“2.1.2”项中提取的滤液为供试品。
2.2.3 色谱条件 色谱条件为安捷伦Agilent(250 mm×4.6 mm,5 μm)色谱柱;流动相为乙腈和0.2%甲酸;体积流量1.0 mL/min;检测波长260 nm;进样量10 μL[10]。
2.2.4 标准曲线绘制 精密吸取毛蕊异黄酮葡萄糖苷对照品溶液 1、2、4、6、8、10 μL 注入液相色谱仪,按照“2.2.3”项色谱条件进行测定,以峰面积为纵坐标(),质量浓度为横坐标(),绘制标准曲线,根据标准曲线方程=25.712-3.297 2,2=0.999 6,记录色谱图(图2),计算毛蕊异黄酮葡萄糖苷含量。
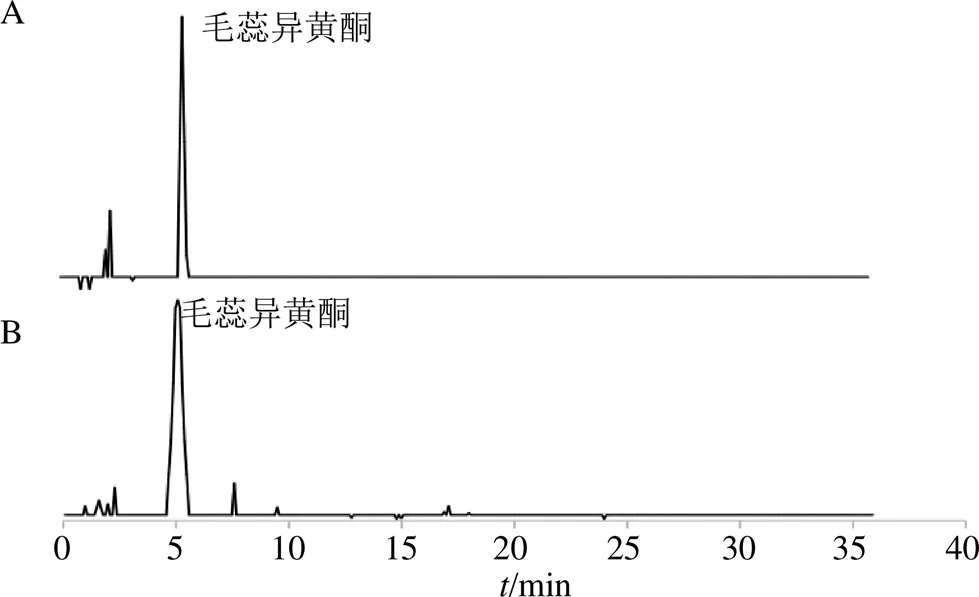
图2 毛瑞异黄酮对照品(A) 和黄芪样品(B) 的高效液相色谱图
2.2.5 精密度试验 吸取毛蕊异黄酮葡萄糖苷对照品溶液,在“2.2.3”项色谱条件下重复进样6次,每次进样10 μL,计算黄芪甲苷峰面积的RSD值为1.72%。
2.2.6 重复性试验 取蒙古黄芪粉(HQ-1)1.0 g,按照“2.1.2”项平行制备6份供试品溶液,在“2.2.3”项色谱条件下进行分析,计算毛蕊异黄酮葡萄糖苷质量分数的RSD值为1.94%。
2.2.7 稳定性试验 取同一份药材样品(HQ-1),按照“2.1.2”项的方法制备供试品溶液,在室温下分别于 0、2、4、6、8、12、24 h内进行测定,以峰面积为指标计算毛蕊异黄酮葡萄糖苷的RSD值为1.88%。
2.2.8 加样回收率试验 取同一批(HQ-1)黄芪样品6份,每份样品1.0 g,加入毛蕊异黄酮葡萄糖苷对照品甲醇溶液1 mL,室温挥干,按照“2.1.2”项制备供试品溶液,测定,加样回收率为99.6%,RSD值小于3%。
2.3 蒙古黄芪总皂苷含量的测定
2.3.1 供试品溶液的制备 精确称量不同产地蒙古黄芪样品1.00 g,加入15 mL 80%乙醇超声提取30 min,提取3次,合并滤液。用蒸发皿在水浴锅中65 ℃下蒸发溶剂,加入80%甲醇溶解,随后将提取物离心,挥干溶液,定容至5 mL,即得供试品溶液。
2.3.2 对照品溶液制备 精密称取黄芪甲苷对照品5mg,置于10 mL量瓶中,加少量甲醇溶解,定容,摇匀,即得对照品溶液。
2.3.3 测定波长的选择 取对照品溶液、供试品溶液适量,加入5%香草醛-冰醋酸试液0.2 mL,高氯酸溶液0.8 mL,充分振摇混匀后置于60 ℃恒温水浴上加热20 min,立即用冰水冷却至室温,再加入5 mL冰醋酸溶液,摇匀。以试剂作空白,采用紫外分光光度法在200~700 nm进行扫描,于570 nm波长处有最大吸收。
2.3.4 线性方程的绘制以吸光度()为纵坐标、浓度()为横坐标,绘制标准曲线,根据标准曲线方程:= 4.368 7-0.041 4,²= 0.997,计算总皂苷含量。
2.4 蒙古黄芪根组织总RNA的提取
将保存在−80 ℃的蒙古黄芪根组织样品在液氮中充分研磨至粉末状,利用多糖多酚植物总RNA提取试剂盒提取总RNA,研磨样品约30 min,在研磨过程中,注意试验环境的卫生状况以免样品感染,最好选择在冰上操作,以加大提取总RNA试验的成功率。利用NanoDrop 2000检测仪测定蒙古黄芪根组织中RNA浓度,并对提取得到的总RNA进行完整性检测。选用M-MuLV第一链cDNA合成试剂盒,按试剂盒中提供的操作步骤将总RNA逆转录合成cDNA,并于−20 ℃保存备用。
2.5 引物设计
根据GenBank数据库中已经公布的黄芪乙酰辅酶A乙酰基转移酶[acetoacetyl-co zyme A (CoA) thiolase ,AACT]、3-羟基-3-甲基戊二酰辅酶A合酶(HMG-CoA synthase,HMGS)、3-羟基-3-甲基戊二酰辅酶A还原酶[3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase,HMGR]、异戊二烯焦磷酸异构酶(iso-pentenyl diphosphate isomerase,IDI)、法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPS)、鲨烯合酶(squalene synthase,SS)、鲨烯环氧酶(squalene epoxidase,SE)、环阿尔庭烷合酶(cycloartenol synthase,CAS),以18S RNA为内参基因,上海生物工程技术有限公司,引物序列见表2。

表2 基因序列引物
2.6 关键酶基因表达量的测定
以各样地地蒙古黄芪根组织的cDNA为模板,18S RNA为内参基因,根据表2中各基因的引物序列,分别对、、、、、、和基因进行RT-PCR扩增,重复3次,采用2−ΔΔCt法分析结果。PCR反应体系为:灭菌水7.4 µL,SYBR® Premix Ex TaqTM 10 µL,正反引物各0.8 µL,cDNA模板1.0 µL,共20 µL的反应体系。RT-PCR反应程序:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,反应40个循环。
2.7 数据分析
实验所得数据采用Excel 2010、SPSS和GraphPad Prism6等软件进行处理。
3 结果与分析
3.1 不同产地蒙古黄芪黄芪甲苷含量
内蒙古呼和浩特地区蒙古黄芪黄芪甲苷含量见图3,各样地蒙古黄芪中黄芪甲苷含量差异较大,其中HQ-4样地的蒙古黄芪黄芪甲苷含量最高为0.066%,HQ-3蒙古黄芪黄芪甲苷含量最低为0.024%,二者相差2.73倍。《中国药典》2015年版规定黄芪甲苷的含量为不小于0.04%,样地HQ-1、HQ-2及HQ-4黄芪中黄芪甲苷含量达到国家药典水平,样地HQ-3黄芪未达到药典规定。呼和浩特地区蒙古黄芪中黄芪甲苷含量的排序由高到低依次为土默特左旗>可可以力更镇>武川县>赛罕区。
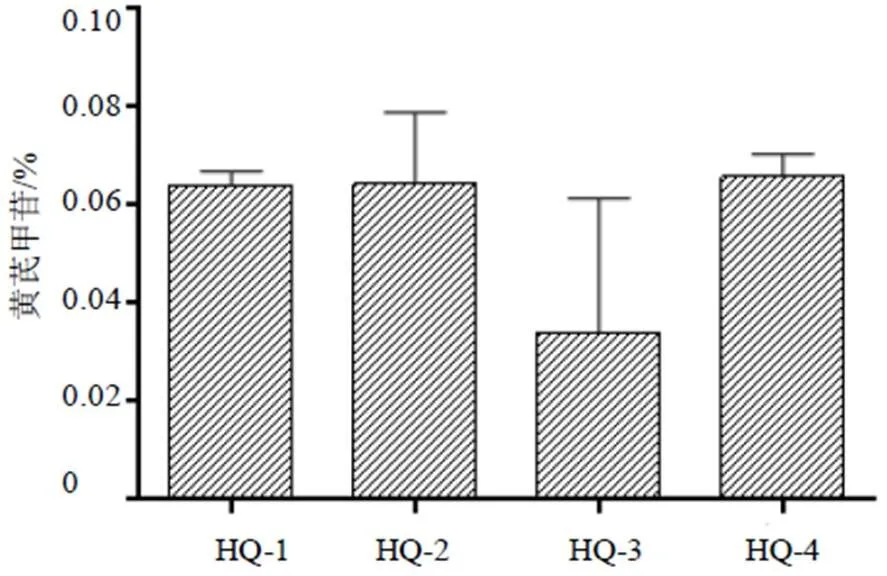
图3 不同样地黄芪甲苷含量
3.2 不同产地蒙古黄芪毛蕊异黄酮葡萄糖苷含量
内蒙古呼和浩特地区蒙古黄芪中毛蕊异黄酮葡萄糖苷含量结果见图4,HQ-2的蒙古黄芪毛蕊异黄酮葡萄糖苷含量最高为0.409%,在HQ-1样地蒙古黄芪中毛蕊异黄酮葡萄糖苷最低为0.085%;《中国药典》2015年版规定黄芪甲苷的含量为不小于0.02%,均达到了药典要求,其中样地HQ-2黄芪中毛蕊异黄酮葡萄糖苷含量约为药典规定的20倍。呼和浩特地区蒙古黄芪中毛蕊异黄酮葡萄糖苷含量的排序由高到低依次为可可以力更镇>土默特左旗>赛罕区>武川县。
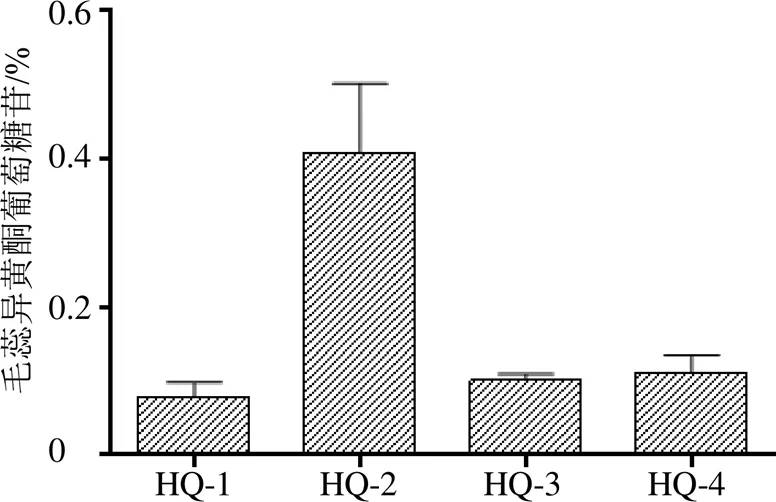
图4 不同样地毛蕊异黄酮葡萄糖苷含量
3.3 不同产地蒙古黄芪总皂苷含量
内蒙古呼和浩特地区蒙古黄芪中总皂苷含量结果见图5,HQ-2的蒙古黄芪总皂苷含量最高为11.064%,在HQ-4样地蒙古黄芪中毛蕊异黄酮葡萄糖苷最低为1.591%。由图可知,样地HQ-1与HQ-2黄芪中总皂苷含量显著高于样地HQ-3与HQ-4。呼和浩特地区蒙古黄芪中总皂苷含量的排序由高到低依次为可可以力更镇>武川县>赛罕区>土默特左旗。
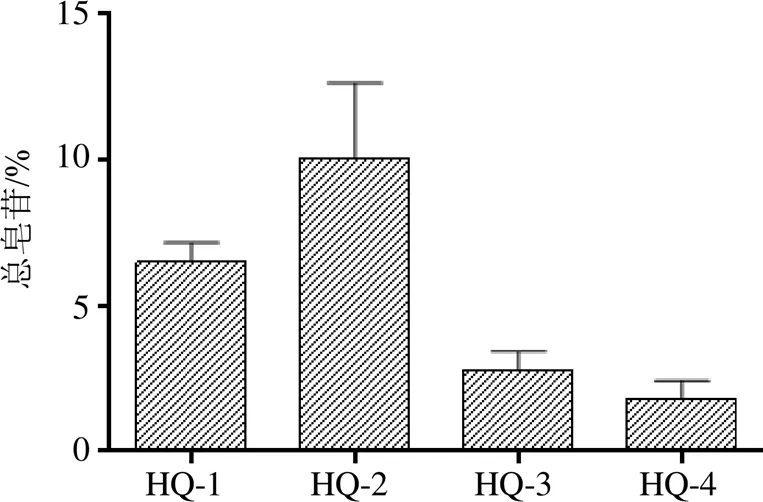
图5 不同样地总皂苷含量
3.4 蒙古黄芪根组织总RNA提取结果
将提取得到的不同产地蒙古黄芪根组织中总RNA进行质量浓度和纯度检测260/280和260/230值,260/280和260/230值可表明RNA的纯度,260/280应在2.0~2.2,若小于2.0说明存在蛋白或有机物污染,若大于2.2说明RNA已水解为单核苷酸。260/230应在2.0~2.4,若小于 2.0说明存在乙醇、异硫氰酸胍等残留,若大于2.4说明需用乙醇、乙酸盐沉淀RNA。结果见表3,蒙古黄芪根组织中总RNA的质量浓度和纯度均较高,可用于下一步试验。
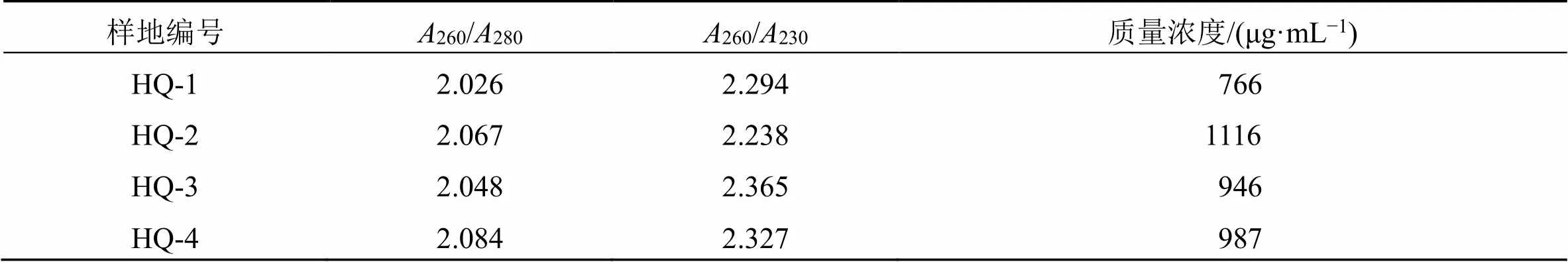
表3 不同样地蒙古黄芪根部总RNA的检测结果
3.5 关键酶基因表达量的测定
利用实时荧光定量PCR方法,以18S RNA作为内参基因,检测呼和浩特地区蒙古黄芪根组织中、、、、、、、基因的表达量,结果见图6。HQ-1样品中基因表达量最高为1.54,HQ-2样品基因表达量最低为0.461,两者相差3.35倍。基因各产地表达量相差不大,HQ-3样品中基因相对表达量最低。、和基因在呼和浩特地区黄芪根组织表达趋势基本一致,均是HQ-2样地显著高于其他省份黄芪。基因表达量最高是HQ-2,是表达量最低的HQ-3的4.6 倍左右。基因HQ-1与HQ-2中相对表达量普遍高于HQ-3与HQ-4相对表达量。HQ-1样地基因相对表达量显著高于其他样地为2.63。
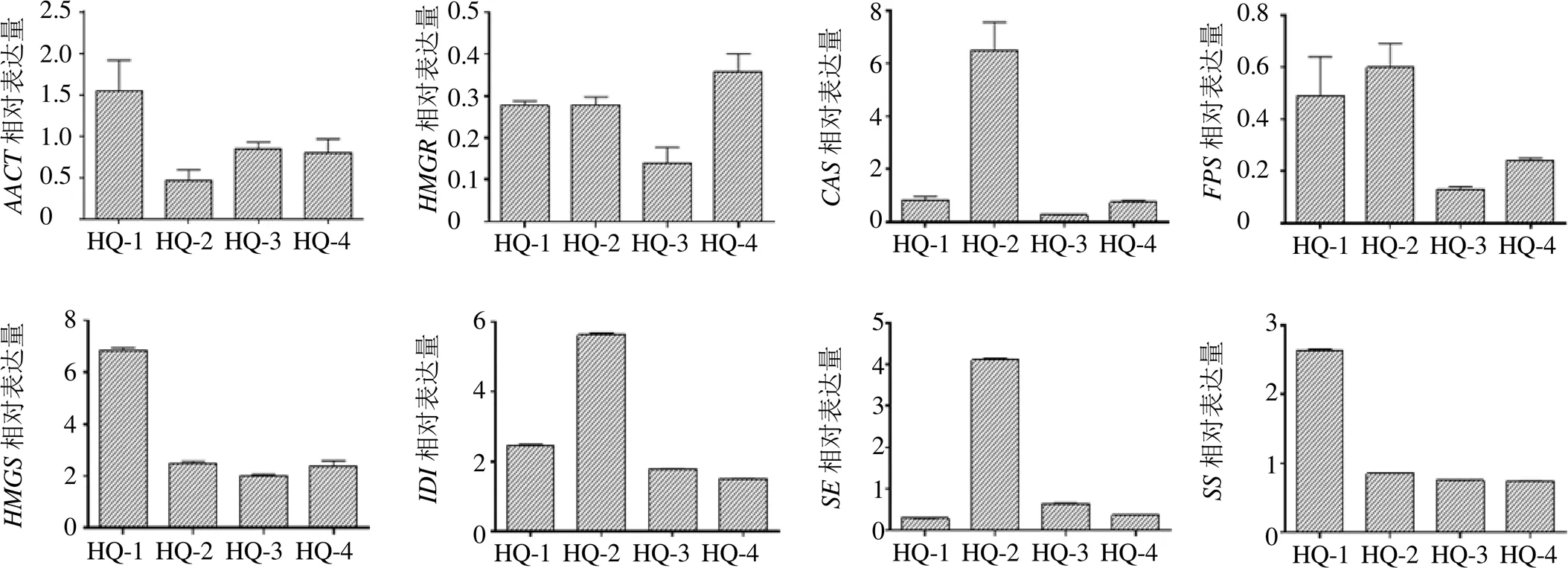
图6 不同样地黄芪根中关键酶基因荧光定量PCR表达分析
3.6 海拔高度与黄芪活性成分的相关性分析
海拔高度在1000~1732 m,黄芪总皂苷含量与海拔高度呈显著正相关(<0.05),随海拔高度的升高而增加,但海拔过高,反而不利于黄芪总皂苷的合成,在2427 m海拔时,黄芪中总皂苷含量最低;海拔高度在1056 m黄芪甲苷含量最低,其他海拔高度所采集蒙古黄芪黄芪甲苷含量差异不明显;海拔高度在1732 m毛蕊异黄酮葡萄糖苷含量最高,其他海拔高度所采集蒙古黄芪黄芪甲苷含量差异不明显。
3.7 黄芪活性成分与关键酶基因表达量的相关性分析
黄芪皂苷和关键酶基因表达量的相关性分析,见表5,、和基因与黄芪总皂苷含量呈显著正相关(<0.05),说明、和基因在黄芪总皂苷的合成过程中起主要作用;基因表达量与黄芪甲苷和黄芪中皂苷含量呈负相关,但是没有达到显著作用,说明基因对黄芪皂苷的合成具有一定的抑制作用,但是作用不明显;关键酶之间存在一定的相关性,说明关键酶之间相互协调,共同调节黄芪皂苷的合成。
3.8 海拔高度与关键酶基因表达量的相关性分析
海拔高度与和基因表达量呈极显著正相关(<0.01),与基因呈显著正相关(<0.05),与其他基因没有明显的相关性,说明、和基因表达量随着海拔的升高而增加,海拔有利于、和基因的表达。
4 讨论
药用植物次生代谢产物的合成、积累与外部环境关系密切,直接影响药用植物的质量形成[11-13]。而次生代谢产物则源自于植物体内本身的生理生化代谢活动,为了在生产中获得稳定的药材质量,需要对植物次生代谢活动的途径、规律及其影响因素进行系统研究。
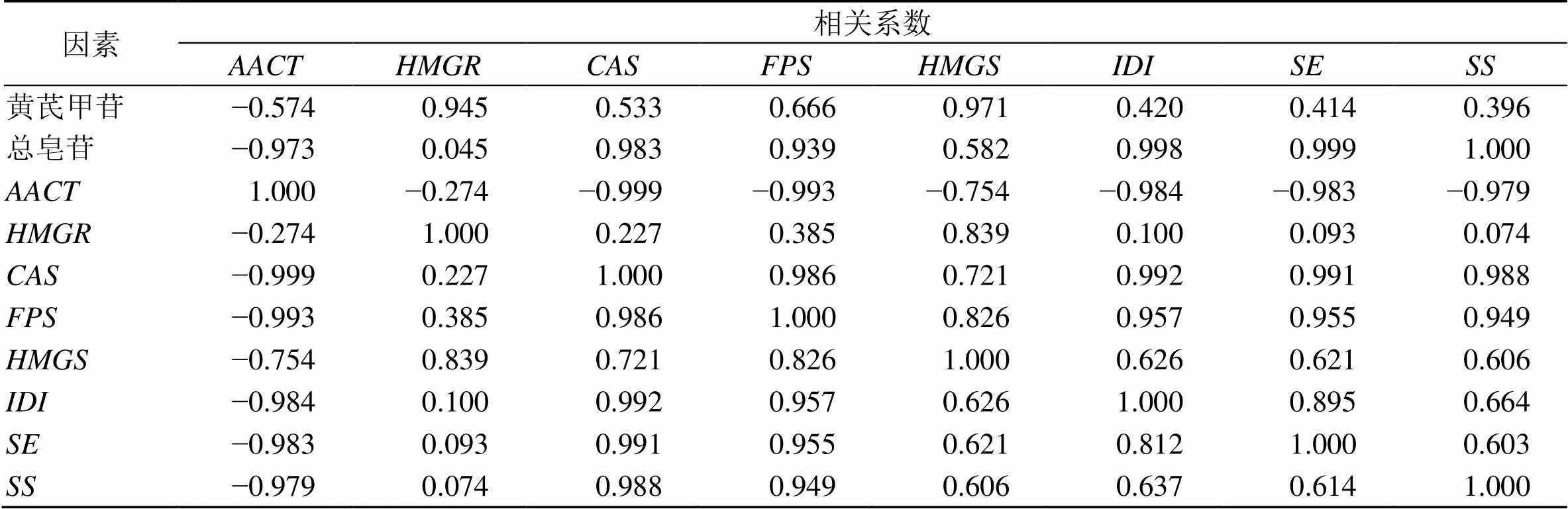
表5 黄芪皂苷与关键酶基因表达量的相关性分析
环境因子是影响药用植物活性成分的主要因素,环境因子主要包括土壤、气候、海拔等[14];本实验主要研究了海拔因子对黄芪质量的影响,胡明勋等[7]对山西恒山野生蒙古黄芪质量的环境因素研究,发现海拔对蒙古黄芪皂苷含量影响不大,本研究发现海拔高度在1000~1732 m,黄芪总皂苷含量与海拔高度呈显著正相关(<0.05),随海拔高度的升高而增加,但海拔过高,反而不利于黄芪总皂苷的合成,在2427 m海拔时,黄芪中总皂苷含量最低;海拔高度在1056 m黄芪甲苷含量最低,其他海拔高度所采集蒙古黄芪黄芪甲苷含量差异不明显;海拔高度在1732 m毛蕊异黄酮葡萄糖苷含量最高,其他海拔高度所采集蒙古黄芪黄芪甲苷含量差异不明显;内蒙古呼和浩特地区4个样地中样地HQ-2(内蒙呼和浩特可可以力更镇)中黄芪甲苷含量、毛蕊异黄酮葡萄糖苷含量及总皂苷含量普遍高于其他样地,可推断出样地HQ-2的海拔高度是最适海拔高度为1730 m左右。
中药材次生代谢产物的合成过程中关键酶基因的表达量具有主要作用,且受环境因子影响较大[15-16];本研究分别选取上游、、基因,中游、、、基因,下游基因黄芪甲苷与及海拔高度进行相关性研究,发现黄芪总皂苷与及基因均表现显著正相关,这与韦赫等[16]研究结果相似。海拔高度与、及基因均有显著关系,其中海拔高度与基因呈极显著正相关,海拔高度与基因呈显著正相关。因此,在分子层面上,阐述海拔高度有助于黄芪总皂苷积累的原因,选择高海拔高度的样地栽培黄芪能够促进、及基因的表达,从而提高蒙古黄芪中总皂苷的含量。
寻找到海拔高度与黄芪皂苷生物合成相关基因之间的联系,有望找到海拔高度影响黄芪皂苷类成分的根本原因,明确黄芪所处环境中,海拔高度对黄芪皂苷类成分合成过程中起到的重要作用。本研究针对不同海拔高度黄芪制定更加科学合理的质量标准,为实现中药材质量的可控性提供理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2015: 302-303.
[2] 段琦梅. 黄芪生物学特性研究[D]. 杨凌: 西北农林科技大学, 2005.
[3] 杨利民, 张永刚, 林红梅, 等. 中药材质量形成理论与控制技术研究进展[J]. 吉林农业大学学报, 2012, 34(2): 119-124.
[4] 朱仁斌, 宛志沪, 丁亚平. 皖西山区西洋参有效成分含量与栽培地海拔高度的关系[J]. 中草药, 2002, 33(2): 69-72.
[5] 卫昊, 郭玲玲, 李柳柳, 等. 不同海拔和光照对黄芩中7种黄酮类有效成分含量的影响[J]. 中草药, 2019, 50(6): 1472-1476.
[6] 王寅秀, 赵岩, 陈文学, 等. 海拔高度对人参多糖量的影响 [J]. 中草药, 2011, 42(4): 796-798.
[7] 胡明勋, 陈安家, 郭宝林, 等. 影响山西恒山野生蒙古黄芪质量的环境因素研究 [J]. 中草药, 2012, 43(05): 984-989.
[8] 张艳利, 杨兴鑫, 李晓妮. HPLC/UV法测定黄芪四物胶囊中黄芪甲苷含量[J]. 中国药学杂志, 2010, 19(3): 223-228.
[9] 王谦, 赖慧, 陈立, 等. 高效液相色谱法测定3种剂型黄芪中黄芪甲苷和毛蕊异黄酮葡萄糖苷含量 [J]. 中国药业, 2019, 28(6): 23-26.
[10] 杨庆珍, 王增绘, 付娟, 等. 黄芪化学成分与生态因子的相关性 [J]. 应用生态学报, 2015, 26(3): 732-738.
[11] 苏文华, 张光飞, 李秀华, 等. 植物药材次生代谢产物的积累与环境的关系 [J]. 中草药, 2005, 36(9): 139-142.
[12] Cheng L, Han M, Yang L,. Changes in the physiological characteristics and baicalin biosynthesis metabolism ofGeorgi under drought stress [J]., 2018, 122: 473-482.
[13] 林红梅. 生态因子对人参皂苷含量及其生物合成关键酶基因表达的影响 [D]. 长春: 吉林农业大学, 2016.
[14] 杨林林. 不同生长时期人参皂苷合成及其关键酶基因表达对生态因子的响应 [D]. 长春: 吉林农业大学, 2017.
[15] 张甜, 程林, 杨林林, 等. 生态因子及关键酶基因表达对秋季黄芩采收期主要药效成分合成的影响 [J]. 中草药, 2019, 50(4): 936-944.
[16] 韦赫, 程林, 吴培, 等. 黄芪皂苷生物合成对短期水分变化的响应 [J]. 中国中药杂志, 2019, 44(3): 441-447.
Study on effect of altitude on accumulation of main active components and expression of key enzyme genes of
WU Pei1, SUN Zhuo1, 2, YANG Li-min1, 2, HAN Mei1, 2
1. College of Traditional Chinese Medicine, Jilin Agricultural University, Changchun 130118, China 2. State Key Laboratory of Ecological Restoration and Ecosystem Management, Changchun 130118, China
was used as the experimental material to study the relationship between different altitude and the content of main effective components and the expression of key enzyme genes of.The content of astragaloside and genistein glucoside inroot was detected by HPLC, and the expression of key enzyme genes (AACT, HMGR, CAS, FPS, HMGs, IDI, SE, SS) in astragaloside biosynthesis was detected by qRT-PCR.The contents of astragaloside a, isoflavone glucoside, and total saponin in HQ-2 of four plots in Huhhot were higher than those in other plots. The correlation analysis showed that the altitude had a great influence on the synthesis of astragalus total saponins, and the genes of,andplayed a major role in the synthesis of astragalus total saponins. Altitude was favorable for the expression of,andgenes, and it also had a certain regulatory effect on key enzyme genes in astragaloside synthesis pathway.Plantingat an altitude of 1730 meters is beneficial to the accumulation of its active components.
(Fisch.) Bunge var.(Bge.) Hsiao.; gene expression;total saponins; altitude
R282.12
A
0253 - 2670(2021)13 - 4031 - 08
10.7501/j.issn.0253-2670.2021.13.026
2020-11-09
国家中药材产业技术体系项目(CARS-21)
吴 培,硕士研究生,主要从事生态学研究。Tel: 17390928256 E-mail: 1561485694@qq.com
孙 卓,博士,主要从事药用植物病害防治及土壤微生态。Tel: 17390901105 E-mail: 329575068@163.com
杨利民,教授,博士生导师,主要从事中药资源生态与药材质量调控。Tel: 13384309292 E-mail: ylmh777@126.com
[责任编辑 时圣明]