甜茶素在大鼠体内的代谢产物鉴定与药动学研究
姜蔓菁,蒙金英,颜夏晴,覃淑婷,李耀华,樊兰兰
甜茶素在大鼠体内的代谢产物鉴定与药动学研究
姜蔓菁,蒙金英,颜夏晴,覃淑婷,李耀华*,樊兰兰*
广西中医药大学药学院,广西 南宁 530200
对甜茶素在大鼠体内的代谢产物进行定性分析,并考察甜茶素在大鼠体内的药动学特征。SD大鼠ig甜茶素(125 mg/kg),收集不同时间段的尿液、粪便、胆汁和血浆。采用超高效液相色谱-四级杆飞行时间质谱联用技术(UPLC-Q-TOF-MS/MS)分析其在大鼠体内的代谢产物;基于超高效液相色谱串联质谱(UPLC-MS/MS)建立一种测定大鼠血浆中甜茶素含量的方法,初步研究甜茶素的药动学特征。大鼠ig甜茶素后,在尿液、粪便、胆汁和血浆中共检测并初步鉴定了1种原型成分和58种代谢物,主要代谢途径有脱氢化、羟基化、去葡萄糖基化、葡萄糖醛酸化、硫酸酯化等。甜茶素在大鼠体内的吸收较快,在0.12 h血药浓度达到最大值,半衰期为4.20 h,较大的表观分布容积提示甜茶素可能存在一定的组织分布。甜茶素在大鼠体内吸收迅速,并经历广泛的代谢反应,为进一步阐明甜茶素药效物质基础提供依据。
甜茶素;代谢产物;药动学;UPLC-Q-TOF-MS/MS;UPLC-MS/MS
甜茶素又名甜茶苷、甜叶悬钩子苷,是广西甜茶的主要甜味及活性成分,广西甜茶为蔷薇科植物甜叶悬钩子S. Lee的叶[1-3]。甜茶素是由斯替维醇和葡萄糖组成的四环二萜苷[4],具有调节糖脂代谢紊乱[5-7]、抗过敏性哮喘[8]、抗龋齿[9-10]等药理活性。甜茶素作为一种低热量的天然非糖甜味剂被广泛应用于各种食品的加工中[11-12]。因此,甜茶素在医药和食品领域具有良好的研究价值和广阔的应用前景。目前研究主要集中在甜茶素的分离纯化、含量测定和药理活性等[3,13-15],未见其体内代谢及药动学的研究报道。为了更好地了解甜茶素在生物体内的吸收、转化和排泄过程,本研究利用超高效液相色谱-四级杆飞行时间质谱联用技术(UPLC-Q-TOF-MS/MS)鉴定并推测甜茶素在大鼠尿液、粪便、胆汁和血浆中的代谢产物,同时基于超高效液相色谱串联质谱(UPLC-MS/MS)建立一种快速测定甜茶素的血浆药物浓度的方法,探究其体内药动学过程,为甜茶素的进一步研究提供依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,7~14周龄,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2016-0002。动物饲养于温度(20±2)℃、湿度40%的环境中。动物实验符合动物伦理委员会标准,伦理批准号DW20200713-003。
1.2 药品与试剂
对照品甜茶素(批号18053101)、甘草次酸(批号19011506)和甜菊醇(批号18121002)购自成都普菲德生物技术有限公司,质量分数均≥98%;乌拉坦(批号H1821067)购自上海阿拉丁生化科技股份有限公司;质谱级甲酸(批号186260)购自美国Thermo Fisher Scientific公司;色谱级甲醇、乙醇和乙腈购自西陇化工股份有限公司;超纯水为实验室自制;固相萃取小柱购自广州费尼根仪器有限公司。
1.3 仪器
Dionex Ultimate 3000 UPLC(美国Thermo Fisher Scientific公司);Bruker impact HD型Q-TOF-MS/MS(德国Bruker公司);Acquity UPLC®I Class色谱仪和Xevo TQ-XS质谱仪(美国Waters公司)。
2 方法
2.1 代谢产物的鉴定
2.1.1 色谱条件 Waters Acquity UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~10 min,10%~24% B;10~18 min,24% B;18~19 min,24%~54% B;19~21 min,54%~95% B;21~24 min,95% B;24~25 min,95%~10% B;25~28 min,10% B。体积流量为0.3 mL/min;柱温为40 ℃;进样体积为5 μL。
2.1.2 质谱条件 电喷雾离子源(ESI);负离子模式;雾化气(N2)压力为200 kPa;干燥气温度为200 ℃;气体体积流量为8.0 L/min;毛细管电压为3.5 kV;扫描范围/50~1000。
2.2 血浆药物浓度的测定
2.2.1 色谱条件 Waters Acquity UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-甲醇(B),梯度洗脱:0~0.5 min,30% B;0.5~1.0 min,30%~60% B;1.0~2.5 min,60%~90% B;2.5~5.0 min,90% B;5.0~6.5 min,90%~30% B。体积流量为0.3 mL/min;柱温为40 ℃;进样体积为5 μL。
2.2.2 质谱条件 ESI源;负离子多反应监测模式(MRM);雾化气(N2)压力为700 kPa;温度为550 ℃;体积流量为1000 L/h;毛细管电压为3.5 kV;锥孔电压为117 V;用于定量分析离子反应对为:甜茶素/641.3→317.2,碰撞能43 eV;甘草次酸/469.3→425.4,碰撞能40 eV。
2.3 溶液的配制
2.3.1 甜茶素药液的配制 精密称取适量甜茶素,溶于纯水配制成质量浓度为12.50 mg/mL的溶液。
2.3.2 对照品、内标溶液的配制 精密称取甜茶素和甘草次酸,以甲醇配制成质量浓度为16.80 mg/mL的对照品储备液和20.80 μg/mL的内标储备液。取甜茶素储备液稀释成质量浓度为6.72、5.05、3.36、1.26、0.84、0.42、0.17、0.08 μg/mL的系列对照品溶液;质控溶液高、中、低质量浓度分别为5.88、1.68、0.25 μg/mL;定量限溶液质量浓度为0.08 μg/mL。
2.4 生物样品的收集
取SD大鼠随机分为空白组、尿液粪便组、胆汁组和血浆组,每组8只,给药前禁食不禁水12 h。空白组ig纯水(10 mL/kg),其余各组ig甜茶素(125 mg/kg)[16-17]。尿液粪便组分别收集给药后0~4、4~8、8~12和12~24 h尿样和粪样,尿样记录体积,3500 r/min离心10 min后取上清液;粪样于50 ℃烘干后称定质量。胆汁组ip 20%乌拉坦(1.1 g/kg)麻醉[18],实施胆汁插管引流手术,分别收集给药后0~2、2~4、4~6、6~8、8~10、10~12、12~24 h胆汁,记录体积。血浆组ip 20%乌拉坦(1.1 g/kg)麻醉,于5、15、30 min以及1.0、1.5、2.0、3.0、4.0、6.0、8.0、12.0、24.0 h眼眶静脉采血0.5 mL,置肝素化抗凝离心管3000 r/min离心15 min取上清。空白组收集尿液、粪便、血浆和胆汁。所有样品于−20 ℃保存备用。
2.5 生物样品的处理
2.5.1 尿液、粪便的处理 将各时间段尿液样品混合后以3倍量甲醇稀释,旋蒸蒸干,以25 mL甲醇超声复溶。每克粪便以20 mL甲醇稀释,旋蒸蒸干,以10 mL甲醇超声复溶。复溶后的尿液和粪便样品4 ℃、12 000 r/min离心10 min,取上清液分析。
2.5.2 胆汁的处理 将7个时间段胆汁样品等体积混合,取1 mL加入到活化好的固相萃取小柱,依次用2 mL水和甲醇洗脱,收集甲醇洗脱液,于40 ℃氮气流吹干,以100 μL甲醇复溶,4 ℃、12 000 r/min离心10 min,取上清液分析。
2.5.3 血浆的处理 方法1:将12个时间点血浆各取50 μL混合,按“2.5.2”项下方法处理,取上清液进行UPLC-Q-TOF-MS/MS分析。方法2:取各时间点血浆20 μL,加入内标20 μL、乙腈400 μL,涡旋混匀,4 ℃、12 000 r/min离心10 min,取上清液于40 ℃氮气流吹干,以200 μL甲醇复溶,离心取上清液进行UPLC-MS/MS分析。
2.6 方法学考察
2.6.1 专属性考察 分别取空白血浆、加入对照品和内标的血浆、给药后大鼠血浆按“2.5.3”项下方法2处理后进行UPLC-MS/MS分析。
2.6.2 标准曲线和定量限 分别取20 μL空白血浆,加入“2.3.2”项下系列对照品溶液20 μL,按“2.5.3”项下方法2处理,制备分别含672.00、504.50、336.00、126.00、84.00、42.00、16.80、8.40 ng/mL甜茶素及2.08 μg/mL内标的血浆样品。以待测物和内标的峰面积比值为横坐标(),血浆中待测物的浓度为纵坐标(),用加权(W=1/x)最小二乘法进行回归运算。取定量限溶液同上述处理平行制备3份定量限样品(含8.40 ng/mL甜茶素),连续测定3 d,并随行当天标准曲线计算浓度。
2.6.3 准确度和精密度 取20 μL空白血浆和质控溶液制备质量浓度分别为25.20、168.00、588.00 ng/mL的低、中、高浓度质控样品,各浓度平行6份,连续测定3 d,计算准确度与精密度。
2.6.4 回收率和基质效应 取20 μL空白血浆和低、中、高浓度质控溶液,按“2.5.3”项下方法2制备低、中、高浓度质控样品(A);空白血浆按“2.5.3”项下方法2处理(不加内标),再加入内标、质控溶液各20 μL,甲醇200 μL,离心取上清液(B);以甲醇制备与上述质控样品等浓度的工作液(C)。以相同质量浓度A与B溶液的峰面积比值计算提取回收率;以B与C溶液的峰面积比值计算基质效应。
2.6.5 稳定性试验 取20 μL空白血浆和质控溶液制备低、中、高浓度质控样品,每个浓度平行制备6份,分别于室温放置12 h、−20 ℃至室温反复冻融3次、−80 ℃放置20 d后进样分析,每次测定随行标准曲线。
3 结果
3.1 甜茶素对照品的质谱裂解途径分析
甜茶素的[M-H]−离子/641.317 2,同时存在[M+HCOO]−离子/687.323 0(图1-A)以及特征碎片离子/479.264 6 [M-H-C6H10O5]−、317.211 1 [M-H-2C6H10O5]−(苷元甜菊醇),/317.211 1继续失去H2O、-COOH产生碎片离子/273.222 1,255.209 9(图1-B),推测的裂解途径见图2。
3.2 甜茶素在大鼠体内代谢产物的结构分析
运用Metabolite Predict 2.0结合常规I相、II相代谢反应规律预测甜茶素可能的代谢产物,基于UPLC-QTOF-MS分析给药后大鼠尿液、粪便、血浆和胆汁样品。通过对比保留时间(R)和多级质谱信息,共鉴定和推测了1种原型成分和58种代谢物。各生物样品的总离子流图见图3,由于胆汁中杂质较多,以提取离子流图代替,代谢物信息见表1。
尿液、粪便、胆汁和血浆样品的R为20.3 min时,均检测L0准分子离子峰/641 [M-H]−以及特征碎片离子/479 [M-H-C6H10O5]−、317 [M-H-2C6H10O5]−,与甜茶素对照品一致,以此鉴定L0为甜茶素。L1-1/L1-2的准分子离子峰为/639 [M-H]−,较L0少2,产生碎片离子/479、317、273,推测L0葡萄糖基上的羟基发生了脱氢化反应。L2-1/L2-2、L3准分子离子峰/657 [M-H]−均较L0多16,产生碎片离子/495 [M-H-C6H10O5]−、333 [M-H-2C6H10O5]−。L3二级质谱中检测到/629,比[M-H]−离子少28 [C≡O]−,为环氧乙烷开环特征碎片,环氧化位点推测是L0的C16位双键[19],L2-1/L2-2无此碎片,推测为L0羟基化产物,羟基化位点推测为母核的-CH2。L4准分子离子峰[M-H]−为/789,较L0多148(C5H8O5),碎片离子/641、627、479、317,推测为L0葡萄糖基上的-OH与五碳糖结合的糖基化产物,但无法确定糖基构型及连接位点。L5-1/L5-2准分子离子峰[M-H]−为/817,较L0多176(C6H8O6),推测为L0的葡萄糖醛酸化产物。L6-1/6-2准分子离子峰/479 [M-H]−,与L0特征碎片一致,推测为L0的去葡萄糖基化产物。L7-1/L7-2准分子离子峰/721 [M-H]−,较L0多80,推测由L0葡萄糖基上的羟基发生硫酸酯化反应得到。L8~L25的代谢产物中,大部分由上述同种或两种I相、II相代谢反应结合得到。其中,L12准分子离子峰/675 [M-H]−,较L3多18,失去葡萄糖产生碎片离子/513、351,推测L12为L3的C16位连接的环氧乙烷基发生开环反应得到[19]。L17和L21的准分子离子峰[M-H]−分别为/874、536,分别较L6和L5多57,推测为L6的C18位上和L5葡萄糖醛酸基上的-COOH与甘氨酸结合的产物。同理,推测L22为L6的谷氨酸化产物。
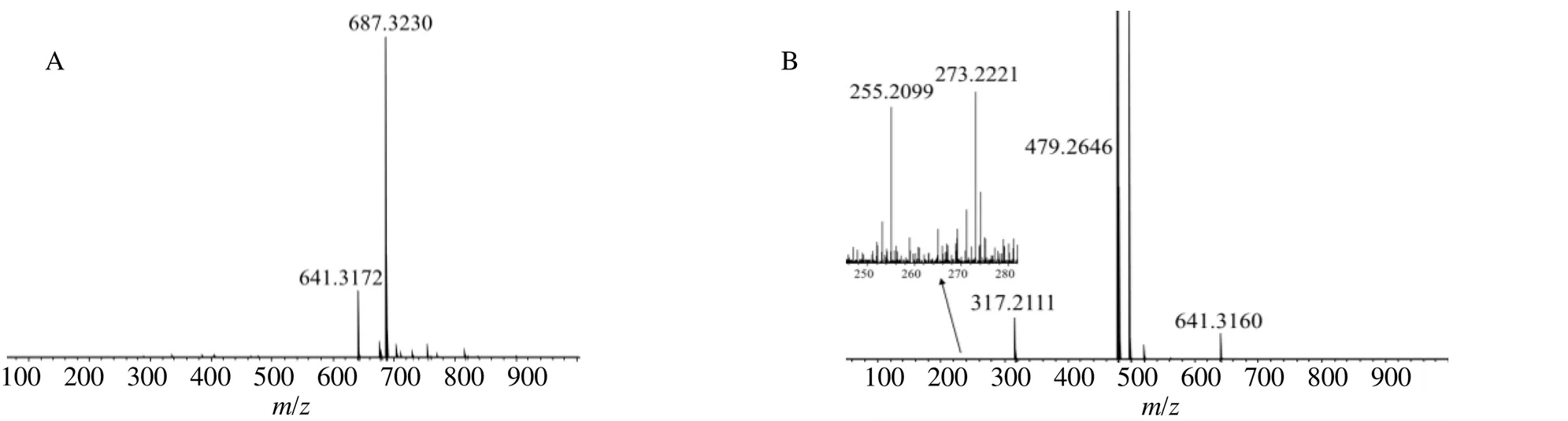
图1 负离子模式下甜茶素的一级质谱图(A) 和二级质谱图 (B)
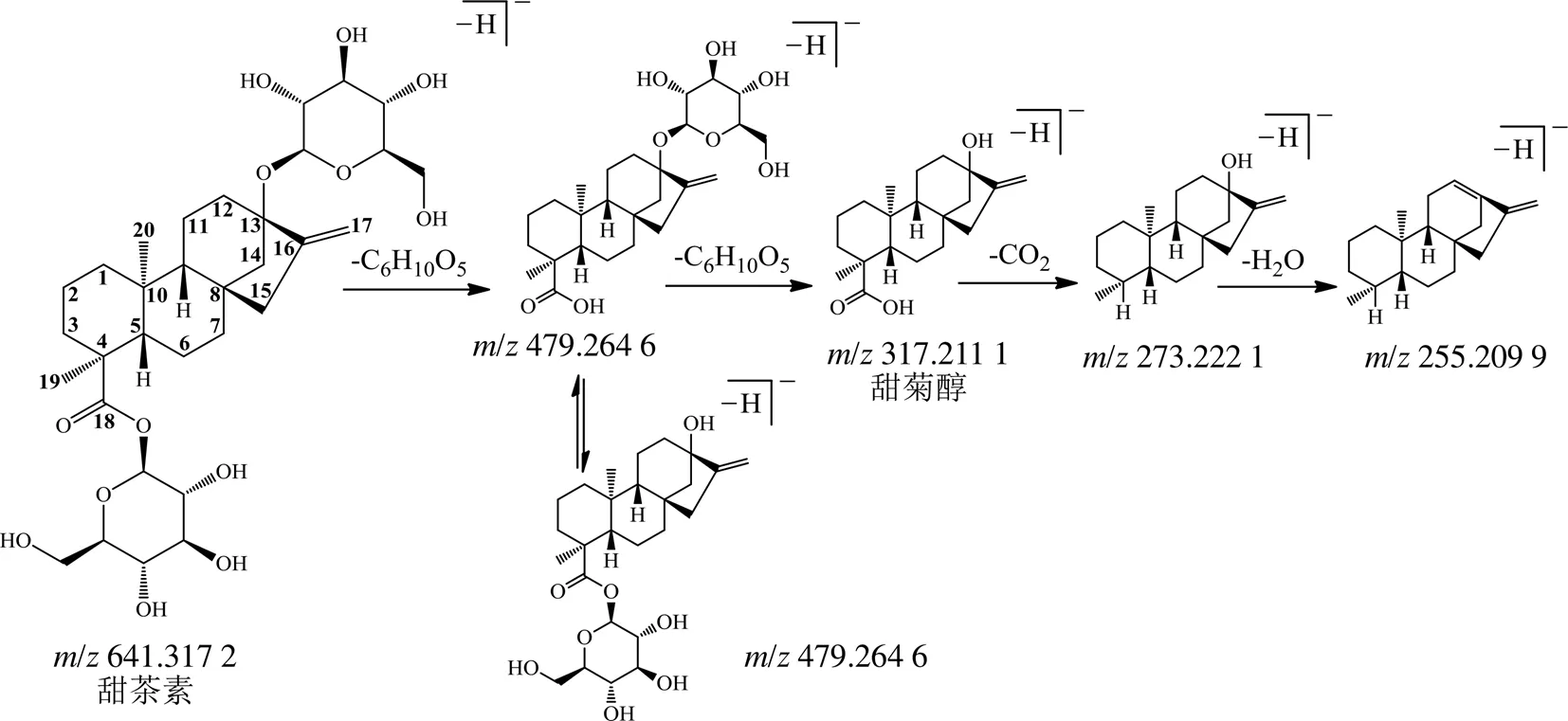
图2 甜茶素可能的裂解途径
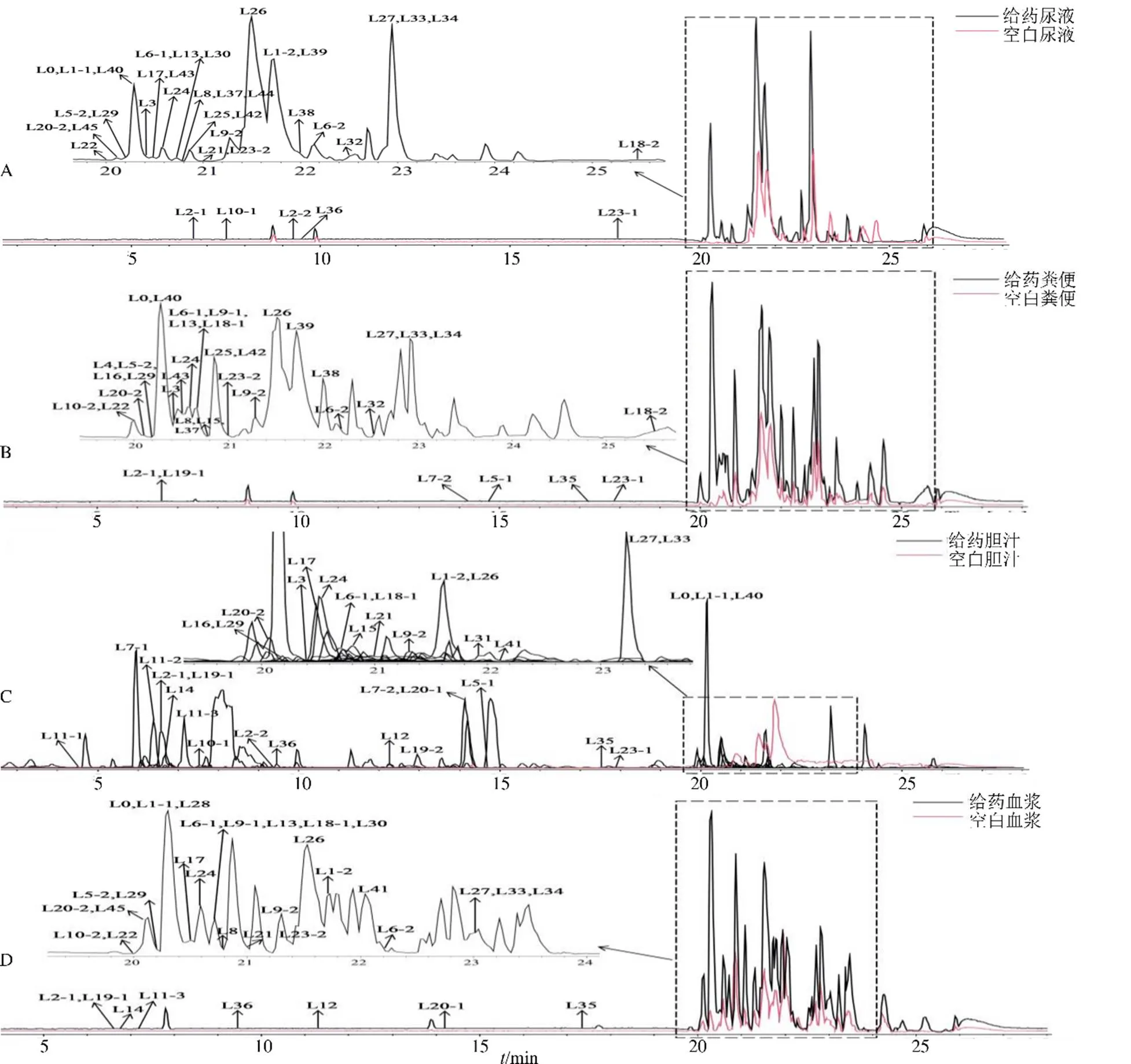
图3 大鼠ig甜茶素后尿液(A)、粪便 (B)、胆汁(C) 和血浆 (D) 样品总离子流图或提取离子流图
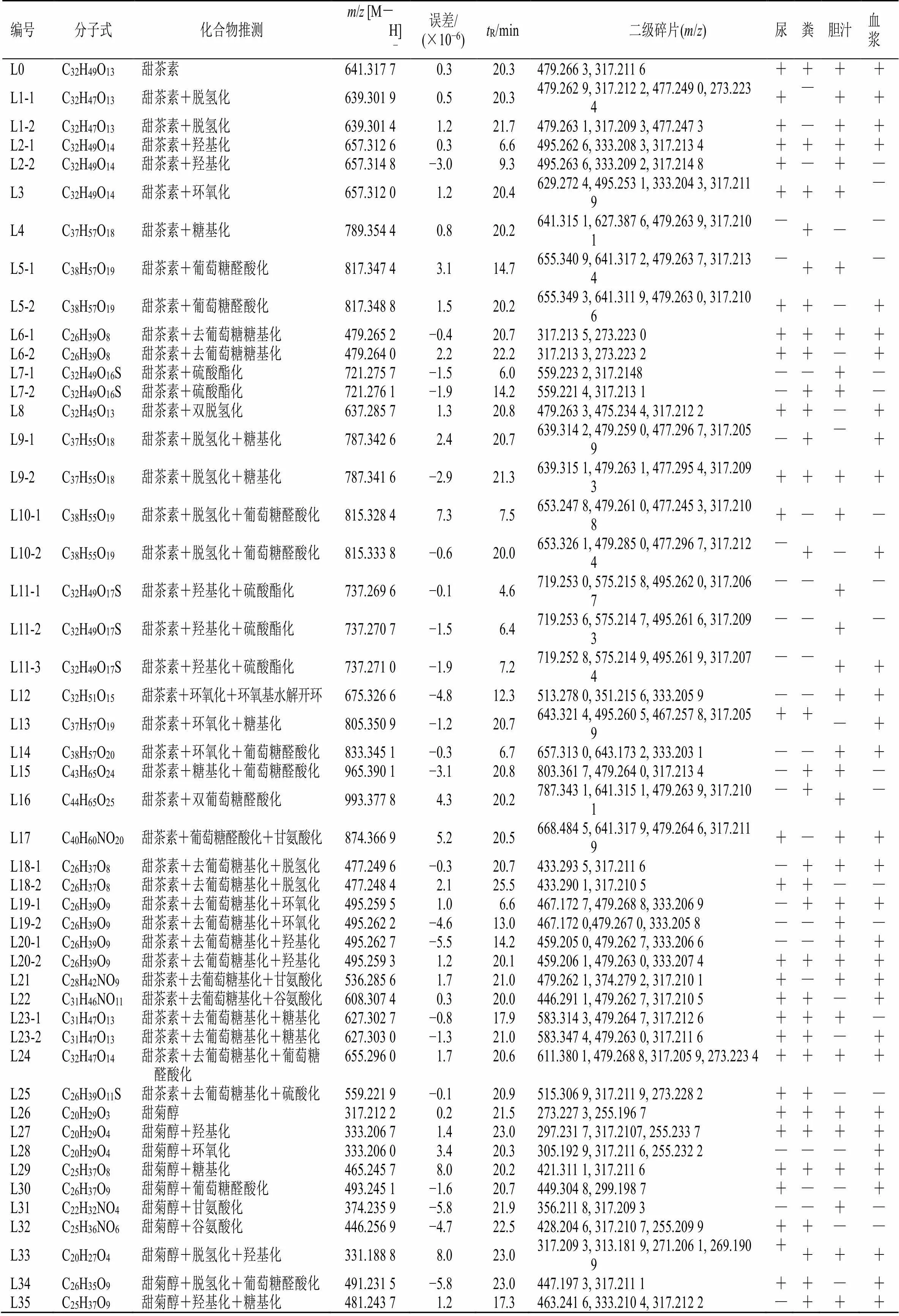
表1 甜茶素在大鼠体内代谢物的鉴定
“+”表示检测到;“-”表示未检测到
“+” means detected; “—” means not detected
尿液、粪便、胆汁和血浆样品的R为21.5 min处均检测到L26准分子离子峰为/317 [M-H]−,其二级碎片特征与甜菊醇对照品一致,故鉴定为甜菊醇。根据甜茶素对照品的裂解规律,推测L26由L0在大鼠体内发生糖苷键水解而得到。L27、L28准分子离子峰均为/333 [M-H]−,较L26多了16,与L12和L13类似,L28存在环氧乙烷开环特征碎片离子/305 [M-H-CO]−,L27无此碎片,推测L27和L28分别为L26的羟基化产物和环氧化产物[19-21]。L29、L30、L31和L32的准分子离子峰[M-H]−分别较L26多148、176、57、129,根据二级碎片信息,分别推测为L26的C13位羟基糖基化和葡萄糖醛酸化产物、C18位的羧基甘氨酸化和谷氨酸化产物。L33~L45由以上同种或2种I相、II相代谢反应结合而得到。
3.3 甜茶素在大鼠体内的代谢产物信息总结
本研究检测和鉴定了甜茶素在大鼠体内的1种原型、20种I相和38种II相代谢产物,其中尿液38个、粪便38个、胆汁37个、血浆35个。I相代谢包括脱氢化、羟基化、环氧化和去葡萄糖基化等,II相代谢包括糖基结合、葡萄糖醛酸结合、硫酸化、谷氨酸结合和甘氨酸结合等。甜茶素中的代谢反应位点主要有母核的-CH2、-OH、C=C及葡萄糖基上的-OH。羟基化反应主要发生在母核环上的几个-CH2,C16位的双键是环氧化和开环反应发生的位点。脱氢化和II相代谢反应中的各种结合反应主要发生于葡萄糖上的-OH或糖基水解后苷元暴露出的-OH。由于质谱提供的信息有限,许多代谢反应无法确定具体位点。另外,糖基化产物如L4等所结合的糖基均推测为五碳糖(C5H8O5),而非较常见的葡萄糖基结合,但未能确定构型,初步推断其反应发生位点在-OH上。
比较各化合物峰面积,尿液中主要检测到L27(甜菊醇+羟基化产物)和一部分L0(原型)、L26(甜菊醇);粪便中主要检测到L0、L26和L27。胆汁中检测到的各代谢物含量较低,以L0的硫酸酯化产物(L7-1)、羟基化+硫酸酯化产物(L11-2/L11-3)、L26的环氧化+谷氨酸产物(L40)为主,只检测到了少量的L0和L26;血浆中主要检测到了L0、L26及L26的葡萄糖醛酸化产物(L30)、脱氢化+羟基化产物(L33)。结果表明甜茶素在大鼠体内能够直接以原型被吸收,经历的主要代谢途径有糖苷键水解(去葡萄糖基化)产生苷元甜菊醇,苷元的脱氢化、羟基化、葡萄糖醛酸化、环氧化和谷氨酸化,以及原型直接发生羟基化和硫酸酯化反应。甜茶素在大鼠体内大部分以原型、苷元和苷元的羟基化产物经尿液或粪便排泄,但主要排泄途径为粪便。
3.4 方法学考察
3.4.1 专属性试验 空白血浆、加入对照品工作液和内标的空白血浆、给药后大鼠血浆样品色谱图见图4。表明在该实验条件下,甜茶素与内标可以得到较好分离,血浆中的内源性物质不会影响甜茶素和内标的测定,该方法专属性良好。
3.4.2 标准曲线和定量限 标准曲线回归方程为=1 408.4-14.873(2=0.996 6),表明甜茶素在8.40~672.00 ng/mL线性关系良好,定量限血浆样品日间精密度为0.90%。
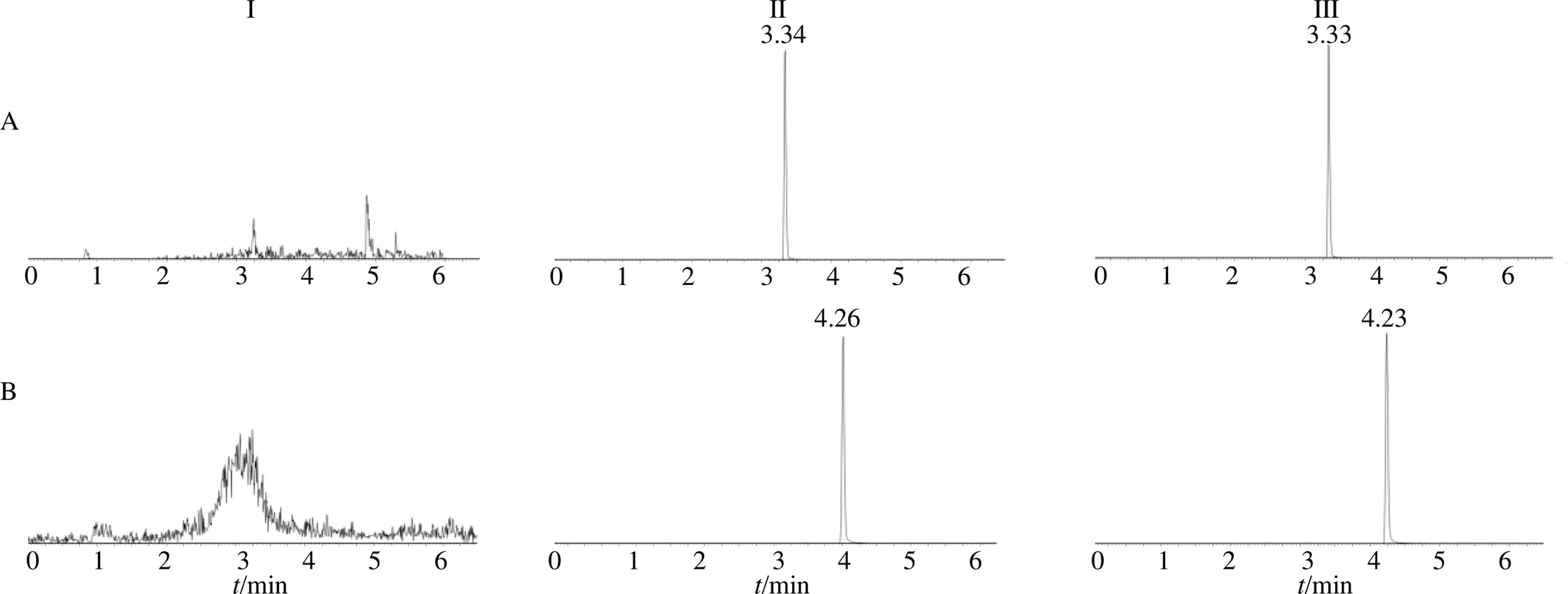
I-空白血浆样品 II-空白血浆+待测物(168 ng/mL甜茶素)和内标(2.08 μg/mL甘草次酸)样品 III-给药后30 min的血浆样品
3.4.3 精密度和准确度 如表2所示,甜茶素各浓度质控样品日内和日间精密度的RSD为2.51%~10.51%,准确度为−1.78%~4.81%,表明该方法精密度和准确度良好。
3.4.4 回收率和基质效应 基质效应考察中,甜茶素各浓度样品基质效应为88.63%~98.57%,RSD在11.08%以下;回收率为90.18%~95.41%,RSD在6.68%以下。表明该条件下,基质几乎不干扰待测物的测定,且对待测物具有足够的提取回收率。

表2 甜茶素质控样品的日内、日间精密度和准确度
3.4.5 稳定性试验 3个浓度质控样品于室温放置12 h后的准确度为−5.87%~3.14%;于−20 ℃反复冻融3次的准确度为 −8.03%~5.21%;于−80 ℃存放20 d后,准确度为0.90%~3.34%,表明血浆样品稳定性良好。
3.5 甜茶素在大鼠体内的药动学研究
按“2.5.3”项下方法2处理血浆样品,每次检测随行标准曲线和质控样品。采用Phoenix WinNonlin 8.1药动学软件计算大鼠血浆中的药动学参数,结果见表3,药-时曲线见图5。大鼠ig甜茶素(125 mg/kg)后,吸收较快,达峰时间(max)为(0.12±0.08)h,达峰浓度(max)为(2 196.13±472.36)ng/mL,消除半衰期(1/2)为(4.20±1.38)h。同时,表观分布容积大,提示甜茶素可能具有较大程度的组织分布。
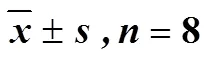
表3 大鼠ig甜茶素后的药动学参数()
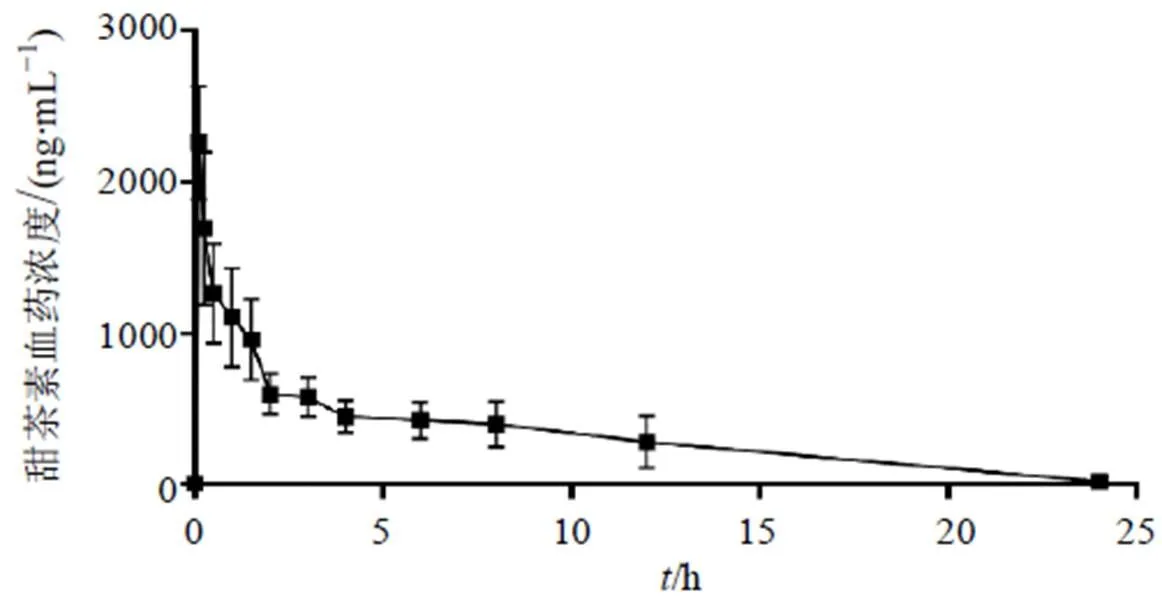
图5 大鼠ig甜茶素后在体内的平均血药浓度-时间曲线()
4 讨论
本研究分析了ig甜茶素后大鼠的尿液、粪便、胆汁和血浆中的代谢产物,发现各生物样品在ESI负离子模式下响应优于正离子模式,因此选用负离子模式检测代谢产物。在对样品处理方法进行考察时,发现胆汁和血浆样品经固相萃取小柱预处理后进样时可以较大程度地减少杂质干扰,用乙腈代替甲醇沉淀蛋白质可以消除内源性杂质对甜茶素血药浓度测定的干扰。在测定血药浓度时,一级质谱中除了准分子离子峰[M-H]−外,还可观察到[M+HCOO]−的加合离子。
甜茶素在大鼠体内经历了广泛的I相和II相代谢反应,以脱氢化、羟基化、去葡萄糖基化、葡萄糖醛酸化等为主。此前已有不少关于甜菊醇及其苷类代谢和药动学研究的报道。Koyama等[19]研究甜叶菊提取物(主要含rebaudioside A、rebaudioside C、甜菊苷等)及甜菊醇在大鼠体内和体外肝微粒体的生物转化及药动学,发现甜菊醇能够被快速吸收,而以甜菊醇为苷元的苷类较难被直接吸收,主要被肠道菌群降解为苷元才能重新被小肠吸收。Roberts等[22]的研究中也得到了类似的结果,且发现大鼠胆汁中大部分甜菊醇会与葡萄糖醛酸结合,但粪便中主要以原型排泄,表明在经粪便排泄前葡萄糖醛酸基又会被水解而释放出原型。本研究中,甜茶素虽与上述苷类结构类似,但经大鼠口服后能够快速以原型被吸收,推测是由于甜茶素结构中糖基数量较上述苷类少。大鼠尿液和粪便中主要检测到甜茶素原型、苷元和苷元的羟基化产物,极少或未检测到葡萄糖醛酸化、硫酸酯化和环氧化等结合型代谢产物,推测这些产物在排泄前可能被降解而失去结合基团,更容易进入尿液或粪便。另外,葡萄糖醛酸结合反应主要发生在肝脏,产物主要经胆汁排泄,本研究中的葡萄糖醛酸结合产物主要在血浆中被检测到,并且该基团大部分与苷元甜菊醇结合,与Geuns等[23]的甜菊苷体内代谢研究结果相似,推测甜茶素在大鼠体内产生的葡萄糖醛酸结合产物会经胆汁排泄至胃肠道,重新进入血液循环。
药动学结果表明,甜茶素在大鼠体内能够被迅速吸收,表观分布容积较大,提示其可能存在较大程度的组织分布,课题组前期在ig甜茶素的大鼠心、肝、脾、肺、肾、脑组织中均检测到甜茶素,但还有待深入研究。本研究在大鼠胆汁中主要检测到一些结合型代谢产物,尿液和粪便中主要检测到甜茶素原型、苷元和羟基化产物,对比峰面积,粪便中的原型、苷元和苷元的羟基化产物含量较高,但排泄速率和累积排泄量还有待进一步研究,甜茶素中苷元甜菊醇的药动学过程也有待深入探究。
综上,本研究利用UPLC-Q-TOF-MS方法对大鼠ig甜茶素后的尿液、粪便、胆汁及血浆样品进行分析,共鉴定出1种原型成分和58种代谢物,涉及广泛的I相和II相代谢反应。甜茶素在大鼠体内能够直接以原型被吸收,经历的主要代谢途径有脱氢化、羟基化、环氧化、去糖基化、葡萄糖醛酸结合、硫酸酯化等。甜茶素大部分以原型、苷元和苷元的羟基化产物经尿液和粪便排泄,主要排泄途径为粪便。本研究还建立了基于UPLC-MS/MS测定大鼠血浆中甜茶素的方法,并以该方法初步研究甜茶素在大鼠体内的药动学过程,发现甜茶素能够被快速吸收,为甜茶素的体内转化过程和药理作用提供依据,为其开发利用提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 李树刚. 甜茶, 悬钩子属一新种 [J]. 广西植物, 1981, 1(4): 17-19.
[2] 广西壮族自治区食品药品监督管理局. 广西壮族自治区壮药质量标准(第2卷)[M]. 2011年版. 南宁: 广西科学技术出版社, 2011: 344-345.
[3] Editorial Committee of Flora of China, Chinese Academy of Sciences.(Vol.9) [M]. Beijing: Science Press, 2003: 88b.
[4] 闫志刚, 蒙淑洁, 韦荣昌, 等. 广西甜茶研究与应用现状 [J]. 中草药, 2017, 48(12): 2572-2578.
[5] Zhang H, Qi R L, Zeng Y H,. Chinese sweet leaf tea () mitigates LPS-induced low-grade chronic inflammation and reduces the risk of metabolic disorders in a C57BL/6J mouse model [J]., 2020, 68(1): 138-146.
[6] 田翠平, 瞿伟菁, 孙斌, 等. 甜茶素提取物对STZ致高血糖大鼠的降血糖作用研究 [J]. 营养学报, 2003, 25(1): 29-33.
[7] Li L, Jiang M J, Li Y H,.1H-NMR metabolomics analysis of the effect of rubusoside on serum metabolites of golden hamsters on a high-fat diet [J]., 2020, 25(6): E1274.
[8] Wang C Q, Tang J, Qian B,. Rubusoside alleviates the ovalbumin-induced mice allergic asthma by modulating the NF-κB activation [J]., 2020, 44(5): e13187.
[9] Kim J, Nguyen T T H, Jin J H,. Anti-cariogenic characteristics of rubusoside [J]., 2019, 24(2): 282-287.
[10] Guan C R, Che F A, Zhou H X,. Effect of rubusoside, a natural sucrose substitute, onbiofilm cariogenic potential and virulence gene expression[J]., 2020, 86(16): e01012-e01020.
[11] 何伟平. 天然甜味剂—甜茶甙的工业化试验 [J]. 广西轻工业, 1999, 15(1): 3-5.
[12] 林继元, 饶力群. 甜茶酸奶的研制 [J]. 食品与机械, 2006, 22(5): 106-108.
[13] 王立波, 毕彩虹. 甜茶活性成分最新研究进展 [J]. 粮食与油脂, 2007, 20(2): 47-49.
[14] 叶琴, 杨洋, 袁经权. 正交实验设计法优化超声复合酶提取甜茶苷工艺 [J]. 食品工业科技, 2017, 38(20): 216-220.
[15] 樊兰兰, 韦玮, 何丽丽, 等. 广西甜茶制剂中甜茶素含量的RSLC-DAD测定 [J]. 时珍国医国药, 2012, 23(1): 129-131.
[16] 廖曼云, 覃国忠. 甜茶的毒理学实验研究 [J]. 广西植物, 1985, 5(1): 43-49.
[17] 梁坚, 赵鹏, 李彬, 等. 甜茶的急性和长期毒性研究 [J]. 广西医学, 2003, 25(12): 2394-2397.
[18] 樊慧蓉, 李全胜, 张爱杰, 等. 柚皮素在大鼠体内的代谢途径研究 [J]. 中草药, 2017, 48(10): 2093-2099.
[19] Koyama E, Sakai N, Ohori Y,. Absorption and metabolism of glycosidic sweeteners of stevia mixture and their aglycone, steviol, in rats and humans [J]., 2003, 41(6): 875-883.
[20] 陈俊名. 甜菊糖苷的体外代谢及生物活性研究 [D]. 无锡: 江南大学, 2019.
[21] Wheeler A, Boileau A C, Winkler P C,. Pharmacokinetics of rebaudioside A and stevioside after single oral doses in healthy men [J]., 2008, 46(Suppl 7): S54-S60.
[22] Roberts A, Renwick A G. Comparative toxicokinetics and metabolism of rebaudioside A, stevioside, and steviol in rats [J]., 2008, 46(Suppl 7): S31-S39.
[23] Geuns J M, Buyse J, Vankeirsbilck A,. Metabolism of stevioside by healthy subjects [J]., 2007, 232(1): 164-173.
Identification of metabolites and pharmacokinetic study of rubusoside in rats
JIANG Man-jing, MENG Jin-ying, YAN Xia-qing, QIN Shu-ting, LI Yao-hua, FAN Lan-lan
School of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530200, China
To identify the metabolites and study the pharmacokinetic characteristics of rubusoside in rats.SD rats were ig rubusoside (125 mg/kg), metabolites in their urine, feces, bile and plasma collected at different time periods were identified by ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-QTOF-MS/MS). A UPLC-MS/MS method was developed and validated for determination of rubusoside in rat plasma. The pharmacokinetic characteristics of rubusoside in rats were investigated.One prototype component and 58 metabolites were detected. The main metabolic pathways of rubusoside were dehydrogenation, hydroxylation, deglucosylation, glucuronic acid conjugation, sulfation, etc. Rubusoside was absorbed rapidly into the blood after intragastric administration. Maximum concentration (max) and the half-life (1/2) of rubusoside were 0.12 h and 4.20 h, respectively. Meanwhile, the large apparent volume of distribution indicated possible tissue distribution of rubusoside.Rubusoside was absorbed fast and experienced extensive metabolismin rats, which provide a reference for further investigation on therapeutic material basis of rubusoside.
rubusoside; metabolites; pharmacokinetics; UPLC-Q-TOF-MS/MS; UPLC-MS/MS
R285.61
A
0253 - 2670(2021)13 - 3914 - 09
10.7501/j.issn.0253-2670.2021.13.015
2020-12-31
国家自然科学基金资助项目(31660095);国家自然科学基金资助项目(81903918);广西自然科学基金资助项目(2019JJA140644);广西中医药大学一流学科项目(2019XK117);广西中医药大学研究生创新项目(YCSZ2020011,YCSZ20190028)[1]
姜蔓菁(1997—),女,硕士研究生,主要从事中药民族药物质基础研究。
樊兰兰(1980—),研究员,硕士生导师,主要从事中药民族药质量控制研究。Tel: (0771)4953513 Email: fanll2015@gxtcmu.edu.cn
李耀华(1978—),高级实验师,硕士生导师,主要从事中药质量控制研究。Tel: (0771)4953513 E-mail: liyh2001@gxtcmu.edu.cn
[责任编辑 李亚楠]