UHPLC-Q-TOF/MS鉴定大鼠体内隐绿原酸的代谢产物
李 芳,李 洁,王喻淇,董 凡,陶雨凡,王少平,张加余*
UHPLC-Q-TOF/MS鉴定大鼠体内隐绿原酸的代谢产物
李 芳1,李 洁2,王喻淇2,董 凡2,陶雨凡3,王少平3,张加余3*
1. 北京市丰台区妇幼保健院 药剂科,北京 100069 2. 北京中医药大学中药学院,北京 102488 3. 滨州医学院药学院,山东 烟台 264003
定性分析隐绿原酸在大鼠血浆、尿液和粪便中的代谢产物。大鼠给予隐绿原酸后,采集血液、尿液和粪便并进行样品处理,采用UHPLC-Q-TOF/MS法检测各生物样品中的代谢产物。通过相应的色谱保留行为、精确相对分子质量、特征碎片离子、质谱裂解规律、文献报道以及对照品比对,最终分析鉴定了47个代谢产物。其主要体内代谢途径为水解反应、异构化反应、甲基化、氢化、葡萄糖醛酸化以及它们的复合反应。UHPLC-Q-TOF/MS法能较全面地鉴定隐绿原酸在大鼠体内的代谢产物,有助于进一步阐明隐绿原酸的药效学物质基础。
隐绿原酸;大鼠;UHPLC-Q-TOF MS;代谢产物鉴定;生物样品
绿原酸类化合物(chlorogenic acids,CGAs)一般是指1个或多个有机酸(如咖啡酸、肉桂酸、阿魏酸、芥子酸与奎宁酸或其衍生物莽草酸、奎宁酸甲酯或丁酯、4-去氧奎宁酸)缩合形成的酯。很多中药材及其复方制剂均富含绿原酸(5--咖啡酰奎尼酸)、隐绿原酸(4--咖啡酰奎尼酸)和新绿原酸(3--咖啡酰奎尼酸)等绿原酸类成分[1-3]。近年来,它们凭借着显著的抗炎、抗菌和抗病毒药理活性而广受关注[4-6]。
中药体内代谢以及药动学研究是阐明中药复杂体系作用模式的重要途径,也是中药现代化研究的难点和重点。很多临床有效的中药,进入人体发挥药效的物质基础及其体内过程尚不明确,严重影响了中医药的现代化进程。作为中药物质基础基本单元的单体成分,其体内代谢过程的阐明对于中药起效物质基础和作用靶点等重要科学问题的揭示具有重要意义。目前,绿原酸的体内吸收代谢过程已相对清晰[7-11],而绿原酸的同分异构体之一——隐绿原酸的体内分布代谢研究却未见报道。本研究利用超高效液相色谱-四极杆飞行时间质谱(UHPLC-Q- TOF/MS)系统分析了隐绿原酸在大鼠体内(血浆、尿液及粪便)的代谢产物及代谢途径,以期全面地反映隐绿原酸在生物体内的药效物质基础,并为其后续的临床研究提供依据。
1 材料
1.1 药品与主要试剂
隐绿原酸(批号PRF8010501)、新绿原酸(批号PRF8050442)、奎尼酸(批号PRF8060823)和咖啡酸(批号PRF7102044)均购自成都普瑞法科技开发有限公司;绿原酸(批号110753-200413)和阿魏酸(批号110773-201313)购于中国食品药品检定研究院;所有对照品经HPLC-UV检测质量分数均大于98%。甲酸(色谱级,德国Merck公司),乙腈和甲醇(质谱级,美国Thermo Fisher公司)。SPE Cartridges C18固相萃取小柱(500 mg/3 mL,Grace PureTM公司)。
1.2 仪器
Exion LCTMAC液相色谱仪与X500R QTOF质谱,配有双喷雾Turbo V离子源,SCIEX OS 1.3工作站(AB SCIEX公司);R200D型电子分析天平(十万分之一,德国Sartorius公司);Millipore Synergy UV型超纯水机(美国Millipore公司);KQ-250 DE型数控超声波清洗器(昆山市超声仪器有限公司)。
1.3 动物
SD大鼠,雄性,体质量(200±10)g,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。动物实验经北京中医药大学动物实验中心审查批准(伦理审查号Bucm-4-2018062602-3039)。
2 方法
2.1 混合对照品溶液的制备
分别精密称取上述6个对照品适量,加甲醇制成质量浓度为100 μg/mL的储备液。吸取各对照品储备液100 μL,最终加甲醇定容至1 mL,制成质量浓度约为10 μg/mL的混合对照品溶液,备用。
2.2 色谱条件
Waters HSS T3 UPLC色谱柱(100 mm×2.1 mm,1.7 μm);流动相:乙腈(A)-0.1%甲酸水溶液(B);洗脱梯度:0~6 min,2%~10% A;6~10 min,10%~25% A;10~15 min,25%~35% A;15~16 min,35%~40% A;16~20 min,40%~80% A;20~21 min,80%~95% A;21~24 min,95% A;柱温40 ℃;体积流量0.3 mL/min;进样量5 μL。
2.3 质谱条件
HESI负离子模式,离子源温度550 ℃,电离源电压4.5 kV,鞘气和辅助气均为高纯氮气(纯度>99.99%),鞘气体积流量35 arb,扫描模式:Full MS/dd-MS2;数据依赖性ddMS2采集,Full MS分辨率70 000,dd-MS2分辨率17 500,高分辨扫描范围/100~1000,碰撞能为30 eV。
2.4 给药样品的制备
称取隐绿原酸200 mg,加入8 mL生理盐水,超声至充分混悬,配制成质量浓度为25 mg/mL的给药溶液,用前保存于4 ℃冰箱中。
2.5 动物实验与生物样品采集
8只SD大鼠(随机分组,空白组和给药组各4只),饲养于温度为22~26 ℃、湿度为40%~70%、12 h昼夜更替的SPF级动物室内。实验前适应性喂养7 d,受试前禁食12 h,全程不禁水。给药组ig给予隐绿原酸药液200 mg/kg,空白组ig给予等量的生理盐水。空白组和给药组大鼠分别于ig后0.5、1、2、4 h时间点眼眶取血0.5 mL,置于肝素钠抗凝EP管中,混合均匀,3500 r/min离心10 min,分别合并4个时间点的血浆,即得空白血浆和含药血浆,于−80 ℃冰箱保存,备用。
空白组和给药组ig给药后24 h内,每隔6 h收集一次尿液和粪便,分别合并。空白组和给药组尿液4000 r/min离心10 min,取上清液于−80 ℃冰箱中保存;空白组和给药组粪便样品分别晾干后碾碎,置于−80 ℃冰箱中冻存。
2.6 生物样品的处理
取固相萃取柱,依次用3 mL甲醇和3 mL水对其进行活化。分别吸取室温下解冻的空白组和给药组的血浆和尿液生物样品2 mL上样,依次用3 mL水和3 mL甲醇洗脱,收集甲醇洗脱液,分别制备空白组和给药组的血浆和尿液样品;取空白组和给药组粪便样品适量,按照1∶5比例加入去离子水,超声处理60 min,3500 r/min离心10 min,取上清液加到预处理好的固相萃取小柱,用3 mL水冲洗杂质,再用3 mL甲醇洗脱,收集甲醇洗脱液,分别制备空白组和给药组的粪便样品。
将上述所有甲醇洗脱液,在常温下用N2吹干,残渣用初始流动相定容至100 μL,涡旋3 min后,再14 000 r/min离心15 min。取上清液,注入UHPLC-Q-TOF-MS进行分析。
3 结果
3.1 高分辨质谱数据的预处理
所有数据采集和处理均在SCIEX OS 1.3.1工作站进行。基于药物的代谢产物通常具有相同或者相似的母核结构,可采用数据采集的质量亏损过滤(MDF)软件进行筛选追踪主要的代谢产物。基于母药隐绿原酸的化学结构,设置了如下MDF模板:母药隐绿原酸(/353.086 7)及其核心结构咖啡酸和奎宁酸(/179.033 9、/191.055 0);隐绿原酸谷胱甘肽结合产物(/660.171 5)、糖基化产物(/515.140 4)、葡萄糖醛酸结合产物(/529.119 9)和磺酸化产物(/433.043 5)等。MDF窗口设置为±0.05。
根据精确相对分子质量、元素组成和可能发生的反应,对所有的母离子和碎片离子的分子式进行预测。相关参数设置为:C [0-30],H [0-50],O [0-30],S [0-2],N [0-3],环不饱和双键数(RDB equivalent value)[0-15],质量精度误差在1×10−5以内。
3.2 隐绿原酸在大鼠体内的代谢产物分析鉴定
基于UHPLC-Q-TOF分析空白组和给药组的大鼠血浆、尿液和粪便样品。通过对比给药前后的生物样品图谱信息,结合色谱保留时间、精确相对分子质量、碎片离子、文献报道以及对照品比对信息等,共鉴定了包括原型在内的47个代谢产物。其中,在给药组血浆、尿液和粪便样品中分别鉴定了13、38、18个代谢产物,具体的质谱信息见表1。
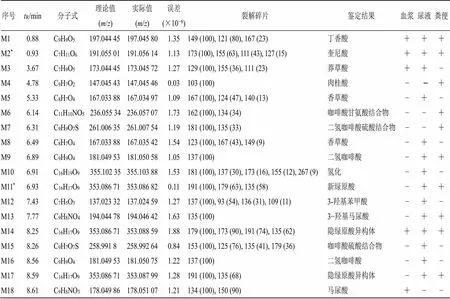
表1 大鼠生物样品中隐绿原酸代谢产物的质谱信息
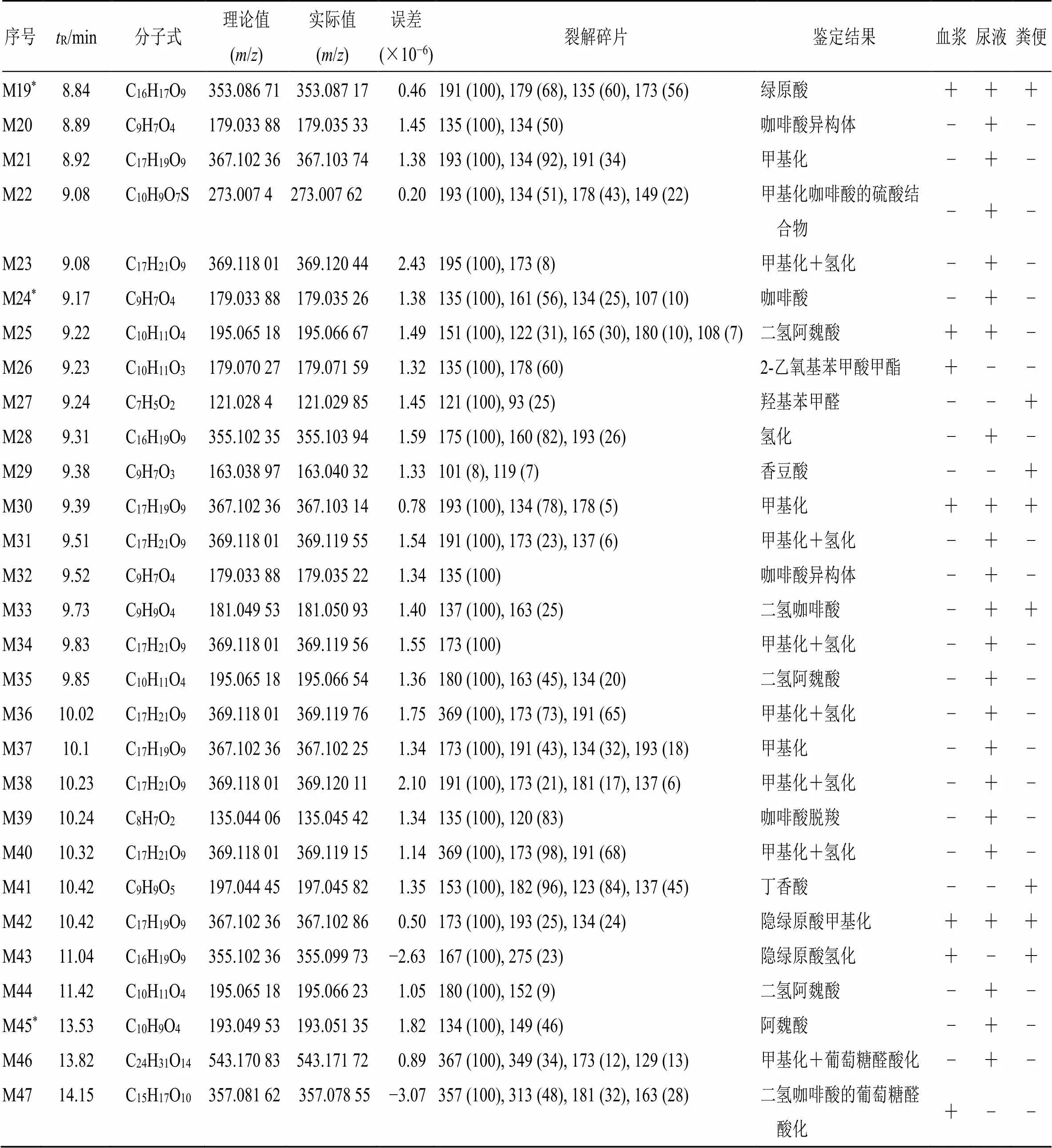
续表1
“+”检测到 “−”未检测到*与对照品比对鉴定
“+”detected “−” undetected*identified with reference standard
在负离子模式下,M11、M14、M17和M19产生相同的准分子离子峰/353.086 71 [M-H]−,推测其分子式为C16H17O9(误差≤±2.00×10−6)。在其ESI-MS2谱中,它们均产生特征碎片离子/191.056 13(奎尼酸骨架离子)。其中,M11和M19的色谱保留时间和多级质谱裂解行为与相应的对照品基本相同。因此,分别将M11和M19准确鉴定为新绿原酸和绿原酸,同时将M14和M17鉴定为隐绿原酸的同分异构体[12-15]。
M20、M24和M32具有相同的准分子离子峰/179.035 26,推断最可能的分子式为C9H7O4(误差≤±2.00×10−6)。在其ESI-MS2谱中均可见特征碎片离子/135 [M-H-CO2]−,表明分子中存在羧基。通过与咖啡酸对照品的保留时间以及质谱裂解行为比对,可将M24准确鉴定为咖啡酸,并把M20和M32鉴定为咖啡酸同分异构体。M9、M16和M33的实验相对分子质量均比咖啡酸多2,并产生相同的准分子离子峰/181.049 53 [M-H]−,推测其分子式为C9H9O4(误差≤±2.00×10−6)。在ESI-MS2谱中,它们均可脱去1分子H2O(18)产生主要的碎片离子/163,并可中性丢失1分子CO2(44)产生碎片离子/137。因此,可将M9、M16和M33鉴定为二氢咖啡酸同分异构体。
M47的准分子离子峰为/357.078 55 [M-H]−,推测其分子式为C15H17O10,误差为3.07×10−6。在ESI-MS2谱图中,/357脱去1分子CO2(44)形成碎片离子/313。同时还检测到碎片离子/181 [M-H-glucuronide-H2O]−。因此,推测M47是二氢咖啡酸的葡萄糖醛酸结合反应产物。其ESI-MS2裂解的产物离子/163 [M-H-glucuronide-2H2O]−,可进一步确认上述推断。M6的准分子离子峰为/236.057 07 [M-H]−,推测其分子式为C11H10NO5,误差为1.73×10−6。在其ESI-MS2谱中,/236分别中性丢失1分子C2H4NO2和C3H4NO3,生成碎片离子/162([M-H-NH2CH2COO]−)和/134([M-H-NH2CH2COO-CO]−),表明其分子中存在甘氨酸和羰基。参照文献报道,可将其鉴定为咖啡酸的甘氨酸结合产物。
M23的色谱保留时间为9.08 min,准分子离子峰为/273.007 60 [M-H]−,推测其分子式为C10H9O7S。在其ESI-MS2谱图中,/273相继产生碎片离子/193 [M-H-SO3]−、/149 [M-H-SO3-CO2]−和/134 [M-H-SO3-CO2-CH3]−,表明其母核结构中存在羧酸、硫酸基团及甲氧基等。结合相关文献报道,将M23鉴定为咖啡酸甲基化和磺酸化的复合产物。M4的准分子离子峰为/147.045 43 [M-H]−,推测其分子式为C9H7O2(误差≤±2.00×10−6)。同时,M4的实验相对分子质量比咖啡酸少32。在其ESI-MS2谱图中,/147脱掉1分子CO2(44)生成碎片离子/103。结合文献报道[16],可将M4鉴定为肉桂酸。
M7的色谱保留时间为9.24 min,相对分子质量为261.006 35,推测其分子式为C9H9O7S(误差≤±2.00×10−6)。在它的ESI-MS2谱中,/261脱掉1分子SO3(80)和1分子CO2(44),分别产生碎片离子/181 [M-H-SO3]−和/137 [M-H-SO3-CO2]−,表明其母核结构中存在羧基和磺酸基。因此,M7被鉴定为二氢咖啡酸磺酸化结合物。M29的准分子离子峰为/163.040 30 [M-H]−,推测其分子式为C9H7O3(误差1.33×10−6)。它的实验相对分子质量比咖啡酸少16,推测是咖啡酸的脱羟基产物。结合产生碎片离子/119 [M-H-CO2]−,将M29鉴定为咖啡酸的脱羟基产物香豆酸[17-18]。
M39的准分子离子峰为/135.045 40 [M-H]−,推测其分子式为C8H7O2(误差为1.34×10−6)。在ESI-MS2谱中,其可中性丢失1分子CH3,产生二级碎片离子/120,表明其母核结构中存在甲基。结合相关文献报道,将M39鉴定为咖啡酸脱羧产物。M45的色谱保留时间为13.53 min,准分子离子峰为/193.051 35 [M-H]−。根据精确分子质量推测其分子式为C10H9O4(质量误差1.82×10−6)。在ESI-MS2图谱中,/193依次丢失1分子CO2和1分子CH3,分别产生碎片离子/149和/134,推测其分子中存在羧基和甲基。通过与相应的对照品比对,将M45准确鉴定为阿魏酸。
M2的准分子离子峰为/191.056 14 [M-H]−,保留时间为0.93 min,分子式为C7H11O6。在ESI-MS2图谱中,通过中性丢失1分子H2O和1分子CO2产生/173和/147。此外,中性丢失2分子H2O和1分子CO2产生/111 [M-H-CO2-2H2O]−。据此推断M2分子中极有可能存在至少2个羟基和1个羧基。由于M2与奎尼酸对照品的色谱保留时间和质谱碎片相同,可将其准确鉴定为奎尼酸。
M12的准分子离子峰为137.023 32 [M-H]−,推测其分子式为C7H5O3,误差为1.27×10−6。其相对分子质量比苯甲酸多16,推测M12可能是苯甲酸的羟基化产物。由于其ESI-MS2碎片离子/109 [M-H-H2O]−和/93 [M-H-CO2]−是通过中性丢失1分子CO2和1分子H2O分别产生的,表明其母核结构上存在羟基和羰基。因此,最终将M12鉴定为3-羟基苯甲酸。
M5和M8的准分子离子峰[M-H]−分别为167.034 9、167.035 4,并分别产生 ESI-MS2碎片离子/123和/149。其中,/167脱去1分子CO2产生/123,/167中性丢失1分子H2O产生/149。因此,可将二者鉴定为香草酸及其同分异构体[19]。
M27的准分子离子峰为/121.029 85 [M-H]−,分子式为C7H5O2。在其ESI-MS2图谱中,通过中性丢失1分子CO产生碎片离子/93 [M-H-CO]−。因此将M27鉴定为羟基苯甲醛。M3的色谱保留时间为1.27 min,结合高分辨相对分子质量173.045 7,推测分子式为C7H9O5,其产生的碎片离子为/129、/155和/111。在负离子模式下,其准分子离子峰/173脱去1分子H2O产生/155,脱去1分子CO2产生/129,/155脱去1分子CO2生成/111,说明分子中存在羧基和羟基,由此将M3鉴定为莽草酸[20-21]。
M18的准分子离子峰[M-H]−为178.051 7,由氮规律推测其含有奇数个氮原子。结合精确相对相对分子质量推测其分子式为C9H8NO3,分别产生ESI-MS2碎片离子/134和/150等。其中,/150为/178脱去1分子CO产生的;/178中性丢失1分子CO2产生/134。因此,最后将其鉴定为马尿酸[22]。
M26的准分子离子峰[M-H]−为179.071 59,推测其分子式为C9H8NO3,误差为1.32×10−6。其ESI-MS2谱碎片离子/135可推测为[M-H]−离子中性丢失1分子CO2所产生的。因此,将M26推测为2-乙氧基苯甲酸甲酯。
M13在总离子流图提取的准分子离子峰为/194.046 43 [M-H]−。结合精确其相分子质量推测其分子式为C8H8NO4,误差为1.63×10−6。由于其相对分子质量较马尿酸多16,并均产生碎片离子/135 [M-H-CO2-CH3]−和/150 [M-H-CO2]−,说明M13分子中存在羧基和甲基。因此,将其鉴定为3-羟基马尿酸[22]。
M25、M35和M44的色谱保留时间分别为9.22、9.58、11.42 min。根据高分辨精确相对分子质量推测它们的分子式为C10H11O4,误差均≤±2.00×10−6。在其ESI-MS2谱中,[M-H]−离子由于中性丢失1分子CH3和1分子CO2分别产生碎片离子/180和/151,表明分子中存在甲基和羧基。结合相关文献报道,将其鉴定为二氢阿魏酸。
M1的准分子离子峰均/197.045 8 [M-H]−,结合高分辨精确相对分子质量推测其分子式为C9H9O5,误差均为1.35×10−6。在ESI-MS2谱图中,均可见碎片离子/167 [M-H-OCH2]−、/149 [M-OCH2-H2O]−和/121 [M-OCH2-H2O-CO]−,表明分子中存在甲氧基、羰基以及羟基。因此,将M1鉴定为丁香酸[19]。
M15的精确相对分子质量为/258.992 64,较M24相对分子质量多80,推测其分子式为C9H8NO3(误差为0.84×10−6)。在其ESI-MS2谱图中,/179[M-H-SO3]−表明分子中磺酸基团的存在。鉴于其裂解规律与咖啡酸裂解规律相近,可将M15推测为咖啡酸硫酸化产物。
M10、M28和M43的准分子离子峰为/355.102 35,根据高分辨精确相对分子质量推测它们的分子式为C16H19O9(误差≤±5.00×10−6),其相对分子质量比绿原酸多2,且均产生/181、/173和/155,故将其鉴定为隐绿原酸氢化产物。
M21、M30、M37和M42色谱保留时间相近,根据高分辨精确相对分子质量推测它们的分子式为C17H19O9,且相对分子质量比隐绿原酸多14(CH2)。在它们的ESI-MS2谱图中,均产生碎片离子为/173 [奎尼酸-H-H2O]−、/137 [二氢咖啡酸-H-CO2]−和/191 [奎尼酸-H]−,故将它们鉴定为隐绿原酸甲基化产物。
M23、M31、M34、M36、M38和M40的理论精确相对分子质量均为/369.118 01,推测它们的分子式为C17H21O9,误差均小于3×10−6。由于其相对分子质量较M17多14,较M21多2,且在ESI-MS2谱均产生/173 [奎尼酸-H-H2O]−和/191 [奎尼酸-H]−等,推测它们为隐绿原酸氢化和甲基化产物。
M46的准分子离子峰[M-H]−为/543.171 72,推测分子式为C24H31O14,误差为8.9×10−7。在其ESI-MS2谱图中,通过丢失176产生碎片离子/367 [M-H-C7H12O5]−,表明其分子中含有葡萄糖醛酸基团。同时,/367比原药分子式多CH2,结合二级碎片离子/173 [奎宁酸-H2O-H]−和/135 [咖啡酸-CO2-H]−,表明分子存在奎尼酸骨架、咖啡酸骨架。因此,M46被鉴定为甲基隐绿原酸的葡萄糖结合产物。
4 隐绿原酸在大鼠体内的代谢途径分析
通过分析,本研究共从大鼠的血浆、尿液和粪便中鉴定了47个代谢产物,其中有5个代谢产物通过与对照品的精确相对分子质量、特征碎片离子以及色谱保留行为比对而被准确鉴定。通过归纳分析,隐绿原酸在大鼠体内的主要代谢反应有异构化、氢化、甲基化、葡萄糖醛酸化以及它们的复合反应。其中,本研究并未检出原药隐绿原酸,而其同分异构体绿原酸、新绿原酸等均检出,说明隐绿原酸在大鼠体内稳定性较差,极易发生异构化反应。同时,隐绿原酸在结构上由咖啡酸和奎尼酸脱水缩合形成,当隐绿原酸进入体内后极其容易水解成咖啡酸和奎尼酸2个核心代谢产物,并在此基础上发生进一步的代谢转化反应,涉及的反应有葡萄糖醛酸化、硫酸酯化、去羟基化以及它们的复合反应。其主要代谢途径见图1。
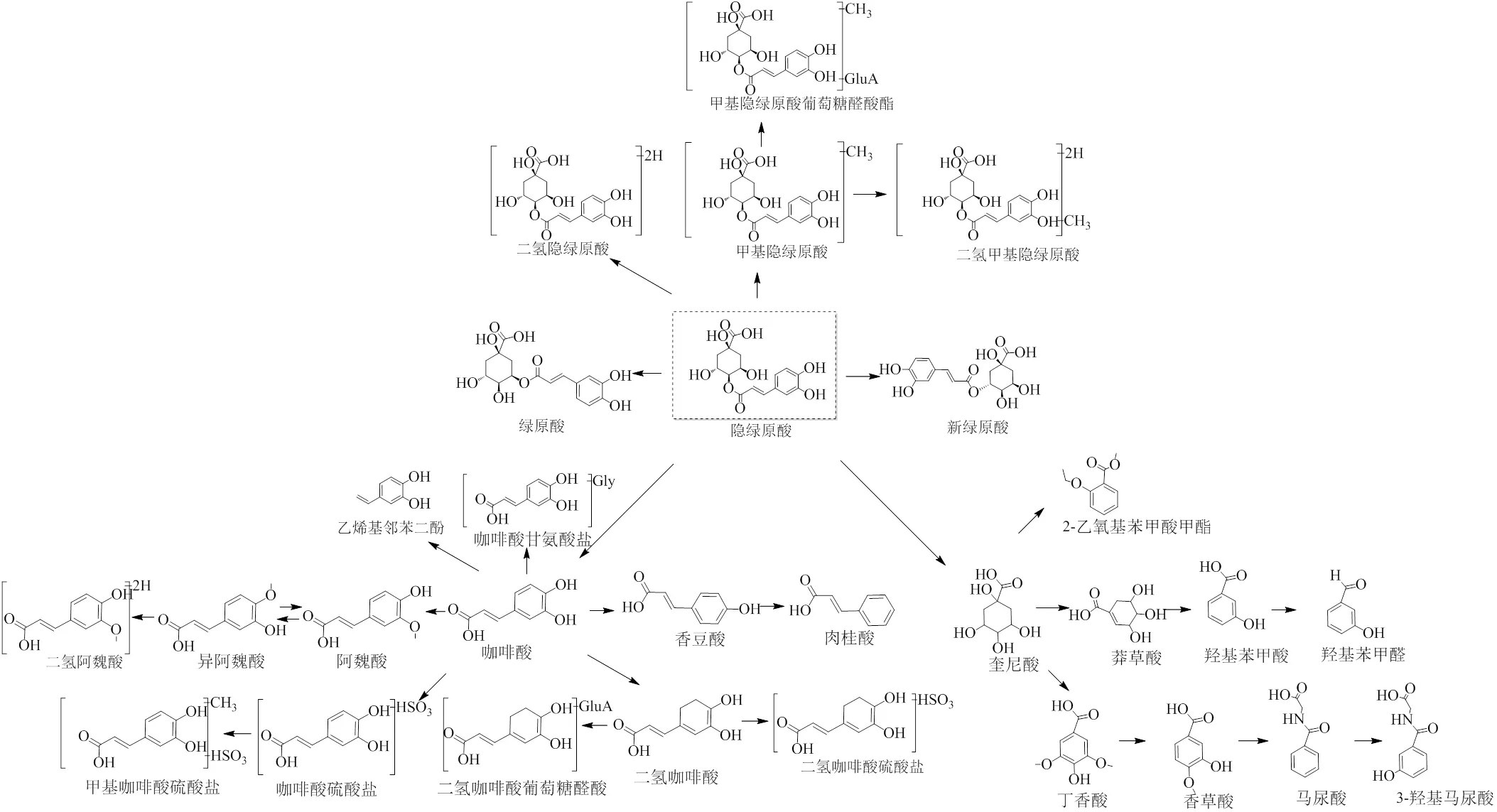
图1 隐绿原酸在大鼠体内的代谢途径
5 讨论
本研究利用UHPLC-Q-TOF MS高分辨质谱联用技术分析鉴定了隐绿原酸在正常SD大鼠血浆、尿液及粪便中的代谢产物。通过分析这些代谢产物的精确分子质量、质谱裂解规律以及特征碎片离子等,筛选鉴定了47个代谢产物。其发生的主要代谢反应与绿原酸较为相似,主要缘于二者类似的母核结构和取代模式。本研究为进一步研究绿原酸类的体内代谢奠定了基础。
除此之外,隐绿原酸进入体内后产生核心代谢产物咖啡酸和奎宁酸,并在此基础上发生进一步的代谢,产生阿魏酸、异阿魏酸、香豆酸等,它们均具有很好的抗菌消炎的药理作用,上述结果可为隐绿原酸的临床应用研究以及阐明药效学物质基础提供借鉴。
利益冲突 所有作者均声明不存在利益冲突
[1] Clifford M N, Marks S, Knight S,. Characterization by LC-MS(n) of four new classes of-coumaric acid-containing diacyl chlorogenic acids in green coffee beans [J]., 2006, 54(12): 4095-4101.
[2] Liang N J, Kitts D D. Role of chlorogenic acids in controlling oxidative and inflammatory stress conditions [J]., 2015, 8(1): E16.
[3] Marques V, Farah A. Chlorogenic acids and related compounds in medicinal plants and infusions [J]., 2009, 113(4): 1370-1376.
[4] 米慧娟, 王永香, 吴云, 等. 基于化学成分群动态变化研究金银花药材在抗菌活性方面的质量优劣 [J]. 中草药, 2018, 49(7): 1677-1681.
[5] 宋亚玲, 王红梅, 倪付勇, 等. 金银花中酚酸类成分及其抗炎活性研究 [J]. 中草药, 2015, 46(4): 490-495.
[6] Fernandez-Gomez B, Ullate M, Picariello G,. New knowledge on the antiglycoxidative mechanism of chlorogenic acid [J]., 2015, 6(6): 2081-2090.
[7] 谢岑, 钟大放, 陈笑艳. 鉴定大鼠注射绿原酸后体内的代谢产物 [J]. 药学学报, 2011, 46(1): 88-95.
[8] Naranjo Pinta M, Montoliu I, Aura A M,.gut metabolism of [U-13C]-quinic acid, the other hydrolysis product of chlorogenic acid [J]., 2018, 62(22): e1800396.
[9] Plumb G W, Garcia-Conesa M T, Kroon P A,. Metabolism of chlorogenic acid by human plasma, liver, intestine and gut microflora [J]., 1999, 79(3): 390-392.
[10] Azuma K, Ippoushi K, Nakayama M,. Absorption of chlorogenic acid and caffeic acid in rats after oral administration [J]., 2000, 48(11): 5496-5500.
[11] Morishita H, Ohnishi M. Absorption, metabolism and biological activities of chlorogenic acids and related compounds [J]., 2001, 25: 919-953.
[12] Zhang J Y, Wang Z J, Zhang Q,. Rapid screening and identification of target constituents using full scan-parent ions list-dynamic exclusion acquisition coupled to diagnostic product ions analysis on a hybrid LTQ-Orbitrap mass spectrometer [J]., 2014, 124: 111-122.
[13] 张敏敏, 赵志国, 刘倩, 等. 基于离线2D-HPLC- DPPH-ESI-Q-TOF/MS联用技术的金银花抗氧化成分系统筛选研究[J]. 中草药, 2021, 52(11): 3193-3200.
[14] Clifford M N. Chlorogenic acids and other cinnamates - nature, occurrence and dietary burden [J]., 1999, 79(3): 362-372.
[15] Farah A, Monteiro M, Donangelo C M,. Chlorogenic acids from green coffee extract are highly bioavailable in humans [J]., 2008, 138(12): 2309-2315.
[16] 王静哲, 刘震, 马立满, 等. 基于UPLC-Q-TOF MS分析加工炮制对玄参化学成分的影响 [J]. 质谱学报, 2016, 37(1): 1-9.
[17] 赵利娟, 高文雅, 顾欣如, 等. 蒲地蓝消炎口服液化学成分鉴定及归属研究 [J]. 中国中药杂志, 2019, 44(8): 1573-1587.
[18] 于泓, 胡青, 孙健, 等. 基于超高效液相色谱-四极杆-飞行时间质谱技术的黄芪注射液中化学成分分析[J].世界中医药, 2019, 14(4): 809-817.
[19] 李振华, 徐金娣, 鞠建明, 等. 川楝子水提化学成分的UPLC-ESI-Q-TOF-MS分析 [J]. 中草药, 2015, 46(4): 496-501.
[20] 郝庆秀, 康利平, 朱寿东, 等. 基于UPLC-Q-TOF/MSE技术的彝药满山香的化学成分鉴别研究 [J]. 中国中药杂志, 2017, 42(21): 4234-4245.
[21] 周丹丹, 邹秦文, 林瑞超. 基于超高效液相色谱-四级杆-静电场轨道阱质谱的胃复春片化学成分研究[J]. 世界中医药, 2020, 15(13): 1841-1848.
[22] 马飞祥, 薛培凤, 韩盟帝, 等. 蒙药蓝盆花乙醇提取物的血清药物化学研究 [J]. 中国药房, 2018, 29(21): 2953-2957.
Metabolite identification of cryptochlorogenic acid in rats using UHPLC-Q-TOF MS
LI Fang1, LI Jie2, WANG Yu-qi2, DONG Fan1, TAOYu-fan3,WANG Shao-ping3, ZHANG Jia-yu3
1. School of Pharmacy, Fengtai Maternal and Children’s Health Hospital of Beijing, Beijing 100069, China 2. School of Chinese Pharmacy, Beijing University of Chinese Medicine, Beijing 102488, China 3. School of Pharmacy, Binzhou Medical University, Yantai 264003, China
To elucidate themetabolites of cryptochlorogenic acid in rat plasma, urine and feces samples.Urine, plasma and feces samples were collected after oral gavage. After processing biological sample by solid-phase extraction, an efficient method of ultra-high performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry (UHPLC-Q-TOF) mass spectrometer was established to identify its metabolites.According to the obtained accurate mass weight, chromatographic retention behavior, mass spectrometry cleavage, characteristic fragment ions, reference comparison, and related literature reports, a total of 47 metabolites were finally screened and characterized. The main metabolic pathways contained hydrolysis, isomerization, hydrogenation, glucosylation and their complicated reactions.The results showed that the metabolism of cryptochlorogenic acid could be comprehensively clarified by using UHPLC-Q-TOF mass spectrometer. Moreover, our study provided the scientific evidence for the further study of the pharmacological material basis of cryptochlorogenic acid.
cryptochlorogenic acid; rats; UHPLC-Q-TOF MS; metabolite identification; biological samples
R284.1
A
0253 - 2670(2021)13- 3810 - 08
10.7501/j.issn.0253-2670.2021.13.005
2020-12-20
2017年北京市科技新星与领军人才培养专项计划(Z171100001117029);滨州医学院高层次人才科研启动基金项目(2019KYQD05);山东省青创人才引育创新研究团队;烟台市校地融合中药大健康产业化平台项目
李 芳(1980—),女,博士,副主任药师,研究方向为中药调肝方药药理研究。Tel: (010)83917191 E-mail: myhappyflash@126.com
张加余(1981—),男,教授,硕士生导师,主要从事中药质量控制及体内代谢研究。Tel: (0535)6913719 E-mail: zhangjiayu0615@163.com
[责任编辑 王文倩]