海绵共生真菌Chaetomium globosum HXL-1次级代谢产物及其体外抗肿瘤活性研究
晏骄阳,孔凡栋,马青云,谢晴宜,张 菲,郭教岑,戴好富,黄小龙*,赵友兴*
•化学成分 •
海绵共生真菌HXL-1次级代谢产物及其体外抗肿瘤活性研究
晏骄阳1,孔凡栋2,马青云2,谢晴宜2,张 菲2,郭教岑2,戴好富3,黄小龙1*,赵友兴2*
1. 海南大学生命科学与药学院,海南大学热带生物资源教育部重点实验室,海南 海口 570228 2. 中国热带农业科学院热带生物技术研究所 海口市热带天然产物研究与利用重点实验室,海南 海口 571101 3. 中国热带农业科学院海南热带农业资源研究院,海南 海口 571101
研究海绵共生真菌HXL-1的次级代谢产物及其抗肿瘤活性。利用硅胶柱色谱、ODS柱色谱、高效液相色谱等方法对其次级代谢产物进行分离纯化,运用NMR、MS等多种波谱方法鉴定化合物结构;采用MTT方法评价化合物的体外抗肿瘤活性。从该菌株发酵液的醋酸乙酯萃取物中分离得到16个化合物,分别鉴定为4-甲氧基-3,5-二甲基-6-(2-甲基丁酰基)-2氢-2-吡喃酮(1)、吡啶并戊二烯(2)、1-脱乙酰基-吡啶并戊二烯(3)、7-脱乙酰基-吡啶并戊二烯(4)、大黄素-8-甲醚(5)、8-羟基-1,3-二甲氧基-6-甲基蒽醌(6)、cytoglobosins D(7)、isochaetoglobosin D(8)、球毛壳菌素E(9)、球毛壳菌素Vb(10)、monohydroxyisoaflavinine(11)、aflavazole(12)、烟曲酶毒素C(13)、chaetoviridin B(14)、杀锥曲菌素(15)、oxidized-nodulisporic acid B(16)。化合物1是吡喃酮类新化合物;化合物7~13为吲哚生物碱类化合物;化合物1、11、12为首次从球毛壳菌中分离得到;化合物2、8、15对选定的人肿瘤细胞具有一定的体外抗增殖活性。
海绵真菌;球毛壳菌;次级代谢产物;抗肿瘤活性;4-甲氧基-3,5-二甲基-6-(2-甲基丁酰基)-2氢-2-吡喃酮;吡啶并戊二烯;杀锥曲菌素
球毛壳菌为子囊菌亚门、毛壳菌科、毛壳属真菌,广泛分布于空气、土壤和动植物体内,是产生结构新颖、生物活性显著的次级代谢产物的重要来源[1]。已有研究表明,球毛壳菌次级代谢产物的类型以细胞松弛素类、嗜氨酮类、二酮哌嗪类居多,且多具抗肿瘤、抑菌、抗病毒等生物活性[2-3]。自1976年Sekita等[4]首次从中分离到球毛壳菌素以来,目前已发现了300多个结构新颖的活性次生代谢产物。虽然已有球毛壳菌的次生代谢产物和药理活性的报道[5-6],但由于菌株来源、发酵培养条件不同,代谢产物种类与结构会有较大的差异。因此,球毛壳菌的次级代谢产物仍有待进一步挖掘。
为了更深入地研究球毛壳菌的次级代谢产物,本实验对1株海绵共生菌HXL-1的化学成分进行研究,分离得到16个化合物(图1),分别鉴定为4-甲氧基-3,5-二甲基-6-(2-甲基丁酰基)-2氢-2-吡喃酮[4-methoxy-3,5-dimethyl-6-(2-methylbutanoyl)- 2-pyran-2-one,1]、吡啶并戊二烯(pyripyropene A,2)、1-脱乙酰基-吡啶并戊二烯(1-deacetyl- pyripyropene A,3)、7-脱乙酰基-吡啶并戊二烯(7-deacetyl-pyripyropene A,4)、大黄素-8-甲醚(questin,5)、8-羟基-1,3-二甲氧基-6-甲基蒽醌(8-hydroxy- 1,3-dimethoxy-6-methylanthraquinone,6)、cytoglobosins D(7)、isochaetoglobosin D(8)、球毛壳菌素E(chaetoglobosins E,9)、球毛壳菌素Vb(chaetoglobosin Vb,10)、monohydroxy- isoaflavinine(11)、aflavazole(12)、烟曲酶毒素C(fumitremorgin C,13)、chaetoviridin B(14)、杀锥曲菌素(trypacidin,15)、oxidized-nodulisporic acid B(16)。化合物1是吡喃酮类新化合物,化合物7~13为吲哚生物碱类化合物;化合物1、11、12为首次从球毛壳菌中分离得到;化合物2、8、15对选定的人肿瘤细胞具有一定的体外抗增殖活性。
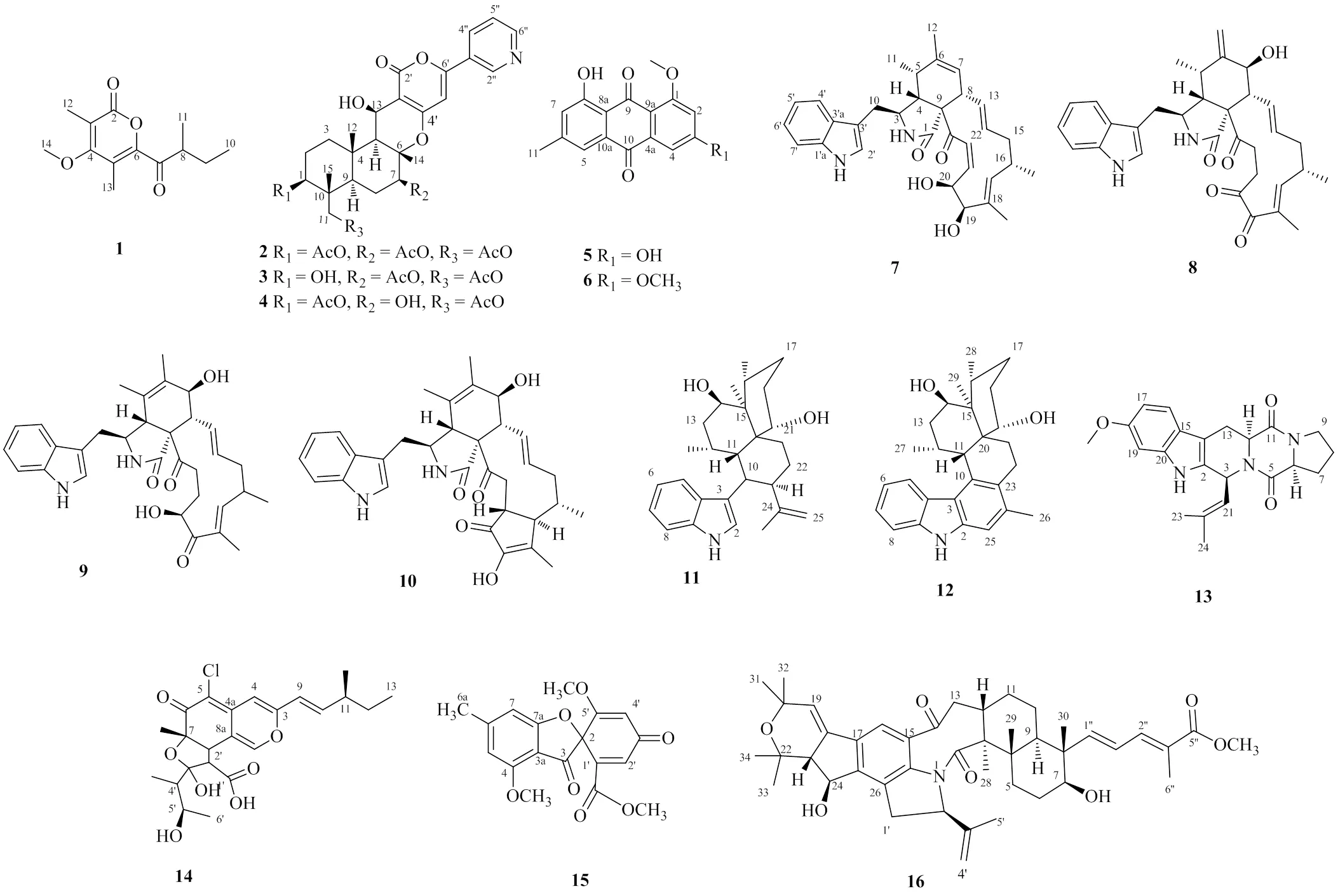
图1 化合物1~16的结构
1 仪器与材料
GF254薄层色谱硅胶板、柱色谱用200~300目硅胶(青岛海洋化工厂);CCA-1112A冷却水循环装置、N-1100旋转蒸发仪(上海爱朗仪器有限公司);SHZ-DIII循环水真空泵(郑州予华仪器有限公司);超净工作台(苏州净化有限公司);反相材料C18(日本FUJI公司);Sephadex LH-20凝胶(德国Merck公司);Bruker AV-500型超导核磁共振波谱仪(德国Bruker公司);Autospec-3000质谱仪;Agilent 1260分析型高效液相色谱仪(安捷伦公司),COSMOSIL半制备色谱柱C18(250 mm×4.6 mm,5 μm)购于日本Nacalai Tesque公司,色谱级甲醇和乙腈(西陇化学试剂有限公司),5种人肿瘤细胞株:人类红白血病K562细胞、人肝癌BEL细胞、人胃腺癌SGC-7901细胞、人肺癌A549细胞、人宫颈癌HeLa细胞购于上海生工生物技术有限公司。
2 菌株来源与发酵
从海南文昌海域的海绵样品中分离得到的菌株HXL-1,经ITS测序鉴定为球毛壳属真菌;GenBank号为MW166244。将菌株接种于PDA液体培养基中,在28 ℃、180 r/min的摇床上培养3 d;配制真菌二号发酵培养基(麦芽糖20 g、味精10 g、KH2PO40.5 g、MgSO4·7H2O 0.3 g、葡萄糖10 g、酵母膏3 g、玉米浆1 g、甘露醇20 g,pH 6.5,海水1 L)并分装200 mL于1000 mL三角瓶中,共计200瓶;经高压灭菌锅121 ℃灭菌25 min后,从PDA液体培养基接种5 mL菌液于发酵培养基中,室温静置培养30 d。
3 提取与分离
发酵结束后,向三角瓶中加入2倍体积的醋酸乙酯,经过浸泡、破碎、超声等过程,用纱布滤过得发酵产物上清液,将其减压浓缩得到浸膏123.0 g。浸膏经石油醚萃取脱脂后,采用硅胶(200~300目)减压柱色谱,以石油醚-醋酸乙酯(8∶1→1∶2)体系进行梯度洗脱,得到6个次级组分(Fr. 1~6)。
Fr. 6(2.3 g)先经反相硅胶柱,以20%~100%甲醇梯度洗脱分成9个组分(Fr. 6-1~6-9),Fr. 6-2(4 mg)经半制备HPLC(COSMOSIL- packed,C18,250 mm×4.6 mm,5 μm,75%甲醇)分离得到化合物1(0.7 mg);Fr. 6-4(74 mg)经半制备HPLC(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,65%甲醇)分离得到化合物9(8.0 mg)和8(3.0 mg);Fr. 6-5(12 mg)经半制备HPLC(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,80%甲醇)分离得到化合物13(2.5 mg)。Fr. 6-6(30 mg)经半制备HPLC分离(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,60%甲醇)得到化合物7(2.0 mg)和10(2.3 mg)。
Fr. 5(4.8 g)经反相硅胶柱,以20%~100%甲醇梯度洗脱分成9个组分(Fr. 5-1~5-9),其中Fr. 5-4(13.5 mg)经半制备HPLC(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,60%甲醇)分离得到化合物5(3.2 mg)和6(3.3 mg);Fr. 5-5(16.2 mg)经半制备HPLC(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,45%乙腈)分离得到化合物2(2.7 mg)、3(2.1 mg)和4(3.5 mg)。Fr.5-6(32.6 mg)经半制备HPLC(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,50%乙腈水)分离得到化合物11(2.3 mg)和12(2.5 mg)。Fr.5-7(12.4 mg)经半制备HPLC(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,65%甲醇)分离得到化合物14(1.4 mg)。
Fr. 4(3.2 g)经反相硅胶柱,以20%~100%乙腈梯度洗脱分成9个组分(Fr. 4-1~4-9),其中Fr. 4-5(18.0 mg)经半制备HPLC(COSMOSIL-packed,C18,250 mm×4.6 mm,5 μm,50%乙腈-0.1%三氟乙酸水)分离得到化合物15(2.4 mg)和16(2.7 mg)。
4 结构鉴定
化合物1:无色油状物,易溶于甲醇,HR-ESI-MS中显示准分子离子峰/237.112 1 [M-H]−(计算值为237.113 2),提示分子式为C13H18O4,红外光谱给出羰基的吸收峰(1731 cm−1)。其1H-NMR、13C-NMR和DEPT数据(表1)提示其含有5个甲基包括1个甲氧基 (C/H62.8/3.68)、1个亚甲基(C/H28.6/1.78, 1.42)、1个次甲基 (C/H46.5/3.77)、1个酯羰基 (C162.0)、1个酮羰基 (C212.3) 和4个sp2杂化的季碳 (C111.1, 160.0, 109.0, 161.9)。这些数据和paecilopyrone A[7]的核磁数据非常相似,只是比paecilopyrone A少了1个亚甲基信号,多了1个甲氧基信号。H-8/H-9/H-10以及H-8/H-11的1H-1H COSY相关给出C-8‒C-11片段(图2)。在HMBC谱中(图2),H3-12 (H2.10) 与C-2, C-3, C-4相关,H3-13 (H2.03) 与C-4, C-5, C-6相关,以及甲氧基氢H3-14与C-4相关(图2),提示化合物1中具有和paecilopyrone A相同的吡喃酮片段,只是在paecilopyrone A的吡喃酮片段中4-OH被化合物1中的4-OCH3取代。C-6和C-7的相连是通过H-8和C-6以及H3-11和C-7之间的HMBC信号确定的。因此,化合物1的结构确定为4-甲氧基-3,5-二甲基-6-(2-甲基丁酰基)-2-2-吡喃酮(图1)。
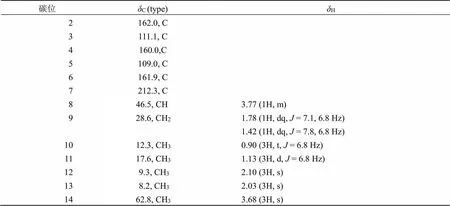
表1 化合物1的核磁数据(500/125 MHz, CD3OD)
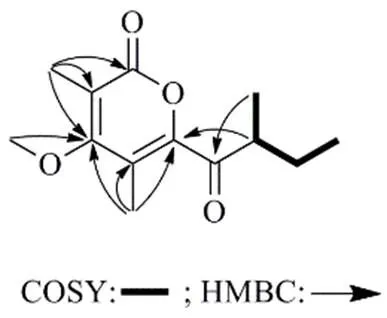
图2 化合物1的关键HMBC、COSY信号
化合物5:淡黄色粉末,ESI-MS/: 307.1 [M+Na]+,分子式C16H12O5。1H-NMR (500 MHz, CD3OD): 13.56 (1H, s, 8-OH), 7.40 (1H, d,= 2.0 Hz, H-4), 7.09 (2H, d,= 2.0 Hz, H-7, 5), 6.67 (1H, s, H-2), 5.74 (1H, s, 3-OH), 3.86 (3H, s, 1-OCH3), 2.37 (3H, s, 6-CH3);13C-NMR (125 MHz, CD3OD): 188.0 (C-9), 184.8 (C-10), 165.6 (C-6), 163.6 (C-8), 162.1(C-1), 147.8 (C-3), 138.6 (C-4a), 134.1 (C-10a), 125.2 (C-2), 120.4 (C-4), 116.2 (C-9a), 110.8 (C-8a), 106.3 (C-5), 104.2 (C-7), 56.6 (1-OCH3), 21.8 (C-11)。以上波谱数据与文献报道基本一致[11],故鉴定化合物5为大黄素-8-甲醚。
化合物6:淡黄色粉末,ESI-MS/: 307.8 [M+Na]+,分子式C17H14O5。1H-NMR (500 MHz, CD3OD): 13.56 (1H, s, 8-OH), 7.48 (1H, d,= 1.7 Hz, H-4), 7.21 (1H, d,= 2.3 Hz, H-5), 7.03 (1H, s, H-7), 6.71 (1H, d,= 1.7 Hz, H-2), 4.59 (3H, s, 3-OCH3), 3.93 (3H, s, 1-OCH3), 2.40 (3H, s, H-11);13C-NMR (125 MHz, CD3OD): 188.4 (C-9), 184.0 (C-10), 165.9 (C-1), 163.5(C-3), 161.1(C-8), 147.1 (C-6), 138.7 (C-4a), 134.2 (C-10a), 124.1 (C-7), 125.3 (C-5), 120.8 (C-9a), 116.2 (C-8a), 110.3 (C-2), 106.2 (C-4), 55.0 (3-OCH3), 54.8 (1-OCH3), 21.8 (C-11)。以上波谱数据与文献报道基本一致[12],故鉴定化合物6为8-羟基-1,3-二甲氧基-6-甲基蒽醌。
化合物9:无色粉末,ESI-MS/: 553.3 [M+Na]+,分子式C32H38N2O5。1H-NMR (500 MHz, DMSO-6): 10.90 (1H, s, H-1′), 8.09 (1H, s, 1H, H-2), 7.41 (1H, d,= 7.9 Hz, H-4′), 7.35 (1H, d,= 8.1 Hz, H-7′), 7.10 (1H, m, H-6′), 7.06 (1H, d,= 2.8 Hz, H-2′), 6.98 (1H, t,= 7.4 Hz, H-5′), 5.57 (1H, d,= 10.2 Hz, H-17), 6.21 (1H, m, H-13), 5.06 (1H, m, H-14), 1.71 (3H, s, 18-CH3), 1.51 (3H, s, H-12), 1.10 (3H, s, H-11), 1.00 (3H, d,= 6.7 Hz, 16-CH3);13C-NMR (125 MHz, DMSO-6): 210.3 (C-19), 204.1 (C-23), 174.1 (C-1), 148.4 (C-17), 136.3 (C-1′a), 135.2 (C-18), 133.69 (C-6), 133.6 (C-14), 128.5 (C-13), 127.2 (C-3′a), 125.6 (C-5), 123.7 (C-5′), 121.2 (C-2′), 118.6 (C-6′), 118.0 (C-4′), 111.7 (C-7′), 110.0 (C-3′), 70.2 (C-20), 67.8 (C-7), 61.7 (C-9), 57.2 (C-4), 51.0 (C-3), 49.3 (C-8), 40.8 (C-15), 36.5 (C-22), 33.0 (C-21), 31.9 (C-10), 30.6 (C-16), 19.9 (16-CH3), 17.0 (C-12), 14.8 (C-11), 12.1 (18-CH3)。以上波谱数据与文献报道基本一致[14],故鉴定化合物9为球毛壳菌素E。
5 体外抗肿瘤活性测试
应用MTT比色法[22]对化合物1~16进行了细胞毒活性初筛测试,发现化合物2、8、15对选定的人肿瘤细胞具有一定的体外抗增殖活性;复筛并测定其对5种肿瘤细胞的半数抑制浓度(IC50),结果见表2。

表2 化合物2、8、15对5种肿瘤细胞的IC50值
6 讨论
海绵共生真菌是新天然产物的重要来源,因此从其次级代谢产物中寻找结构新颖,活性优良的化合物具有重要意义。本研究从菌株HXL-1中分离得到16个化合物(1~16),其中1个吡喃酮类新化合物(1),2个首分化合物(11、12),3个抗肿瘤化合物(2、8、15)。这些发现进一步丰富了球毛壳真菌次级代谢产物结构的多样性,并为抗肿瘤先导化合物的研究提供了参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 梁海林, 童志武, 朱笃. 球毛壳菌次级代谢产物及其生物活性研究进展 [J]. 天然产物研究与开发, 2018, 30(4): 702-707.
[2] 徐国波, 张青艳, 周孟. 毛壳属真菌的次生代谢产物及其生物活性研究进展 [J]. 天然产物研究与开发, 2018, 30(3): 515-525.
[3] Bai H, Wu L, Yang T,. Isolation and identification of secondary metabolites from fungusand their antimicrobial activities [J]., 2015, 21(2): 274-278.
[4] Sekita S, Yoshihira K, Natori S,. Structures of chaetoglobosin A and B, cytotoxic metabolites of[J]., 1973, 14(23): 2109-2112.
[5] Zhang Q, Li H Q, Zong S C,. Chemical and bioactive diversities of the genussecondary metabolites [J]., 2012, 12(2): 127-148.
[6] Fatima N, Muhammad S A, Khan I,.endophytes: A repository of pharmacologically active metabolites [J]., 2016, 38(6): 1-18.
[7] Elbandy M, Shinde P B, Hong J,. ChemInform Abstract: α-Pyrones and yellow pigments from the sponge-derived fungus[J].,2009, 30(1): 188-192.
[8] Odani A, Ishihara K, Ohtawa M,. Total synthesis of pyripyropene A [J]., 2011, 67(42): 8195- 8203.
[9] Cao Q X, Wei J H, Deng R,. Two new pyripyropenes from the marine fungus2016F18-1 [J]., 2017, doi: 10.1002/cbdv. 201600298.
[10] Lan W J, Fu S J, Xu M Y,. Five new cytotoxic metabolites from the marine fungus[J]., 2016, 14(1): 18.
[11] Liangsakul J, Srisurichan S, Pornpakakul S. Anthraquinone-steroids, evanthrasterol A and B, and a meroterpenoid, emericellic acid, from endophytic fungus,variecolor [J]., 2016, 106: 78-85.
[12] Curtis R F, Hassall C H, Parry D R. The biosynthesis of phenols. XXIV. The conversion of the anthraquinone question into the benzophenone, sulochrin, in cultures of[J]., 1972, 2: 240-244.
[13] Cui C M, Li X M, Li C S,. Cytoglobosins A-G, cytochalasans from a marine-derived endophytic fungus,QEN-14 [J]., 2010, 73(4): 729-733.
[14] Sekita S, Yoshihira K, Natori S. Chaetoglobosins, cytotoxic 10-(indol-3-yl)-(13) cytochalasans fromspp. IV.13C-Nuclear magnetic resonance spectra and their application to a biosynthetic study [J]., 1983, 31(2): 490-498.
[15] 万丹, 陈曦, 朱力, 等. 牡蛎共生菌ML-4发酵液的化学成分及其体外抗肿瘤活性研究[J]. 中国中药杂志, 2017, 42(21): 4142-4149.
[16] TePaske M R, Gloer J B, Wicklow D T,. Aflavazole: a new antiinsectan carbazole metabolite from the sclerotia of[J]., 1990, 55(18): 5299-5301.
[17] Nozawa K, Sekita S, Harada M,. Isolation and structures of two new indoloditerpenes related to aflavinine from a microsclerotium-producing strain of[J]., 1989, 37(3): 626-630.
[18] Zhang D H, Noviendri D, Nurisd M,. 12, 13-Dihydroxyfumitremorgin C, fumitremorgin C, and brevianamide F, antibacterial diketopiperazine alkaloids from the marine-derived fungussp. [J]., 2007, 13(3): 251-254.
[19] Takahashi M, Koyama K, Natori S. Four new azaphilones fromvar.e [J]., 1990, 38(3): 625-628.
[20] Lu C H, Huang Y J, Shen Y M. Secondary metabolites ofvar.[J]., 2005, 3(5): 269-271.
[21] Ondeyka J G, Dahl-Roshak A M, Tkacz J S,. Nodulisporic acid B, B1, and B2: A series of 1'-deoxy-nodulisporic acids fromsp. [J]., 2002, 12(20): 2941-2944.
[22] Sylvester P W. Optimization of the tetrazolium dye (MTT) colorimetric assay for cellular growth and viability [J]., 2011, doi: 10.1007/ 978-1-61779-012-6_9.
Secondary metabolites of sponge-derived fungusHXL-1 and theiranti-tumor activities
YAN Jiao-yang1, KONG Fan-dong2, MA Qing-yun2, XIE Qing-yi2, ZHANG Fei2, GUO Jiao-cen2, DAI Hao-fu3, HUANG Xiao-long1, ZHAO You-xing2
1. Key Laboratory of Tropical Biological Resources of Ministry of Education, School of Life Sciences and Pharmacy, Hainan University,Haikou 570228, China 2. Haikou Key Laboratory for Research and Utilization of Tropical Natural Products, Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China 3. Hainan Academy of Tropical Agricultural Resource, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China
To study the secondary metabolites of a sponge-derived fungusHXL-1 and their antitumor activities.The secondary metabolites of strains were separated and purified by silica gel column chromatography, ODS column chromatography, high performance liquid chromatography; The structures of the compounds were identified by NMR, MS, and other spectral methods; Theanti-tumor activity of the compound was evaluated by the method of MTT.A total of 16 compounds were obtained from the EtOAc extract of the fermentation broth of sponge-derived fungus and the structures of the compounds were identified as: 4-methoxy-3,5-dimethyl-6-(2-methylbutanoyl)-2-pyran-2-one (1), pyripyropene A (2), 1-deacetyl-pyripyropene A (3), 7-deacetyl-pyripyropene A (4), questin (5), 8-hydroxy-1,3-dimethoxy-6- methylanthraquinone (6), cytoglobosins D (7), isochaetoglobosin D (8), chaetoglobosins E (9), chaetoglobosin Vb(10), monohydroxyisoaflavinine (11), aflavazole (12), fumitremorgin C (13), chaetoviridin B (14), trypacidin (15) and oxidized-nodulisporicacid B (16).Compound 1 is a new pyrone compound, and compounds 7—13 are known indole alkaloids; Compounds 1, 11 and 12 are isolated fromfor the first time. Compounds 2, 8 and 15 display varying degrees ofantitumor activities against human tumor cells.
sponge-derived fungus;; secondary metabolite; antitumor activity; 4-methoxy-3,5-dimethyl-6- (2-methylbutanoyl)-2-pyran-2-one; pyripyropene A; trypacidin
R284.1
A
0253 - 2670(2021)13 - 3790 - 08
10.7501/j.issn.0253-2670.2021.13.002
2021-01-26
海南省自然科学基金创新团队项目(2019CXTD411);农业农村部财政专项项目(NFZX2018);海南省普通高等学校研究生创新科研课题(Hys201902);中国热带农业科学院基本科研业务费专项资金(17CXTD-15)
晏骄阳(1996—)男,硕士,研究方向为天然产物化学研究。E-mail: 17763775239@163.com
赵友兴,男,博士,研究员。Tel: (0989)66989095 E-mail: zhaoyx1011@163.com
黄小龙,男,博士,副教授。Tel: 13976487719 E-mail: hxl2012@163.com
[责任编辑 王文倩]