抗菌多肽凝胶辅助治疗慢性牙周炎的临床疗效观察
丁戈 孙媛
慢性牙周炎是细菌感染性疾病,菌斑生物膜是始动因子。其为临床常见的口腔疾病,表现为牙龈红肿、出血、口腔异味、牙龈萎缩、咬合不适、牙齿松动甚至脱落。临床采用牙周基础治疗,包括龈上洁治、龈下刮治及根面平整等[1]。牙周基础治疗可有效去除牙石和菌斑,加上局部药物的辅助治疗,可更有效的控制炎症。目前临床上应用的药物有很多种,以往研究都对不同药物的疗效和不足之处进行了分析,近几年研究比较多的是抗菌多肽。抗菌多肽也称抗菌肽(antimicrobial peptides,AMPs),具有抗菌、抗微生物、抗病毒、抗肿瘤、抗发炎、中和内毒素和帮助伤口愈合的功能,且不易产生耐药性的短链多肽[2]。由于广谱抗菌性,近年来在牙周领域广泛应用[2]。本研究着重观察慢性牙周炎患者采用牙周基础治疗局部辅助应用抗菌多肽凝胶,与单纯牙周基础治疗的疗效,报告如下。
1 资料与方法
1.1 一般资料 选取2017 年5 月~2019 年8 月在辽宁健康产业集团本钢总医院口腔科门诊就诊的慢性牙周炎患者70例。其中,男42例、女28例,年龄35~63岁。随机分成对照组及观察组,每组35 例。
1.2 纳入及排除标准
1.2.1 纳入标准 ①符合慢性牙周炎的诊断标准,且口腔内至少余留20 颗牙齿(第三磨牙除外);②12 个月内未接受过牙周基础治疗;③近3 个月未服用抗生素、免疫抑制剂等药物或相关治疗。
1.2.2 排除标准 ①严重的全身系统性疾病;②孕妇或哺乳期妇女;③准备生育的育龄期夫妇;④药物过敏者。
1.3 方法 由同一医生检查并记录患者的口腔情况,包括菌斑指数、牙龈出血指数、牙周探诊深度。两组患者均进行口腔卫生知识宣教,常规牙周基础治疗,包括全口龈上洁治、龈下刮治及根面平整。观察组治疗后牙周袋内注满抗菌多肽凝胶,对照组治疗后牙周袋内注满碘甘油。两组均不服用抗生素。12 周后复诊记录菌斑指数、牙龈出血指数、牙周探诊深度。
1.4 观察指标及判定标准
1.4.1 菌斑指数 用2%品红溶液涂于牙齿颊面及舌面,观察颜色范围。根据Quigley-Hein 法记分标准:0:牙面无菌斑;1:牙颈部龈缘处点状菌斑;2:牙颈部龈缘连续窄带菌斑,宽度≤1 mm;3:牙颈部菌斑覆盖面积>1 mm,但少于牙面的1/3;4:菌斑覆盖面积占牙面的1/3~2/3;5:菌斑覆盖面积≥牙面。
1.4.2 牙龈出血指数 用牙周探针轻探入袋底,取出探针30 s 后记录出血程度。记分标准:0:牙龈健康,无炎症及出血;1:牙龈颜色有炎症改变,探诊后不出血;2:探诊后有点状出血;3:探诊后出血沿牙龈缘扩散;4:出血流满并溢出龈沟;5:自动出血。
1.4.3 牙周探诊深度 牙周探针探查牙龈缘到袋底距离,探诊压力保持25 g。每个牙位记录近中唇/颊,唇/颊,远中唇/颊,近中舌/腭,舌/腭,远中舌/腭6 个位点。
1.5 统计学方法 采用SPSS19.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t 检验。P<0.05 表示差异具有统计学意义。
2 结果
治疗前,两组患者的菌斑指数、牙龈出血指数、牙周探诊深度比较,差异无统计学意义(P>0.05);治疗12 周后,两组患者的菌斑指数、牙龈出血指数、牙周探诊深度均低于本组治疗前,且观察组患者的菌斑指数、牙龈出血指数、牙周探诊深度均低于对照组,差异具有统计学意义(P<0.05)。见表1。
表1 两组患者治疗前后的菌斑指数、牙龈出血指数、牙周探诊深度比较()
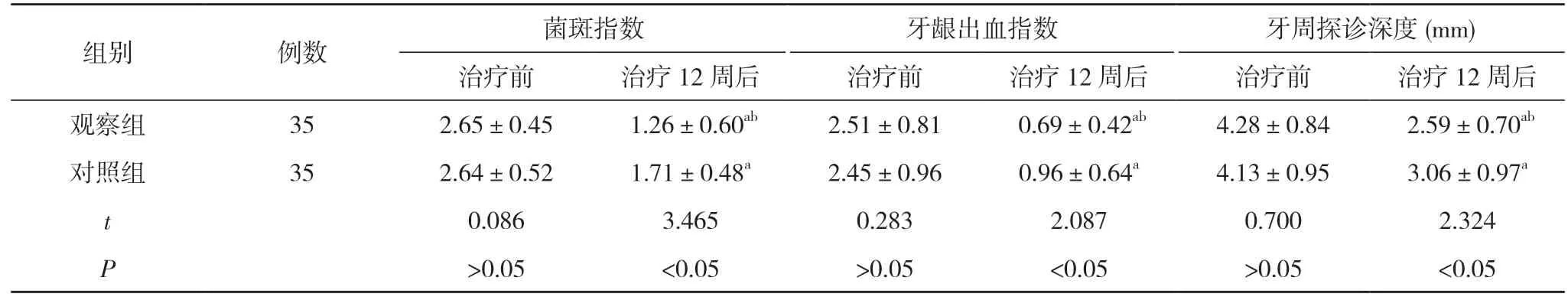
表1 两组患者治疗前后的菌斑指数、牙龈出血指数、牙周探诊深度比较()
注:与本组治疗前比较,aP<0.05;与对照组治疗12 周后比较,bP<0.05
3 讨论
慢性牙周炎是细菌感染性疾病,它的引发基本原因是菌斑微生物及其代谢产物,针对此最基本的治疗手段就是机械清除菌斑和牙石[1]。本研究结果显示,治疗前,两组患者的菌斑指数、牙龈出血指数、牙周探诊深度比较,差异无统计学意义(P>0.05);治疗12 周后,两组患者的菌斑指数、牙龈出血指数、牙周探诊深度均低于本组治疗前,且观察组患者的菌斑指数(1.26±0.60)、牙龈出血指数(0.69±0.42)、牙周探诊深度(2.59±0.70)mm 均低于对照组的(1.71±0.48)、(0.96±0.64)、(3.06±0.97)mm,差异具有统计学意义(P<0.05)。证实了牙周基础治疗的有效性。机械清除菌班和牙石以后,再用药物治疗作为辅助,就可以增强宿主的防御功能,阻断疾病进一步的破坏,促进牙周的组织愈合。在辅助药物选用上,对照组选用碘甘油辅助治疗,利用氧化细菌原浆蛋白的活性基团与氨基结合,使蛋白变性,从而达到杀菌消炎的目的。但由于碘甘油在牙周袋内难以停留较长时间,杀菌作用不持久,因此疗效不理想。根据国内外的经验,目前医学界大量研究利用缓释抗菌药物来治疗慢性牙周炎,普遍认为用缓释抗菌药物是比较合理的给药方式[3]。目前临床广泛应用的四环素、氯已定等缓释剂药物,抗菌作用较弱,易出现细菌耐药性。通常抗生素的耐药是由于细菌修饰抗生素作用的靶标蛋白,使相应酶灭活或将药物排出细胞外,从而降低细胞内的药物浓度[4]。而甲硝唑虽有良好的抗厌氧菌作用,但对胶原酶无抑制作用,不能广谱抑菌。本次研究中观察组选用抗菌多肽凝胶,其作用原理是作用于细菌细胞内特定靶点,与细胞膜通过静电作用相互吸附并结合,并进入胞内与内容物结合,抑制核苷酸和蛋白质的合成,干扰线粒体的功能,最后达到杀菌的目的[5,6]。在治疗口腔疾病时,抗菌药物必然会接触唾液,唾液含有电解质、黏液及多种酶,可以分解抗菌药物,而溶解于唾液的抗菌多肽表现出较强的活性[7],体外环境仍有广谱且高效的抗菌活性[8,9]。也就证实了本次研究观察组治疗后的疗效更显著的原因。
以生物膜方式生长的细菌,比游离悬浮的细菌更耐抗菌药物的作用[10]。抗菌多肽对多重耐药的细菌生物膜还表现出很强的活性[11,12]。有研究表明,抗菌多肽不仅能在细菌生物膜形成的早期进行干扰,防止细菌最初的粘附,还能通过促使微生物细胞脱离或杀死微生物细胞来破坏成熟的生物膜[13,14]。菌斑生物膜有利于细菌定植并迅速繁殖,加速牙周炎发展。也有研究证实,抗菌多肽通过抑制细菌粘附聚集到牙齿表面,可增加生物被膜顶部细菌表面运动,干扰细菌生长,从而分解成熟生物被膜[15,16]。可见抗菌多肽具有抑制细菌生物被膜生成的功效,以得到学者们的肯定。在机体遭受病原体感染时,抗菌多肽比免疫蛋白和免疫细胞反应更快、更灵敏[17]。对于原核生物细胞抗菌多肽产生特异的溶菌活性,对真核生物也有一定的杀伤力,而对人体正常的细胞则无损伤作用。在口腔内可直接分解代谢成机体能吸收利用的氨基酸,不良反应小[18]。
综上所述,牙周基础治疗后局部应用抗菌多肽凝胶,能有效的清除致病因素,药物辅助抗菌,凝胶的缓释技术可以长效维持口腔微生物环境,从而有效改善菌斑指数、牙龈出血指数、牙周探诊深度等临床指标。抗菌多肽凝胶为生物制剂,抗菌广谱且不产生耐药性,值得临床推广应用。

