不同手术时机肋骨环抱器手术对肋骨骨折大鼠预后影响的实验研究
马兵兵,王鹏国
(1.兵器工业五二一医院心胸外科,陕西 西安 710065;2.陕西省核工业二一五医院,陕西 咸阳 712000)
骨折是指骨的力学完整性遭到连续性中断或破坏,同时伴有局部软组织及血管的损伤。肋骨骨折为骨折的主要类型,也是比较严重的胸部损伤[1-2]。当前随着交通事故与工业受伤的发生频率日益增高,肋骨骨折的发生率也随之逐渐增加,已成为临床上常见的创伤性疾病之一[3]。手术为肋骨骨折的主要治疗方法,特别是当前微创手术具有创伤小、恢复胸廓的完整性和稳定性、复位稳定可靠、消除骨折断端的异常刺激等特点,但是也存在骨折愈合时间比较长等不足,为此在临床上多需要进行辅助治疗[4]。其中肋骨环抱器是一种可弯曲塑形的并环抱固定肋骨的内固定物,有利于快速固定肋骨骨折断端,在合适的温度下环抱器迅速恢复形状,从而牢固固定肋骨骨折[5-6]。同时现代研究表明骨折的愈合是骨组织多种生理因子共同参与的修复过程,也是由神经、体液共同调节的复杂过程,涉及到肉芽组织修复期、软骨痂形成期、硬骨痂形成期、骨痂重塑期等,然后让骨恢复原有结构形态[7]。由于骨折手术治疗过程中对骨组织生物学环境的改变,以及不同手术时机所导致的骨组织力学环境的变化可对骨折愈合产生一定的影响[8-9]。本研究具体探讨了不同手术时机肋骨环抱器手术对肋骨骨折大鼠的预后,希望明确肋骨环抱器的应用时机,为促进肋骨骨折愈合提供参考。
1 材料与方法
1.1 实验材料 清洁级健康10周龄雄性SD大鼠购自南京君科生物工程有限公司[体重(200±20)g,饲养于本院实验动物中心提供],饲养条件:空气相对湿度30%~40%,室温(22±2)℃,自由摄食水,12 h间隔照明,每周2~3 次更换垫料。动物许可证号SYXK832913,本实验符合本院动物保护委员会的要求。钛镍记忆合金环抱器购自泰州市宇杰医疗器械有限公司,纯钛爪形肋骨接骨板购自安徽中科中佳科学仪器有限公司。
1.2 肋骨骨折模型的制备 所有大鼠适应性喂养1周,10%的水合氯醛4 ml/kg腹腔注射麻醉大鼠。大鼠取俯卧位,在大鼠左耳下缘约2.5 cm左右,距脊柱中线约1.5 cm处作为切口部位,依次切开皮肤、皮下组织和深筋膜,暴露并固定肋骨,用眼科剪剪断成横行骨折,然后逐层缝合关闭创口。
将建模成功的肋骨骨折大鼠(n=54)随机平分为模型组、早期组与晚期组,根据肋骨横径、形状及长度选择合适的镍钛合金环抱器与纯钛爪形肋骨接骨板。早期组与晚期组分别在建模后1 d与3 d后将环抱器置于肋骨断端,固定环抱器两端,用45 ℃左右温盐水纱布握住放好的环抱器,环抱器可自动复原可固定在骨折处,消除反常呼吸、支撑塌陷的胸廓。模型组不进行环抱器手术处理。
所有大鼠在建模与手术过程中分笼放置,注意大鼠保暖。
1.3 观察指标 ①在术后第1周、第2周每组分别处死9只大鼠,以肋骨骨折区域为中心剪断肋骨及其相邻两根肋骨,拍摄X线片,测定与记录骨小梁宽度、骨小梁成骨指数。②对大鼠进行眼窝采血,分为三管。第一管不抗凝,静置30 min后3000 r/min 离心10 min,分离上层血清,采用酶联免疫法检测血清核因子kappaB受体活化因子配体(Receptor activator of NF-κB ligand,RANKL)与血清中骨保护素(Osteoprotegerin,OPG)含量。第二管进行抗凝,静置30 min后3000 r/min离心10 min,分离上层血浆,采用全自动生化分析仪检测血浆血管内皮生长因子(VEGF)与骨形态发生蛋白(BMP-2)含量。第三管进行抗凝,静置30 min后3000 r/min 离心10 min,分离下层全血细胞,采用流失细胞仪检测CD4+与CD8+T淋巴细胞含量。③去除骨折肋骨周围两根肋骨,剔除表面附着肌肉等软组织,在4%多聚甲醛溶液中固定,制成病理切片,观察骨折愈合情况。

2 结 果
2.1 病理情况比较 所有大鼠在手术过程中都生命体征稳定。模型组大量骨祖细胞及成纤维细胞分布在骨折区域,未见新生的骨小梁,大量炎细胞浸润。早期组骨小梁融合成片,骨基质形成,大量骨细胞沉积于骨基质中。晚期组出现软骨细胞及新生骨小梁,可见大量的成骨细胞与造血细胞灶。
2.2 三组术后不同时间点骨组织形态指标比较 见表1。早期组与晚期组的术后第1周、第2周骨小梁宽度、骨小梁成骨指数都高于模型组(均P<0.05),早期组高于晚期组(P<0.05)。

表1 三组术后不同时间点骨组织形态指标比较
2.3 三组术后不同时间点血清RANKL与OPG含量比较 见表2。早期组与晚期组的术后第1周、第2周的血清RANKL含量低于模型组(均P<0.05),血清OPG含量高于模型组(均P<0.05),早期组与晚期组对比差异也都有统计学意义(P<0.05)。
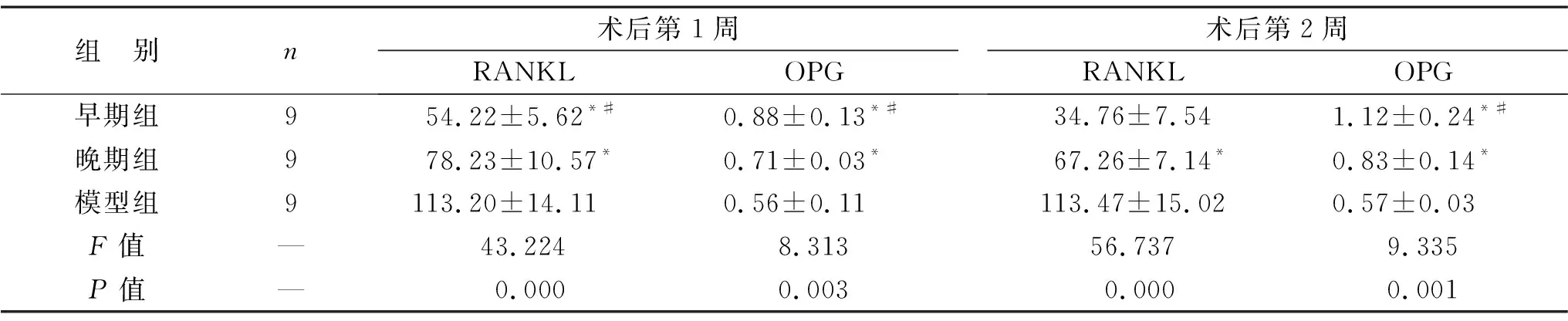
表2 三组术后不同时间点血清RANKL与OPG含量比较(pg/ml)
2.4 三组术后不同时间点血浆VEGF与BMP-2含量比较 见表3。早期组与晚期组的术后第1周、第2周的血浆VEGF与BMP-2含量高于模型组(均P<0.05),早期组高于晚期组(P<0.05)。

表3 三组术后不同时间点血浆VEGF与BMP-2含量比较(pg/ml)
2.5 三组术后不同时间点CD4+、CD8+T淋巴细胞比例比较 见表4。早期组与晚期组的术后第1周、第2周的CD4+T淋巴细胞比例高于模型组(均P<0.05),早期组高于对照组(P<0.05),三组不同时间点的CD8+T淋巴细胞比例对比差异无统计学意义(均P>0.05)。

表4 三组术后不同时间点CD4+、CD8+T淋巴细胞比例比较(%)
3 讨 论
肋骨骨折的发生,其在一定程度上可使局部胸壁失去完整肋骨支撑而软化,导致出现连枷胸,也可出现反常呼吸运动,诱发机体出现血胸、气胸等并发症,严重情况下可导致机体死亡。肋骨骨折的常见临床症状为局部疼痛,特别在咳嗽时疼痛更明显[10]。随着医学技术的发展与手术内固定器械的更新,手术治疗肋骨骨折及纠正连枷胸取得了很好的效果。本研究显示早期组与晚期组的术后第1周、第2周骨小梁宽度、骨小梁成骨指数都高于模型组(均P<0.05),早期组高于晚期组(P<0.05),表明肋骨环抱器早期手术在肋骨骨折大鼠的应用能促进骨折愈合。从机制上分析,钛镍合金是一种形状记忆合金,其可利用镍元素在温度变化下的记忆特性,具有很好的可塑性,塑形完成后迅速固定至肋骨骨折断端,从而牢固固定肋骨断端[11]。而早期手术的应用能尽早使得大鼠的胸廓畸形尽快恢复正常形状,促使大鼠尽快恢复呼吸功能,促使骨折断端骨膜内出现成骨反应,血管进入软骨骨痂,破骨细胞吸收钙化软骨[12-13]。
骨折的发生是一系列细胞和细胞因子相互作用,伴有大量的RANKL释放,也会抑制OPG的释放。骨折愈合的初期炎症期,由于骨折局部为低pH值和高乳酸浓度环境,是影响骨折愈合的重要因素。特别是骨折术后早期血肿形成,标志着炎性反应的开始[14]。RANKL由活化的T细胞、成骨细胞分泌,与RANK结合后可激活下游通路的表达,从而促进破骨前体细胞分化为破骨细胞[15]。OPG 属于肿瘤坏死因子受体家族成员,可竞争性的抑制RANKL与RANK结合,从而抑制骨吸收的发生。VEGF可与血管内皮细胞上的VEGF受体发生特异性结合,可以通过增加细胞外基质而进一步促进血管形成[16]。并且其也可通过与骨折断端的成骨细胞及周围软组织细胞上受体结合,改善骨折局部血运及缺氧状态,加速骨折断端局部坏死组织的移除,为骨折愈合提供营养物质及骨修复细胞[17]。BMP-2能诱导间充质细胞转化为软骨细胞,也可促进骨床再生,增加软骨和骨的合成,从而促进骨折愈合[18]。本研究显示早期组与晚期组的术后第1周、第2周的血清RANKL含量低于模型组(均P<0.05),血清OPG含量高于模型组(均P<0.05),早期组与晚期组对比差异也都有统计学意义(P<0.05);早期组与晚期组的术后第1周、第2周的血浆VEGF与BMP-2含量高于模型组(均P<0.05),早期组高于晚期组(P<0.05)。从机制上分析,环抱器具有生物相容性好、低导磁、应力遮挡率低等特点,其所产生的握持力可维持骨折断端稳定。在骨折术后早期进行应用能通过分泌细胞因子能够促进成纤维细胞的分化和血管形成,从而调节VEGF、BMP-2、RANKL、OPG的表达,促使成骨细胞形成新骨[19]。
人体的脊柱、胸骨、肋骨、肋软骨构成了骨性胸廓的框架,在正常的呼吸循环中提供着胸廓运动的灵活性。肋骨骨折可导致机体血胸和气胸等,如不采取积极的治疗措施,会引发失血性休克甚或死亡等[20]。T淋巴细胞在骨折愈合的炎症阶段与修复塑形阶段都发挥重要作用,其中CD4+T细胞、CD8+T细胞都可直接或间接作用于骨髓干细胞以及成骨细胞,调节骨稳态,从而影响着骨折愈合的过程[21-23]。本研究显示早期组与晚期组的术后第1周、第2周的CD4+T淋巴细胞比例高于模型组(P<0.05),早期组高于对照组(P<0.05),三组不同时间点的CD8+T淋巴细胞比例对比差异无统计学意义(均P>0.05),表明早期进行环抱器手术治疗能改善机体免疫反应,并使其处于平衡稳定状态,从而促进骨折预后。本研究也存在一定的不足,没有设置非手术治疗组,观察的时间点也比较少,将在后续研究中进行探讨。
总之,早期环抱器手术在肋骨骨折大鼠的应用能改善机体免疫反应,促进VEGF、BMP-2、OPG的释放,抑制RANKL的表达,从而促进骨折愈合。
——2015环抱创新创业大赛激活年轻创业群体

