骨髓间充质干细胞对大鼠骨质疏松股骨干骨折早期愈合影响的实验研究
李 鹏,佘新安,赵东军,张 勇,杨 鹏
(安康市中医医院骨科,陕西 安康 725000)
骨质疏松(Osteoporosis,OP)是以骨组织微细结构破坏、骨量减少导致骨折危险性增加的全身性与系统性骨骼疾病,多发病于女性,在临床上可伴随有股骨干骨折,已成为比较关注的公共卫生问题[1-2]。该病的治疗目的是通过提高成骨细胞成骨能力、降低破骨细胞的骨质吸收作用影响患者骨量[3-4]。西药治疗骨质疏松以激素为主,虽然有一定的近期疗效,但是停药后患者病情容易反复,且不良反应比较多。骨髓间充质干细胞(Bone mesenchymalstem cells,BMSCs)是成骨细胞的源头细胞,也是一种自我更新和多向分化能力的成体干细胞[5]。其具有易获得组织修复能力、容易培养扩增、低免疫原性、可移植性等特点,在特定条件下可以向成骨细胞分化,从而发挥成骨作用[6]。Notch基因的命名来自于一个果蝇双翅缺口的基因突变表现,Notch通路具有调节成骨细胞活性及功能的作用,可以通过与其他成骨信号通路交互作用发挥对机体成骨功能的抑制作用[7-8]。已有研究显示缺失Notch 基因的突变动物胚胎成骨细胞中B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)基因的表达水平较正常小鼠增高,从而引起成骨细胞过度增殖[9-10]。本研究具体探讨了BMSCs对骨质疏松大鼠股骨干骨折愈合的早期影响,并分析了相关机制,现报告如下。
1 材料与方法
1.1 实验材料 54只10周龄雌性Sprague-Dawley(SD)大鼠,体重为(240±20)g,购自南通特洛菲饲料科技有限公司,饲养于本院SPF动物实验中心提供。大鼠按分笼饲养(每笼6只),标准大鼠饲料喂养,定期清除笼内异物,动物饲养室温度在22~26 ℃,湿度在45%~55%,可自由饮食、饮水和活动。各种操作严格按照动物伦理学标准实施,研究得到了本院伦理委员会动物实验伦理相关审批。尼尔雌醇(批号:202014222),2%戊巴比妥钠(批号:2020184), 维甲酸(国药准字:H37022380),血清碱性磷酸酶(Alkaline phosphatase,ALP)测定试剂盒(上海生物工程医药有限公司),抗Bcl-2抗体、抗Notch1抗体购自美国BD公司,BMSCs保存于本实验室,胰蛋白酶、胎牛血清、低糖DMEM培养基(美国Gibco公司)。LUNAR Prodigy型双能X线骨密度仪购自美国GE公司LUNAR Prodigy型,AG-10KN型生物力学试验机购自日本岛津公司。
1.2 动物建模与分组 所有大鼠都采用维甲酸灌胃的方式制造骨质疏松模型,用维甲酸按照70 mg/(kg·d)的剂量连续灌胃21 d,停止灌胃后继续饲养30 d。股骨干、股骨颈任一部位骨密度<1.00 g/cm2表明建模成功。将建模成功的51只大鼠随机平分为三组:模型组、尼尔雌醇组与BMSCs组。模型组给予灌胃生理盐水,5 ml/kg,每周2次;尼尔雌醇组给予灌胃0.2 g/L的尼尔雌醇,5 ml/kg,每周2次;BMSCs组经尾静脉注入第三代BMMSCs约3×106个/只,1次/周。两组都治疗观察4周。
1.3 观察指标 ①在治疗后使用眼眶采血法采集大鼠血液1 ml,1500 r/min离心10 min后收集上层上清,-80 ℃冰箱保存,采用酶法检测血清ALP含量。②采血后处死大鼠,剔除附着于股骨的软组织,采用双能X线骨密度仪测定股骨干、股骨颈骨密度。③将股骨干在生物力学试验机上进行三点弯曲实验,压力500牛顿,压头速度5 mm/min,记录最大应力(M-STRESS)、最大承载力(M-LORD)等指标。④将右侧股骨干进行研磨,提取总蛋白,采用二喹啉甲酸(Bicinchoninic acid,BCA)方法定量蛋白质含量,跑SDS-PAGE电泳,每孔上样20 μg,转膜后3%脱脂奶封闭2 h,分别孵育Notch-1/Bcl-2和β-actin(内参蛋白)一抗,4 ℃孵育过夜,洗涤后然后孵育二抗1 h,显影后进行保存分析。
1.4 统计学方法 选择SPSS 23.00统计学软件对本研究进行分析,正态分布计量数据以均数±标准差表示,两两对比用LSD-t法,多组间对比采用单因素方差分析(ANOVA),检验水准α=0.05。
2 结 果
2.1 三组大鼠股骨干、股骨颈骨密度比较 尼尔雌醇组与BMSCs组的股骨干、股骨颈骨密度高于模型组(均P<0.05),BMSCs组高于尼尔雌醇组(P<0.05),见表1。

表1 三组大鼠股骨干、股骨颈骨密度比较(g/cm2)
2.2 三组大鼠血清ALP含量比较 尼尔雌醇组与BMSCs组的血清ALP含量低于模型组,BMSCs组低于尼尔雌醇组(均P<0.05),见表2。
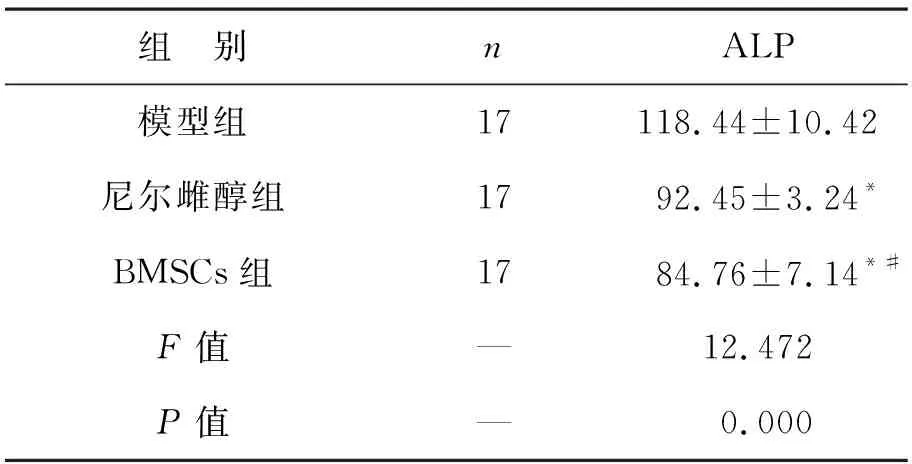
表2 三组大鼠血清ALP含量比较(U/L)
2.3 三组大鼠股骨干生物力学比较 尼尔雌醇组与BMSCs组的股骨干最大应力、最大承载力高于模型组(均P<0.05),BMSCs组高于尼尔雌醇组(均P<0.05),见表3。

表3 三组大鼠股骨干生物力学比较
2.4 三组大鼠股骨干Notch1、Bcl-2蛋白表达比较 尼尔雌醇组与BMSCs组的股骨干Notch1、Bcl-2蛋白相对表达水平低于模型组(均P<0.05),BMSCs组低于尼尔雌醇组(P<0.05),见表4。

表4 三组大鼠股骨干Notch1、Bcl-2蛋白相对表达水平比较
3 讨 论
骨质疏松是一种全身性、炎症性骨骼疾病,很多患者受到轻微外力影响就可发生骨折,股骨干为主要的骨折部位[11]。血清中50%左右的ALP来自于骨,当成骨细胞活跃,可见血清中ALP活性增高。测定骨密度是目前诊断骨质疏松与预测预后的重要指标,且具有重复性好、精确度较高等特点[12]。雌激素替代疗法是防治和治疗质骨质疏松的首选方案,雌激素的加入可抑制破骨细胞的形成,增加骨量减少,但长期使用雌激素类药物有一定的不良反应,且停药后患者容易复发。本研究显示尼尔雌醇组与BMSCs组的股骨干、股骨颈骨密度高于模型组(均P<0.05),BMSCs组高于尼尔雌醇组(P<0.05);尼尔雌醇组与BMSCs组的血清ALP含量低于模型组,BMSCs组低于尼尔雌醇组(均P<0.05)。从机制上分析,BMSCs是成骨细胞的前体细胞,在体内受多种因素调控下分化为成骨细胞,从而参与完成骨的形成[13]。并且BMSCs具有分化能力强、取材简便、来源充足等特点,从而有利于提高机体的血清ALP含量与骨密度[14-15]。
解决骨质疏松患者骨损伤愈合延迟的关键在于提高患者的成骨作用,BMSCs转化为成骨细胞途径是骨骼修复时成骨作用的重要来源[16]。骨生物力学为反映骨组织在外界作用下力学特征和骨在受力后的生物学效应,反映了整体骨的抗骨折能力,其中应力是指骨抵抗外力而不产生变形的能力,承载力是指骨抵抗外力破坏的能力[17-18]。本研究显示尼尔雌醇组与BMSCs组的股骨干最大应力、最大承载力高于模型组(均P<0.05),BMSCs组高于尼尔雌醇组(P<0.05)。从机制上分析,BMSCs可促进骨痂的形成,加快骨损伤的愈合过程。有研究表明,BMSCs能打破破骨细胞与成骨细胞的平衡,从而提高骨组织细胞的数量和质量,从而促进该区域的骨形成[19]。
Notch信号通路参与多种疾病的发生和发展,Notch-1是Notch受体的重要类型。Notch信号通路随后被激活,Notch-1表达增加,可进而激活下游靶基因[20]。有学者发现股骨干骨缺损小鼠模型行中Notch1表达量显著上升,特别是在Notch过表达的小鼠成骨细胞中,ALP活性显著降低[21]。Bcl-2也是成骨信号通络的关键因子,能够调节破骨细胞生成和活化[22]。本研究显示尼尔雌醇组与BMSCs组的股骨干Notch1、Bcl-2蛋白相对表达水平低于模型组(均P<0.05),BMSCs组低于尼尔雌醇组(P<0.05),表明BMSCs能抑制大鼠Notch1、Bcl-2蛋白的表达。当前也有研究显示BMSCs具有抑制破细胞活性,促使钙化骨形成增加等多种作用,可导致骨形成大于骨吸收,从而抑制继发性骨质疏松的发生[23-25]。本研究也存在一定的不足,通过骨密度值与生物力学测定很难全面反映股骨干骨折的早期愈合情况,可能存在误差,同时通过注射治疗难以保证BMSCs数量完全一致,将在后续研究中进行探讨。
总之,BMSCs在骨质疏松大鼠股骨干骨折中的应用能促进早期愈合,可抑制Notch1、Bcl-2表达,有利于降低血清ALP水平与提高骨密度,改善股骨干的生物力学状况。

