第二版前列腺影像报告和数据系统联合应用表观扩散系数在前列腺癌诊断中的价值研究
周理乾,马少君,樊国峰,樊民义
(陕西省人民医院放射科,陕西 西安 710068)
多参数磁共振成像(Multi-parameter MRI,mpMRI)在前列腺癌(Prostate cancer,PCa)早发现、早诊断、早治疗以及术后监测中具有重要作用,同时也促进PCa诊断和报告的标准化[1-3]。为了进一步加强前列腺检查程序、结果报告的规范化与标准化,2015年第二版前列腺影像报告和数据系统(Prostate imaging-reporting and data system version 2,PI-RADS v2)发布。该系统依据mpMRI图像上恶变可能性大小分为1~5分,评分越高,PCa可能性越大[4]。国内外多项研究[5-8]已证明其对PCa诊断的有效性,并能在一定程度上减少不必要的前列腺穿刺。但同时也存在一些局限性,如资深放射科医师和低年资放射医师的评分就难以完全一致[9-10],还有区分PI-RADS v2评分是3分或4分时较困难[11-13]。一般来说,定量参数可提高PI-RADS v2评分的准确性和可重复性,而表观扩散系数(Apparent diffusion coefficient,ADC)作为一种相对客观、可测量指标,在PCa诊断中应用也越来越多。有研究[14]表明ADC值可用于鉴别PCa和前列腺增生,多项研究[15-17]也表明ADC值与PCa Gleason评分(GS)呈负相关。对于如何运用ADC值和PI-RADS v2来诊断PCa,目前相关报告并不多。Park等[18]认为ADC(良/恶)比值>1.3与PI-RADS v2评分为4分的诊断效能等价,但未能解决ADC值的变化和PI-RADS v2评分之间的关系问题。Lin等[15]研究认为ADC直方图参数虽能提高PI-RADS v2对有临床意义PCa的诊断效能,却无统计学意义,也没验证对PCa的预测效能。基于此,本研究探讨ADC或分类联合PI-RADS v2在PCa诊断中的价值。
1 资料与方法
1.1 一般资料 病例均来源于陕西省人民医院2016年1月至2019年5月收治的PSA增高患者,共329例,其中年龄43~91岁,平均(71.99±7.99)岁;PSA 4.05~377.00 ng/ml,平均(39.32±65.36)ng/ml;前列腺体积17.55~420.48 cm3,平均(69.43±42.89)cm3;1个可疑病灶270例,2个可疑病灶53例,3个可疑病灶6例,共394个可疑病灶(329例)。病例纳入标准:①均行盆腔3.0 T mpMRI检查,有完整mpMRI影像学资料,包括有完整清晰的T2WI、DWI、DCE-MRI图像及近期PSA数据;②mpMRI检查后4周内行经直肠超声(TRUS)引导下12+X针系统性穿刺,且病理结果完整。排除标准:①mpMRI检查前3个月内有前列腺穿刺史;②既往有PCa病史或治疗史;③影像学图像不清晰或资料不完整。穿刺标本由病理科医师进行病理学诊断及组织学分级,采用Gleason 5级10分制,主要和次要分化程度区分评分后相加。本研究经医院伦理委员会审查同意。
1.2 检查方法 采用3.0 T飞利浦全数字磁共振,使用相控阵体部线圈进行检查。序列包括轴位和矢状位高分辨T2加权像(T2WI)、弥散加权成像(DWI)和动态对比增强(DCE)。DWI b值选择100×10-6mm2/s和1200×10-6mm2/s。ADC图在扫描结束后由本机后处理软件自动生成。DCE-MRI采用高压注射器静脉团注钆喷酸葡胺注射液0.1 mmol/kg,注射流速2.5 ml/s,注射完毕后用20 ml生理盐水以同样流速冲洗。按常规清洁肠道,膀胱充盈适当后进行检查。
1.3 观察指标 图像指标由2名工作5年以上高年资影像诊断医师单独阅片后获得。
1.3.1 ADC值:在可疑病灶最大层面选取一个感兴趣区域(ROI)。ROI包括至少50%病变区域,但不包括病变周边(避免包含正常组织)。ADC值为2名医师在相同病灶同一最大层面分别测量并平均后的结果。
1.3.2 PI-RADS v2评分:2名影像科医师分别对394个可疑病灶mpMRI图像进行评分,当评分不一致时协商至一致,仍不能达成一致的不纳入此次研究。PI-RADS v2评分标准:1分为肯定良性;2分为良性可能大;3分为良恶性无法鉴别;4分为恶性可能大;5分为极有可能恶性;外周带病灶评分取决于DWI评分,当DWI评分为3分且DCE曲线阳性(平台或流出型)时,PI-RADS v2评分升为4分。
1.4 统计学方法 采用SPSS 20.0和Stata 15.0统计学软件对数据进行分析。以穿刺病理作为金标准,绘制对PCa的受试者工作特征(ROC)曲线,根据最大约登指数得出ADC阈值为≤833.7×10-6mm2/s,然后参考相关文献[14,19]把ADC分为1类(ADC≤850×10-6mm2/s)和2类(ADC>850×10-6mm2/s)。使用Mann-WhitneyU检验对比PI-RADS v2评分、ADC值或分类在PCa组和良性组之间的差异。采用单因素Logistic回归对有差异的指标进行分析,并应用多变量二元Logistic回归对两个变量组合分别进行分析。使用ROC曲线分析联合指标和单独指标的诊断效能,并用Delong法两两比较其曲线下面积(AUC)差异。P<0.05为差异具有统计学意义。
2 结 果
2.1 PI-RADS v2评分和病理结果分布情况 394个病灶中,PI-RADS v2评分为2、3、4、5分的病灶数依次为69、105、94、126个;经穿刺病理证实为良性的病灶数依次为60、84、39、17个,证实为PCa的病灶数依次为9、21、55、109个;GS为6、7、8、9、10分的病灶数依次为46、74、47、21、6个。Spearman相关分析显示,ADC值与GS呈负相关(rs=-0.28,P<0.01)。
2.2 PI-RADS v2评分、ADC值及ADC分类单因素Logistic回归分析 见表1。PCa组和良性组PI-RADS v2评分、ADC值及ADC分类比较差异均有统计学意义(Z=11.82、-11.30、-11.07,均P<0.01)。单因素Logistic回归分析显示,PI-RADS v2评分、ADC值及ADC分类的OR值依次为4.10、1.00和13.02(均P<0.01)。

表1 PI-RADS v2评分、ADC值及ADC分类单因素Logistic回归分析
2.3 PI-RADS v2评分、ADC值及ADC分类多因素Logistic回归分析 见表2。多因素Logistic回归分析显示,联合模型为PI-RADS v2评分+ADC值时,PI-RADS v2评分和ADC值的OR值分别为3.1和1.0(均P<0.01);联合模型为PI-RADS v2评分+ADC分类时,PI-RADS v2评分和ADC分类的OR值分别为3.03和6.40(均P<0.01)。
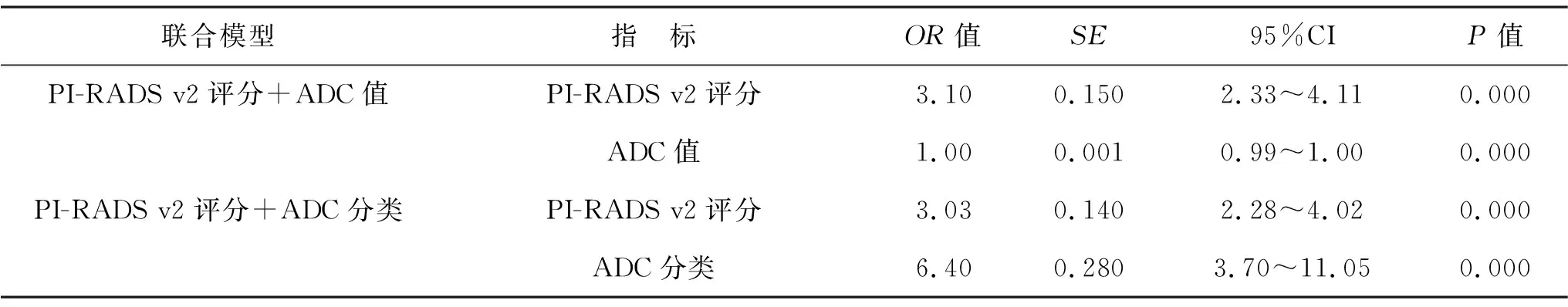
表2 PI-RADS v2评分、ADC值及ADC分类多因素Logistic回归分析
2.4 PI-RADS v2评分、ADC值及分类单独与联合对PCa的诊断效能 见表3。ROC曲线分析显示,PI-RADS v2评分+ADC值与PI-RADS v2评分+ADC分类的ROC AUC比较差异无统计学意义(Z=1.34,P=0.18)。PI-RADS v2评分+ADC值的AUC均高于两者单独情况及ADC分类(Z=4.08、3.41、6.28,均P<0.01)。同样,PI-RADS v2评分+ADC分类的AUC值均高于两者单独情况及ADC值(Z=3.83、6.29、2.32)。
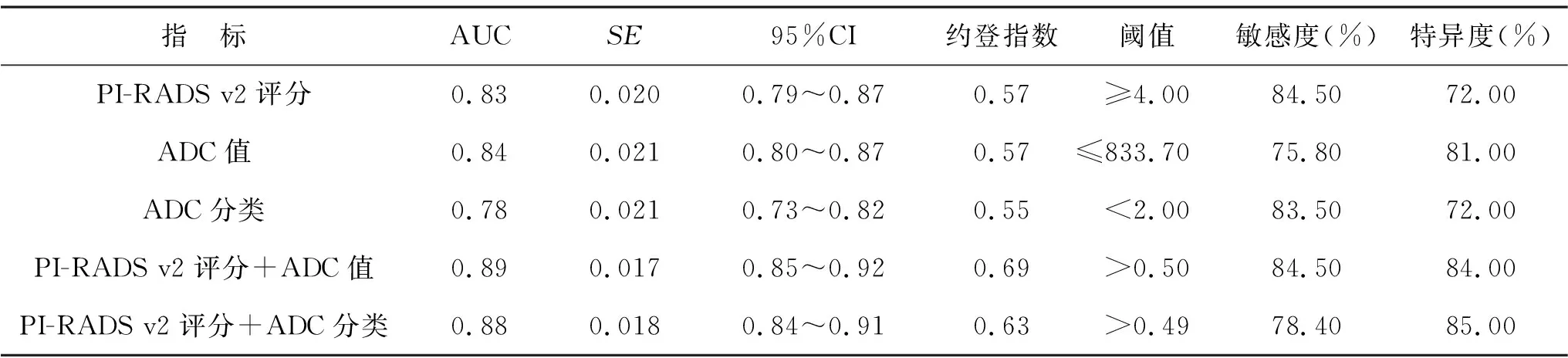
表3 PI-RADS v2评分、ADC值及分类单独与联合对PCa的诊断效能
2.5 PI-RADS v2评分联合ADC值或分类对外周带和移行带病灶的诊断效能 见表4。对于外周带和移行带PCa单独PI-RADS v2评分AUC值均低于PI-RADS v2评分+ADC值和PI-RADS v2评分+ADC分类(均P<0.01)。外周带PI-RADS v2评分+ADC值、PI-RADS v2评分+ADC分类以及单独PI-RADS v2评分AUC值与移行带对比,差异均无统计学意义(均P>0.05)。
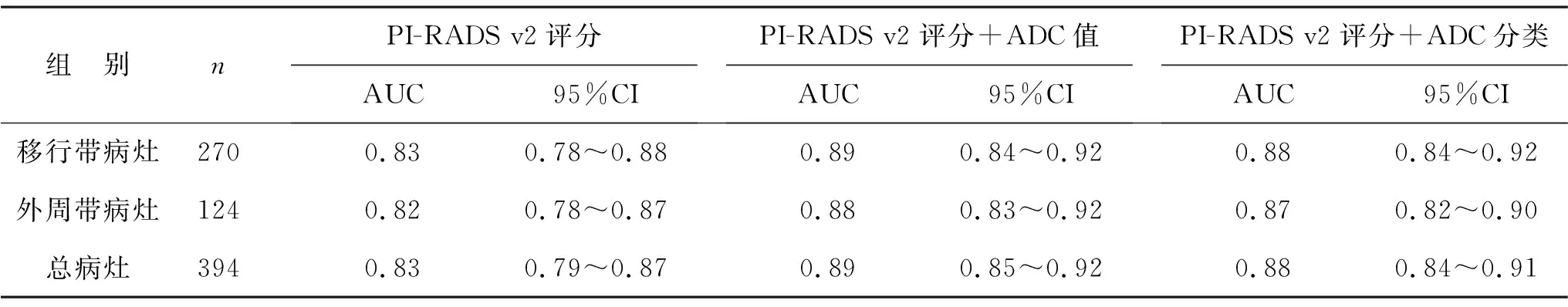
表4 PI-RADS v2评分联合ADC值或分类对外周带和移行带病灶的诊断效能
2.6 PI-RADS v2评分+ADC分类及PI-RADS v2评分中病理结果分布情况 见表5。PI-RADS v2评分为2、3、4、5分时,PCa阳性率依次为13.04%、20.00%、58.51%和86.51%。采用ADC值分层后,在ADC≤850×10-6mm2/s中,PCa阳性率依次为26.32%、38.71%、76.79%和91.18%;在ADC>850×10-6mm2/s组中,阳性率依次为8.00%、12.17%、31.58%和50.00%。PI-RADS v2评分+ADC分类在PI-RADS v2评分为4分时AUC值最大,为0.73;PI-RADS v2评分+ADC分类的部分ROC曲线下面积(pAUC)为0.12,为单独PI-RADS v2评分(0.04)的3倍。
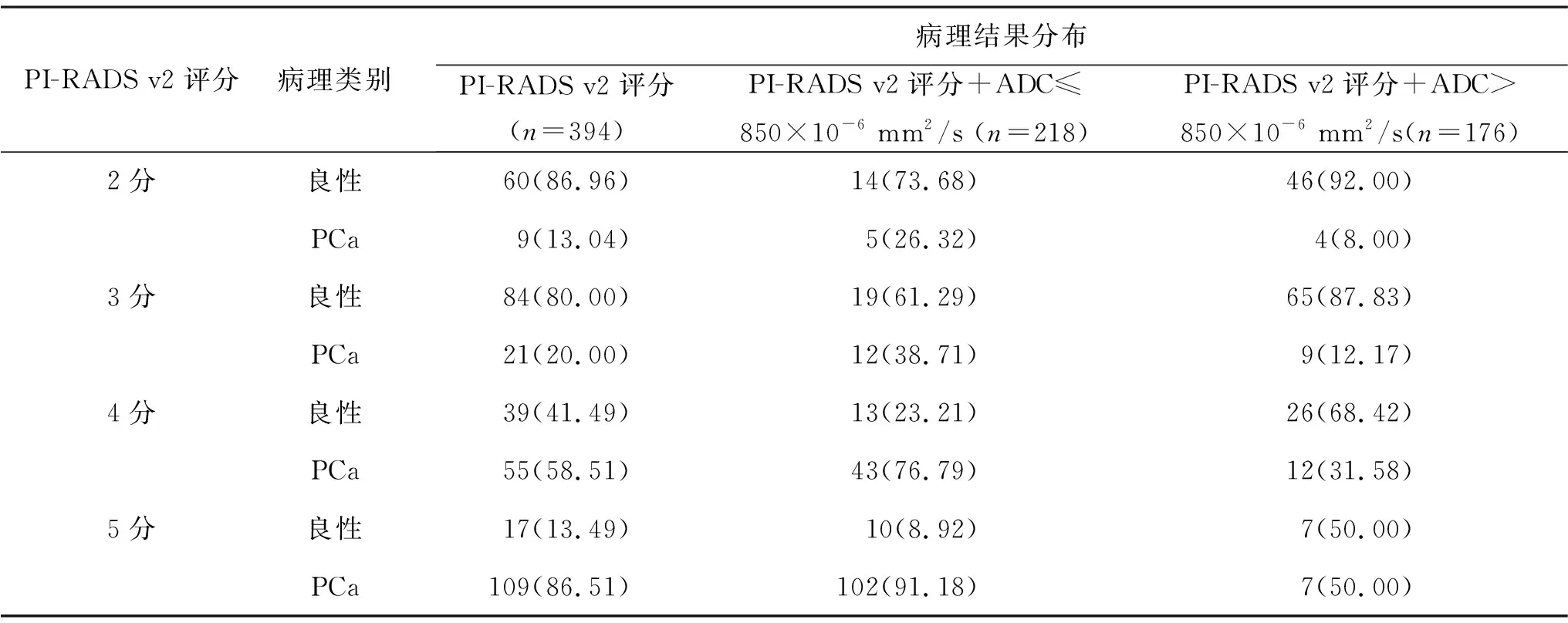
表5 PI-RADS v2评分+ADC分类及PI-RADS v2评分中病理结果分布情况[例(%)]
3 讨 论
目前,mpMRI诊断PCa比较可靠的序列主要包括DWI、ADC以及DCE等。2015年推出的PI-RADS v2是一种主要基于这三种序列的评估系统,也是区域主导序列的评分系统,即外周带病灶评分主要取决于DWI评分,移行带评分主要取决于T2WI评分[4]。ADC是对MRI图像上可疑病灶客观且可测量的重要指标,主要反映细胞增殖情况,却未被纳入PI-RADS v2评估系统,主要的原因可能是ADC值“不稳定性”,即病灶ADC值会随着扫描序列、磁体变化等而不同。但不能因此低估ADC值在PCa诊断中的重要作用。
ADC作为相对可测量的客观指标,可作为影像学意义上的“生物标志物”,不但能对病灶定位,还能协助定性。有研究[15]显示,随着病灶ADC值降低,发生PCa概率则逐渐增高。另外,ADC值与PCa GS呈负相关[15-17,20],本研究也有相似结果,其相关系数r=-0.28。ADC对PCa也有较好的诊断效能,能在一定程度上减少不必要穿刺[15,19,21-22]。Polanec等[22]研究发现,ADC对PCa有中等诊断效能,并可减少约33%的不必要穿刺。Jordan等[19]认为ADC可作为PCa的独立预测指标。由表2可知,本研究也有相似的结果。
PI-RADS v2不但对PCa有较高的诊断效能,也是独立预测指标[5-8]。Liu等[7]认为,PI-RADS v2不但是PCa和有临床意义PCa的独立预测指标,还可减少不必要的穿刺。方志伟等[5]研究发现,PI-RADS v2对PCa的ROC曲线下面积可达0.85,敏感性可达93%。本研究结果也显示,PI-RADS v2有中等的诊断效能(AUC=0.83)及较高的敏感度(84.50%),同样也是PCa的独立预测指标(P<0.01)。
为了保持PI-RADS v2系统简洁、便于应用等特点,本研究根据ADC预测PCa的“阈值”及相关文献[14,19]把ADC分为两类。虽然这个“阈值”与其他研究结果[19,21]不完全相同,却也在PI-RADS v2推荐范围之内[4]。本研究结果显示,采用ADC分类后,相较于ADC值,虽然诊断效能有所降低(AUC=0.78),但敏感度却有所增加(83.50%),ADC分类同样也是独立预测指标。因此,ADC分类不但保持了其简洁易用性,还有利于进一步的应用。
本研究目的在于评估ADC值或分类结合PI-RADS v2评分对PCa的预测效能。由表3可知,PI-RADS v2评分+ADC值和PI-RADS v2评分+ADC分类的AUC分别为0.89和0.88,明显高于单独PI-RADS v2评分、ADC值及ADC分类。因此,PI-RADS v2 评分联合ADC值或分类可明显提高对PCa的预测效能。这与Jordan等[19]有相似的结论,虽其讨论ADC值或分类联合PI-RADS v2评分可明显提高对有临床意义PCa的诊断效能,但考虑到ADC值的“阈值”为775×10-6mm2/s,而且ADC分类是以800×10-6mm2/s为分界,故也从另一方面证明ADC值或分类对PI-RADS v2评分的预测效能有提升作用。同时,ADC分类尤其帮助鉴别PI-RADS v2评分为4份的病灶。由表5可知,当PI-RADS v2评分+ADC分类在PI-RADS v2评分为4份时诊断效能最佳(AUC=0.73);进一步通过ROC曲线分析发现,PI-RADS v2评分+ADC分类的pAUC约为单独PI-RADS v2评分的3倍。故由此可知,ADC分类能提高PI-RADS v2评分对PCa的预测效能,对PI-RADS v2评分为4分的病灶尤其如此。
当PI-RADS v2评分为4分时,PCa阳性率较低[8,23-24]。Merino等[23]研究发现,PI-RADS v2评分为4分时PCa阳性率仅有29.8%。本研究结果显示,PI-RADS v2评分为4分时PCa阳性率为58.51%,与Hofbauer等[24]研究结果更接近。PI-RADS v2评分用于评估体积大于0.5 ml的病变准确性高,对于体积小于0.5 ml病灶则准确性低[25]。而PI-RADS v2评分为4分的病灶,其直径均小于1.5 cm[4],故这可能是PI-RADS v2评分为4分病灶PCa阳性率较低的原因。又由于病灶ADC值越低,PCa发生可能性越高[15],所以通过ADC分类对其分层后,PCa阳性率会明显提高(达76.79%)。
综上所述,ADC值或分类可明显提高PI-RADS v2评分对PCa的预测效能,尤其对PI-RADS v2评分为4分的病灶。但本研究存在一些不足之处:①本研究病例来源单一(住院或门诊患者)且为非连续性收集,采取的是回顾性分析方法,故难以避免选择性偏倚。将来的研究可采用连续收集、多中心病例来验证其有效性。②病例均采取直肠超声引导下的12+X针系统性穿刺,且均为首次穿刺,故在一定程度上存在漏诊可能和GS不够准确等,后续研究可采取其他穿刺方式[26]提高穿刺准确性。③本研究ADC分类选取850×10-6mm2/s作为“阈值”可能不具推广性。由于病灶ADC值随着扫描参数、序列及磁体的变化而变化,故还需大样本量研究来佐证。④对前列腺可疑病灶进行PI-RADS v2评分时,不同阅片人之间存在差异[12],也需要进一步加强评分标准化培训。

